





化学选修4 化学反应原理第一单元 化学反应中的热效应说课课件ppt
展开问题讨论: 化学研究的目的是什么?
通过反应可以获得新物质也可以获得能源(化学反应中伴随着能量变化)
如何表示化学反应中的能量变化呢?
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热.
符号: ΔH ,单位:kJ/ml 或 kJ•ml-1
在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变
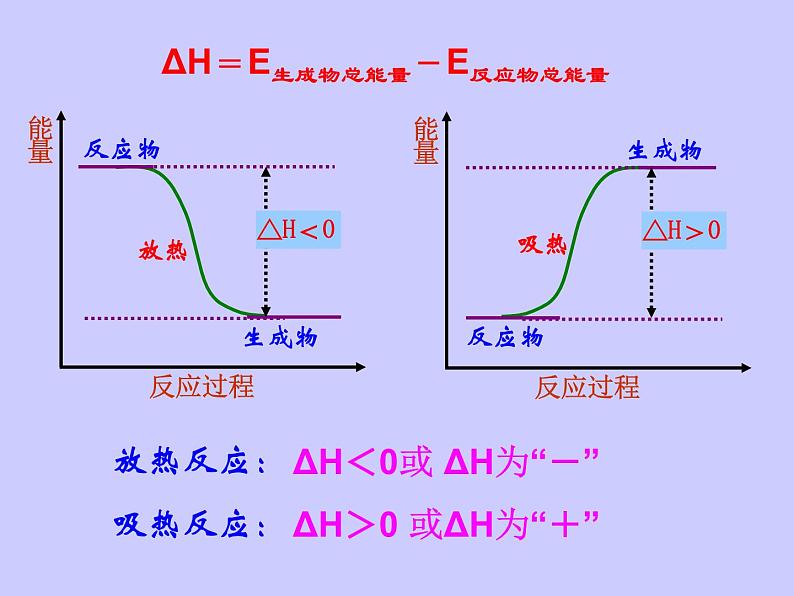
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
ΔH=E生成物总能量-E反应物总能量
规 律: E反:反应物的能量之和 E生:生成物的能量之和
(1)若E反> E生,
(2)若E反< E生,
反应热:△H = E生- E反 吸热反应:△H >0或者ΔH为“-” 放热反应:△H <0或者ΔH为“+”
化学反应中 热量的反应
常见的放热反应和吸热反应
燃料的燃烧中和反应金属与酸大多数化合反应
C+CO2 , H2+CuOC+H2OBa(OH)2.8H2O+NH4ClCaCO3高温分解大多数分解反应
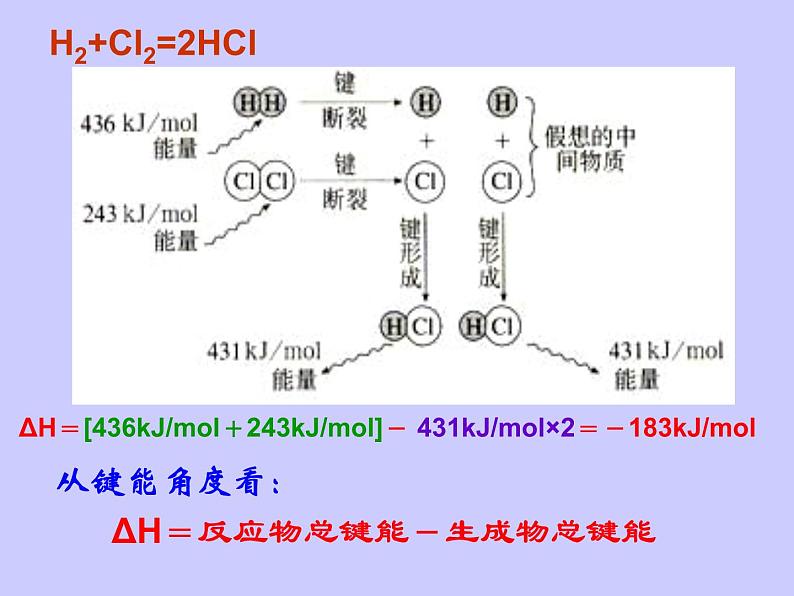
H2+Cl2=2HCl
ΔH=反应物总键能-生成物总键能
ΔH=[436kJ/ml+243kJ/ml]- 431kJ/ml×2=-183kJ/ml
△H=E(生成物总能量)- E(反应物总能量)
△H=反应物总键能 - 生成物总键能
温馨告白:化学反应中的能量变化,主要表现为热量变化,但还有光能、电能转化为热能等释放出来,或者是热能、电能或光能等转化为物质内部的能量(化学能)被“储存”起来的过程。
二、热化学方程式: 1、概念:能够表示反应热的化学方程式叫做热化学方程式。
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/ml
(1)写出化学方程式(2)注明反应物和生成物的状态(3)标明焓变△H (注意化学计量数单位和+、-)☆要注明反应的温度和压强(一般不 注明,为一个大气压,25 0C)
(4)热化学方程式中各物质前的化学计量数表示物质的量不表示 分子数,因而必要时可用简单分数。一般出现分数时是以某一 反应物或生成物为“1ml”时其它物质才出现的。
H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/ml
(5) △H的表示:热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热无论热化学方程式中化学计量数为多少,△H的单位总是KJ/ml,但△H的数值与反应式中的系数成比例
(6)当化学反应逆向进行时, △H数值不变,但符号相反.(7)可逆反应中的△H数值是指该反应完全进行时的数值.
写出下列反应的热化学方程式:
1.已知在1×105Pa,298K条件下,2ml氢气燃烧生成水蒸气放出484kJ热量,
2.已知在25℃、101kPa下,1g C8H18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
2H2(g)+O2(g)=2H2O( g ); ΔH=-484kJ·ml-1
C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(l) △H= - 5518kJ·ml -1
3.46g C2H5OH (l)完全 燃烧生成CO2 (g) 和H2O (l) ,放出1366.8KJ热量。
C2H5OH (l) + 3O2(g)= 2CO2(g) +3H2O(l) △H= - 1366.8KJ·ml -1
练习巩固: 已知键能: N≡N 946KJ/ml, H-H 436KJ/ml, H-N 391KJ/ml,写出合成氨反应的热化学方程式。
3.热化学方程式的意义
1)表示什么物质参加反应,结 果生成什么物质
2)反应物和生成物之间的质量 比、物质的量比
3)反应物完全变成生成物后所 放出或吸收的热量。
1、下列说法不正确的是 ( ) A、化学反应除了生成新物质外,还伴随着 能量的变化 B、放热反应不需要加热即可发生 C、需要加热条件的化学反应都是吸热反应 D、化学反应是吸热还是放热决定于生成物具有 的总能量和反应物具有的总能量 E、分解反应肯定是吸热反应 F、物质燃烧放出热量
2、氢气在氧气中燃烧产生蓝色火焰,已知破坏1mlH-H键消耗的能量为Q1kJ,破坏1mlO = O键消耗的能量为Q2kJ,形成1mlH-O键释放的能量为Q3kJ。下列关系式中正确的是( ) A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3 C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3
3、在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )A.H2(g)+Cl2(g)=2HCl(g); △H1 =-Q1 1/2H2(g)+1/2Cl2(g)=HCl(g); △H2=-Q2B.C(s)+1/2O2(g)=CO (g); △H1=-Q1 C(s)+O2(g)=CO2 (g); △H2=-Q2C.2H2(g)+O2(g)=2H2O(l); △H1=-Q1 2H2(g)+O2(g)=2H2O(g); △H2=-Q2D.S(g)+O2(g)=SO2 (g); △H1=-Q1 S(s)+O2(g)=SO2 (g); △H2=-Q2
4、 1ml C与1ml 水蒸气反应生成1ml CO 和1ml H2,需要吸收 131.5 kJ的热量。写出此反应的热化学方程式。
高中苏教版 (2019)第一单元 化学反应的热效应教学课件ppt: 这是一份高中苏教版 (2019)<a href="/hx/tb_c4009310_t3/?tag_id=26" target="_blank">第一单元 化学反应的热效应教学课件ppt</a>,共33页。PPT课件主要包含了反应热与焓变,热化学方程式,从微观角度分析,典型例题,考题体验,标准燃烧热,例题体验,中和热等内容,欢迎下载使用。
化学选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应完整版ppt课件: 这是一份化学选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应完整版ppt课件,共21页。PPT课件主要包含了思考探究·一,习题探究,作业布置等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件,共28页。PPT课件主要包含了Qcm△t,随堂小练等内容,欢迎下载使用。













