





- 1.1.2热化学方程式、燃烧热课件PPT 课件 0 次下载
- 1.2 反应热的计算课件PPT 课件 0 次下载
- 2.1.1 化学反应速率 影响化学反应速率的因素课件PPT 课件 5 次下载
- 2.1.2 活化能课件PPT 课件 1 次下载
- 2.2.1 化学平衡状态 化学平衡常数课件PPT 课件 2 次下载
高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件
展开【回顾】化学反应有哪些特征?
化学反应在生成新物质的同时,还伴随着能量的变化。而且能量转化形式是多样的。化学反应既遵守质量守恒定律,也遵守能量守恒定律。
(1)所有燃烧 (2)中和反应 (3)活泼金属与水、酸反应(4)大多数化合反应 (5)缓慢氧化(6)铝热反应
(1)大多数分解反应 (2)C与CO2/H2O (3)铵盐与碱(4)碳酸氢钠+盐酸
在实际应用中,人们如何定量地准确描述化学反应过程中释放或吸收的热量呢?
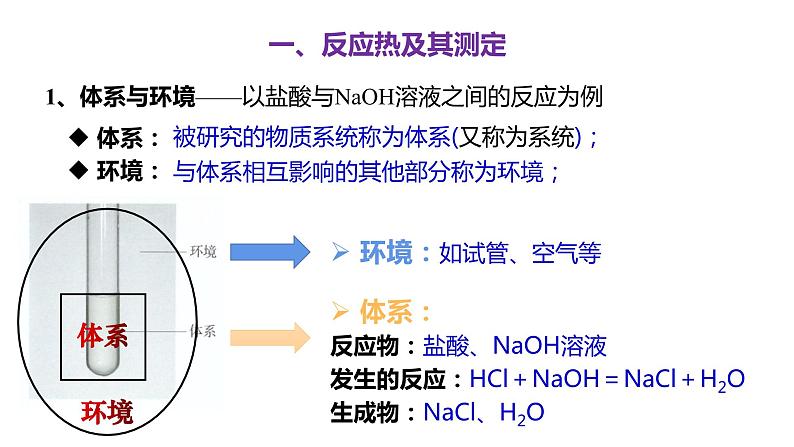
被研究的物质系统称为体系(又称为系统);
与体系相互影响的其他部分称为环境;
体系:反应物:盐酸、NaOH溶液发生的反应:HCl+NaOH=NaCl+H2O生成物:NaCl、H2O
1、体系与环境——以盐酸与NaOH溶液之间的反应为例
2、体系与环境的热量交换——反应热
②直接测定反应热的方法:
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:即反应前后体系的温度相等。
用温度计测量反应前后体系的温度变化,根据测定体系的温度变化和有关物质的比热容等来计算反应热
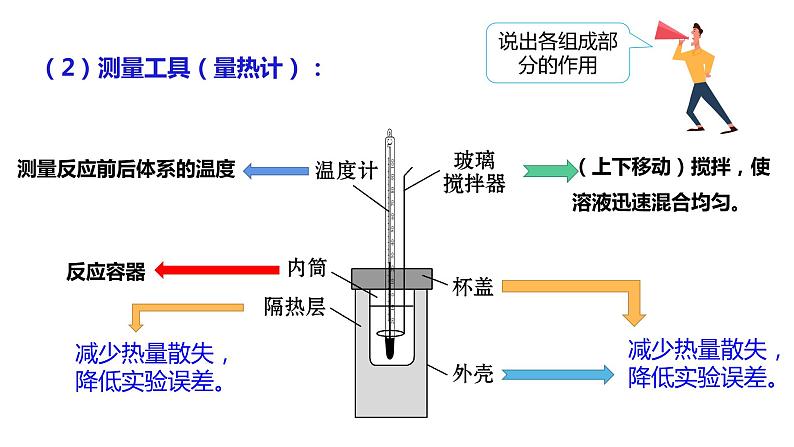
(1)实验原理: 在测定中和反应的反应热时,应该测量哪些数据? 如何根据测得的数据计算反应热?
Q:中和反应放出的热量 m:反应混合液的质量C:反应混合液的比热容 Δt:反应前后溶液温度的差值
3、【探究】中和反应反应热的测定
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50 mL0.50 ml/L盐酸的质量m1=50 g, 50 mL0.55 ml/L NaOH溶液的质量m2=50 g②反应后生成的溶液的比热容c=4.18 J/(g . 0C)。
(上下移动)搅拌,使溶液迅速混合均匀。
测量反应前后体系的温度
减少热量散失,降低实验误差。
(2)测量工具(量热计):
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?2.实验中是否可以更换温度计?3.能否测完酸后直接测量碱的温度?那如何操作?4.能否将NaOH分多次倒入热量计中?5.为什么NaOH的浓度稍稍比酸大?6.玻璃搅拌棒能否用金属搅拌棒代替?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
为了保证盐酸完全被中和
不能,操作时动作要快,尽量减少热量的散失
不能。原因是金属质搅拌器易导热,造成热量损失。
不能。浓硫酸溶解于水时放热,所测数值会偏大。
某小组用50 mL 0.5 ml·L-1的盐酸与50 mL 0.55 ml·L-1的NaOH溶液进行实验。取三次测量所得温度差的平均值作为计算依据。
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1, 则反应放出的热量Q=(m酸+m碱)﹡c﹡(t2-t1)≈ kJ,那么生成1 ml H2O放出的热量为= 。
特别提醒:大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 ml H2O时,放出57.3 kJ的热量。
(5)问题与讨论: 上述过程中,提高测定反应热准确度的措施有哪些?
①反应物:a.用强酸强碱的稀溶液; b.准确配制浓度,且NaOH溶液浓度稍大于盐酸;②减少热量损失:a.量热计保温隔热; b.不能用铜制搅拌器代替玻璃搅拌器; c.酸碱混合要迅速,并盖上盖子;③仪器:a.温度计测定一种溶液后洗净擦干再测别的溶液; b.不能用同一个量筒量取酸碱;④重复三次,减小误差。
二、中和反应热(简称中和热)
在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 ml H2O(l)的反应热。
(4)浓酸和浓碱溶液稀释会放热,中和热偏大
(3)弱酸弱碱电离吸热,中和热偏小
(1)中和热与酸、碱的用量无关。
(2)不是所有的中和反应放出的热都叫中和热
要点:(1)条件:稀溶液(2)(强)酸与(强)碱(3)生成1ml液态水。若反应过程中有其他物质生成,这部分反应热也不在中和热之内(4)放出的热量:57.3kJ
1、下列有关中和反应反应热测定实验的说法正确的是(已知弱酸电离吸热)( )A.使用玻璃搅拌器是为了加快反应速率,减小实验误差B.为了准确测定反应混合溶液的温度,实验中中温度计水银球应与内筒底部接触C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度D.用0.55ml/LNaOH溶液分别与0.50ml/L的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应反应热的绝对值相同
2.当50 mL 0.50 ml/L盐酸与50 mL 0.55 ml/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。(2)烧杯间填满碎纸条的作用是 。(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
减少实验过程中的热量损失
(4)实验中改用60 mL 0.50 ml/L盐酸跟50 mL 0.55 ml/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由 : (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
因为中和热是指酸跟碱发生中和反应生成1ml H2O所放出的能量,与酸碱的用量无关
化学反应过程中为什么会产生反应热?为什么有的化学反应释放热量,有的化学反应吸收热量?
【分析】因为反应前后体系的内能(符号为U)发生变化。
(1)内能(U):体系内物质的各种能量的总和,受温度、压强、物质的聚集状态等影响。能量越低,物质越稳定。
【思考】在科学研究和生产实践中,化学反应通常是在等压条件下进行的。如何描述等压条件下的反应热?
(2)焓:符号为 H焓是物质所具有的能量,与内能有关的物理量(只有正值)
(3)焓变(符号为△H): ①定义: ②数学表达式: ③常用单位: ④与反应热关系:
生成物的总焓与反应物的总焓之差称为焓变。
△H=H(生成物)-H(反应物)
kJ/ml(或kJ·ml-1)
等压条件下进行的化学反应,反应热等于焓变。
【例题1】在250C和101 kPa下,1 mlH2与1 ml Cl2反应生成2 ml HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= - 184.6 kJ/ml
【例题2】在250C和101 kPa下,1 ml C(如无特别说明,C均指石墨)与1 ml H20(g)反应,生成1 ml CO和1 ml H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= + 131.5 kJ/ml
【练习】请用△H表示出中和热的准确值?
ΔH = - 57.3 kJ/ml
【注意】ΔH右端的+或-不可省略,单位kJ/ml必须标出。
放热反应,焓减小,ΔH<0吸热反应,焓增大,ΔH>0
(1)反应物与生成物总能量变化(宏观)
ΔH=E(生成物)—E(反应物)
放热反应,△H为“-”,即△H < 0,
反应体系对环境放热,其焓减小
吸热反应,△H为“+”,即△H > 0,
反应体系从环境吸热,其焓增大
放热反应( ΔH<0 )
放热反应 ( ΔH>0 )
(2)化学键的键能变化(微观)
∆H=E(反应物总键能)—E(生成物总键能)=Q吸-Q放
化学反应的实质:旧键的断裂(吸热),新键的形成(放热)。
(1)ΔH>0 →吸热反应,ΔH<0 → 放热反应(2) ΔH=E(生成物总能量)—E(反应物总能量)(3)∆H=E(反应物总键能)—E(生成物总键能)=Q吸-Q放
【例题】断开 1ml H-H键、1ml N-H键、1ml N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1ml N2生成NH3的反应热为 ,则1ml H2生成NH3的反应热为 。
-92.0 kJ/ml
-30.67 kJ/ml
(4)应用:物质稳定性判断
①物质键能越高,越稳定
②物质总能量越低,越稳定。
【例题】C(石墨 s) = C(金刚石 s) ΔH = +1.9kJ/ml,石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
∆H > 0,吸热反应,石墨键能大,总能量低,更稳定。
1、下列说法正确的是( )A.反应热是1ml物质参加反应时的能量变化B.当反应放热时△H>0,反应吸热时△H<0C.任何条件下,化学反应的焓变都等于化学反应的反应热D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定
2、下列反应既属于放热反应,又属于氧化还原反应的是( )A.Ba(OH)2溶液与硫酸溶液反应B.铝片与稀硫酸反应C.灼热的炭与CO2反应D.NH4Cl固体与Ba(OH)2·8H20晶体反应
3、SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 ml S(s)转化为气态硫原子吸收能量280 kJ,断裂1 ml F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH 为( )A.-1 780 kJ·ml-1 B.-1 220 kJ·ml-1C.-450 kJ·ml-1 D.+430 kJ·ml-1
4、如下图所示,△H1=-393.5kJ/ml,△H2=-395.4kJ/ml,下列说法或表示式正确的是( )A.金刚石与氧气反应生成二氧化碳是吸热反应B.石墨和金刚石的转化是物理变化C.石墨的稳定性比金刚石强D.1ml石墨的总键能比1ml金刚石的总键能小1.9kJ
5、反应 A+B= C(ΔH<0)分两步进行: ①A+B→ X(ΔH>0) ②X→C(ΔH<0)。下列图中能正确表示总反应过程中能量变化的是( )
高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt,共35页。PPT课件主要包含了学习目标,课前导入,知识点一,反应热及其测定,体系与环境之间,1定义,2分类,敞开体系系统,封闭体系系统,孤立体系系统等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热精品课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热精品课件ppt,共29页。PPT课件主要包含了能力提升等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt,共51页。PPT课件主要包含了第一节反应热,知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业一,课后作业等内容,欢迎下载使用。













