



高中化学苏教版选修4 化学反应原理第一单元 化学反应中的热效应课文内容ppt课件
展开在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。符号:单位:
一、反应热 焓变定义:化学反应过程中所吸收或放出的热量 称为化学反应的反应热。
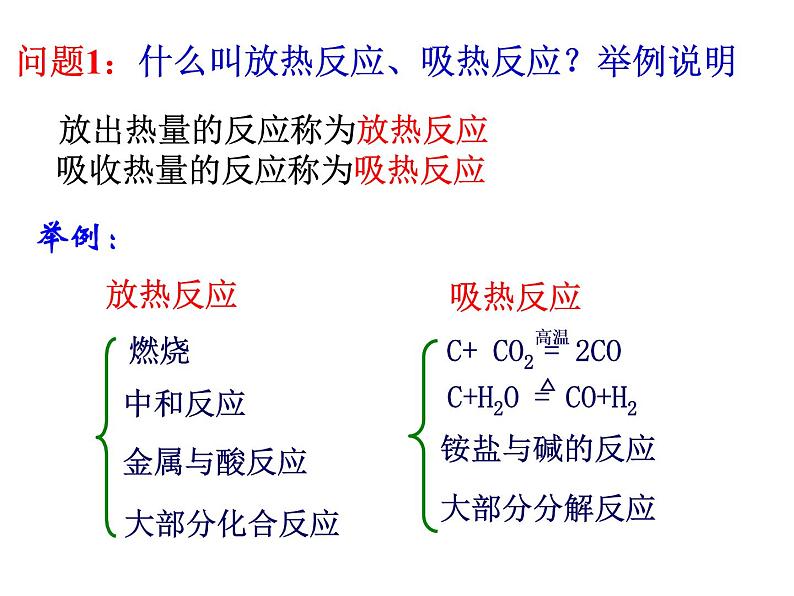
问题1:什么叫放热反应、吸热反应?举例说明 放出热量的反应称为放热反应 吸收热量的反应称为吸热反应
2、下列变化中,属于吸热反应的是( ) A.氮气与氢气合成氨 B.酸碱中和 C.二氧化硫与氧气反应生成三氧化硫 D.焦炭与高温水蒸气反应
[练习]1、下列变化中,属于放热反应的是( ) A.Ba(OH)2·8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧 C.灼热的碳与二氧化碳的反应 D.氯化铝的水解
问题2:反应中为什么会有能量的变化?
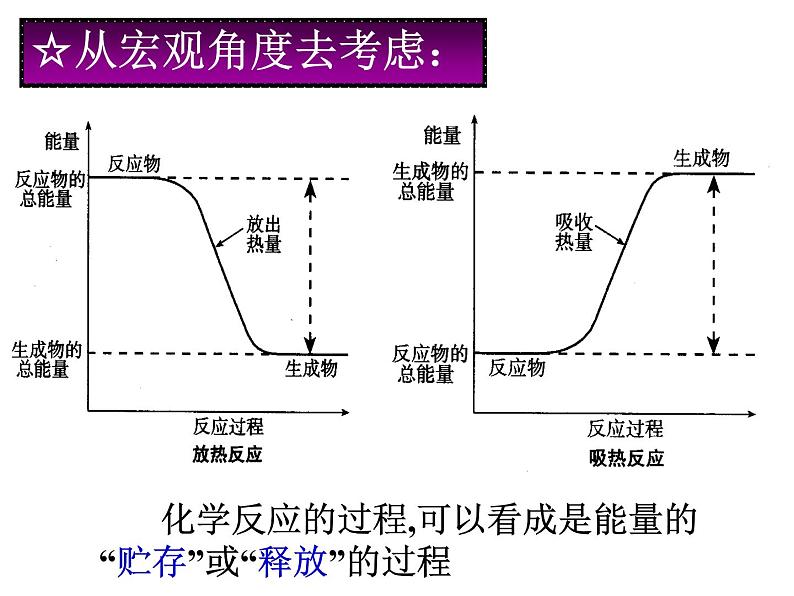
化学反应是放出热量还是吸收热量,与反应物和生成物的能量有关。请思考化学反应的能量变化与反应物和生成物的能量存在什么关系?
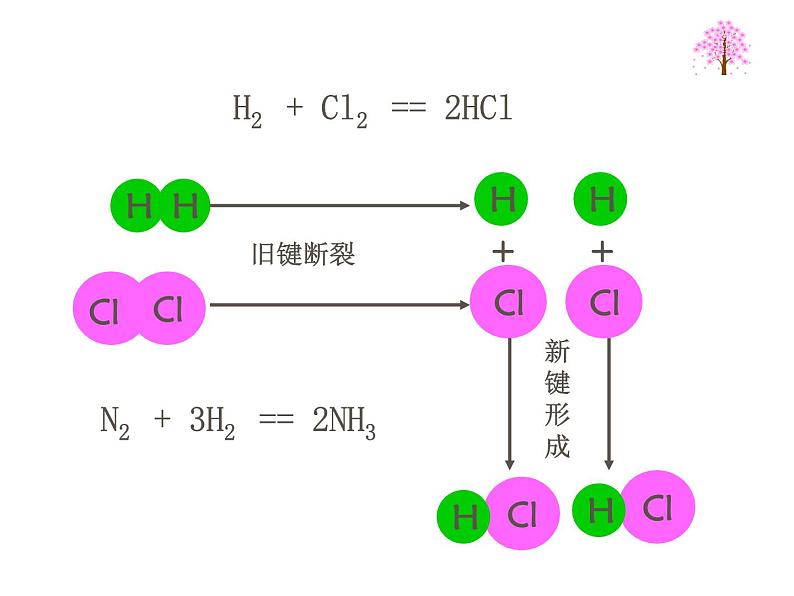
化学反应本质上是旧的化学键断裂、新的化学键形成的过程。请思考键的断裂与形成过程中能量的变化与化学反应中能量的变化有何关系?
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
H2 + Cl2 == 2HCl
N2 + 3H2 == 2NH3
旧键的断裂 新键的形成
已知:1ml H-H键断裂时吸收436.4kJ的能量
∑E吸=436.4kJ +242.7kJ=679.1kJ
∑E放=431.8kJ×2=863.6kJ
1ml Cl-Cl键断裂时吸收242.7kJ的能量
1ml H-Cl键形成时放出431.8kJ的能量
通过计算判断此反应是吸热反应还是放热反应?
∑E放 -∑E吸= 863.6kJ - 679.1kJ=184.5kJ
1mlH2和1mlCl2反应生成2mlHCl时放出184.5kJ热量
2mlH2和2mlCl2反应生成4mlHCl时放出 热量
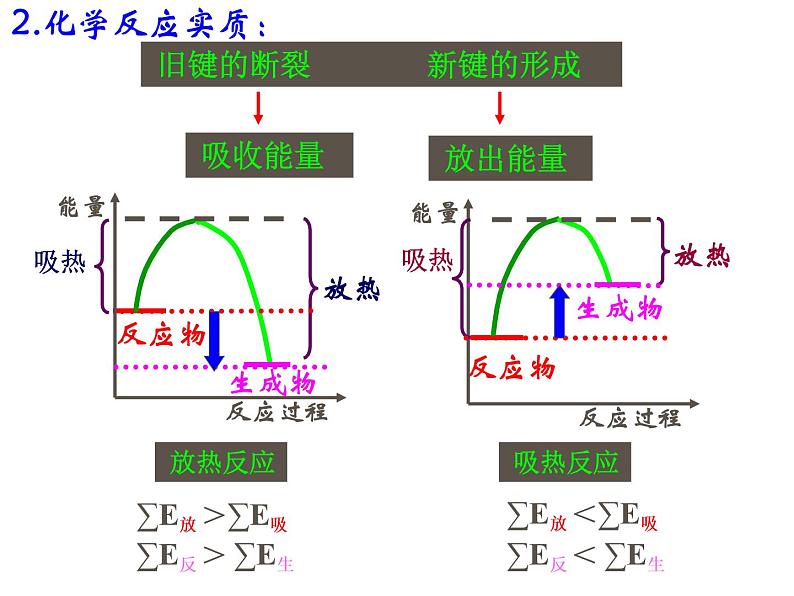
1.化学键断裂,吸收能量;化学键生成,放出能量
反应物总能量小于生成物总能量,吸热反应, 体系能量升高,
H2(g) + Cl2(g)==2HCl(g) △H = - 184.6kJ/ml
1、定义:表明反应放出或吸收的热量的化学方程式
观察以下热化学反应方程式,你发现了什么?
2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/ml2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/ml
结论:同种物质聚集状态不同,能量不同
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mlH2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/ml
△H 的值与化学计量数成正比
化学计量数只表示物质的量,可用分数
不注明的指101kPa和25℃(298K)时的数据
2)要注明反应物和生成物的聚集状态
2、书写热化学方程式的注意点
1)用△H表示反应热,单位是kJ/ml ,△H的正、负一定要注明, “+”代表吸热, “-”代表放热
3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因而必要时可用简单分数。 △H的数值与反应式中的系数成比例
H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/ml
“ g”表示气体,“l”表示液体,“s”表示固体,“aq”表示溶液
下列热化学方程式书写正确的是
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mlB.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJC.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mlD.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/ml
1)每1ml碳完全燃烧生成二氧化碳时将放出393.6kJ
C + O2 == CO2
CH4(g) + 2O2(g) = CO2(g) + H2O(l) △H=-889.6kJ/ml
写出下列反应的热化学方程式
(s) (g) (g)
△H=-393.6kJ/ml
2)1ml水蒸汽分解产生氢气与氧气时吸收242kJ热量
2H2O == 2H2 + O2
(g) (g) (g)
△H=+484kJ/ml
1、在同温同压下,下列各组热化学方程式中Q2>Q1的是( )A. H2(g)+Cl2(g)=2HCl(g) △H= -Q1 1/2H2(g)+1/2Cl2(g)=HCl(g) △H= -Q2B. C(s)+1/2O2(g)=CO (g) △H= -Q1 C(s)+O2(g)=CO2 (g) △H= -Q2C. 2H2(g)+O2(g)=2H2O(l) △H= -Q1 2H2(g)+O2(g)=2H2O(g) △H= -Q2D. S(g)+O2(g)=SO2 (g) △H= -Q1 S(s)+O2(g)=SO2 (g) △H= -Q2
在相同条件下,比较下列热化学方程式
2、已知在1×105Pa,298K条件下,2ml氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·ml-1B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·ml-1C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·ml-1D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·ml-1
2022-2023 高考化学 核心知识 专题7 化学反应的热效应课件PPT: 这是一份2022-2023 高考化学 核心知识 专题7 化学反应的热效应课件PPT,共8页。PPT课件主要包含了构建核心脑图等内容,欢迎下载使用。
2022-2023 高考化学 专题辅导 专题7 化学反应的热效应课件PPT: 这是一份2022-2023 高考化学 专题辅导 专题7 化学反应的热效应课件PPT,共55页。
鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第1节 化学反应的热效应完美版课件ppt: 这是一份鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第1节 化学反应的热效应完美版课件ppt,共32页。PPT课件主要包含了核心问题1,观察·发现规律,总结规律,思维程序,实际问题解决,摩尔燃烧焓,方法提升等内容,欢迎下载使用。














