高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化习题
展开2.下列有关化学电源的说法中正确的是( )
A.化学电源将化学能全部转化为电能
B.燃料电池能将全部化学能转化为电能
C.二次电池又叫蓄电池,它放电后可再充电使活性物质获得再生
D.一次电池包括干电池和蓄电池
3.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应为Zn+2MnO2+2H2O===Zn(OH)2+2MnO(OH),下列说法中错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2+2H2O+2e-===2MnO(OH)+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2ml电子,锌的质量理论上减少6.5g
4.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法中正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应式为2C4H10+13O2eq \(=====,\s\up7(点燃))8CO2+10H2O
C.通入空气的一极是正极,电极反应为O2+4e-===2O2-
D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-===4CO2+5H2O
5.燃料电池是一种利用能源物质的新的形式,比如我们可用熔融的K2CO3做电解质,惰性材料做电极,一极通CH2===CH2,另一极通O2、CO2,则下列说法中错误的是( )
A.通入乙烯的一极为正极
B.正极发生的电极反应为:3O2+6CO2+12e-===6CO eq \\al(\s\up1(2-),\s\d1(3))
C.负极发生的电极反应为:CH2===CH2+6CO eq \\al(\s\up1(2-),\s\d1(3)) -12e-===8CO2+2H2O
D.电池的总反应式为:CH2===CH2+3O2===2CO2+2H2O
6.如图是铅蓄电池的构造示意图,下列说法错误的是( )
A.铅蓄电池是二次电池,充电时电能转化为化学能
B.该电池工作时,电子由Pb板通过外电路流向PbO2板
C.该电池工作时,负极的电极反应式为Pb-2e-+SO eq \\al(\s\up1(2-),\s\d1(4)) ===PbSO4
D.该电池工作时,H+移向Pb板
7.锂—空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( )
A.该电池放电时,正极反应为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.充电时,空气极与直流电源正极相连
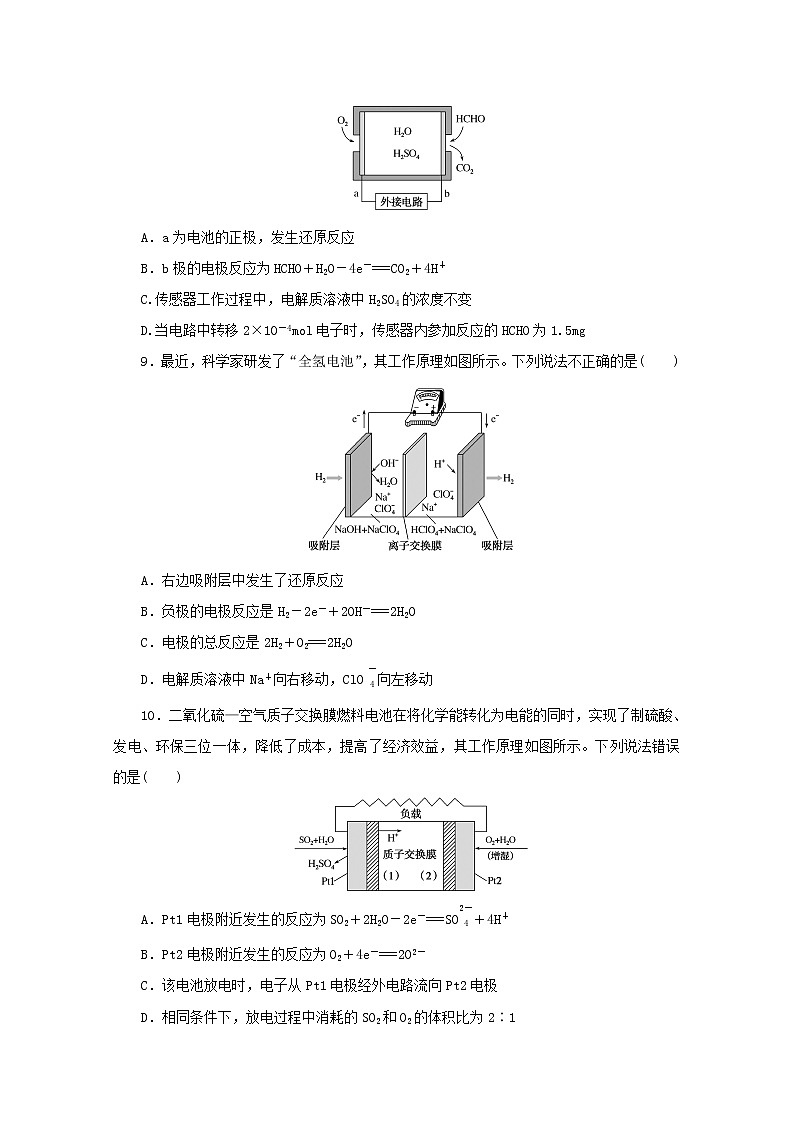
8.通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,下列说法错误的是( )
A.a为电池的正极,发生还原反应
B.b极的电极反应为HCHO+H2O-4e-===CO2+4H+
C.传感器工作过程中,电解质溶液中H2SO4的浓度不变
D.当电路中转移2×10-4ml电子时,传感器内参加反应的HCHO为1.5mg
9.最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.电极的总反应是2H2+O2===2H2O
D.电解质溶液中Na+向右移动,ClO eq \\al(\s\up1(-),\s\d1(4)) 向左移动
10.二氧化硫—空气质子交换膜燃料电池在将化学能转化为电能的同时,实现了制硫酸、发电、环保三位一体,降低了成本,提高了经济效益,其工作原理如图所示。下列说法错误的是( )
A.Pt1电极附近发生的反应为SO2+2H2O-2e-===SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+
B.Pt2电极附近发生的反应为O2+4e-===2O2-
C.该电池放电时,电子从Pt1电极经外电路流向Pt2电极
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
11.一种新型微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。下列说法正确的是( )
A.a极为电池的正极
B.海水淡化的原理是电池工作时,Cl-移向右室
C.处理NO eq \\al(\s\up1(-),\s\d1(3)) 的电极反应为2NO eq \\al(\s\up1(-),\s\d1(3)) +6H2O+10e-===N2↑+12OH-
D.若用C6H12O6表示有机废水中的有机物,则每消耗1mlC6H12O6转移6ml电子
12.某新型可充电电池,能长时间保持稳定的放电电压,该电池的总反应为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
(1)放电时负极反应为________________________________________。
(2)充电时Fe(OH)3发生________反应。
(3)放电时电子由________极流向________极。
(4)放电时1mlK2FeO4发生反应,转移电子数是________。
13.(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是________,正极通的气体应是________。
(2)上图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是________。
A.a电极是负极
B.b电极的电极反应为4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据选择电解质溶液的不同,填写下表:
(4)若把H2改为CH4,KOH溶液作电解质,则负极反应为________________________________________________________________________。
14.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示。
①若A为CO,B为H2,C为CH3OH,则通入CO一极的电极反应式为________________________________________________________________________。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为________________________________________________________________________。
③若A为NO2,B为O2,C为HNO3,则负极的电极反应式为________________________________________________________________________。
(2)碳酸盐燃料电池以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
则电池负极反应式为________________________________________________________________________。
15.(1)以葡萄糖为燃料的微生物燃料电池的结构示意图如图1所示:
①A为生物燃料电池的________(填“正”或“负”)极。
②正极的电极反应式为________________________________________________________________________。
③放电过程中,H+由________(填“正”或“负”,下同)极区向________极区迁移。
④在电池反应中,每消耗1mlO2,理论上生成标准状况下二氧化碳的体积是________________________________________________________________________。
(2)一种一氧化碳分析仪的工作原理如图2所示,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,说明尾气中一氧化碳的含量越高。
请回答下列问题:
①a极的电极反应式为________________________________________________________________________。
②这种一氧化碳分析仪工作时,O2-由电极________(填“a”或“b”,下同)向电极________移动;电子由电极________通过传感器流向电极________。
课时作业5 化学电源
1.解析:锌锰干电池中二氧化锰得电子,为正极,A项错误;燃料电池中氧气得电子,为正极,B项正确;铅蓄电池中二氧化铅得电子,为正极,C项错误;镍镉电池中氢氧化镍得电子,为正极,D项错误。
答案:B
2.解析:化学电源工作时也有少量热量产生,故化学能也部分转化为热能,A项错误;任何电池的效率都不能达到100%,燃料电池的能量转化率超过80%,但不能全部转化为电能,B项错误;蓄电池并不是一次电池,故D项错误。
答案:C
3.答案:C
4.解析:由原电池原理知电子从负极经导线转移到正极,所以正极上富集电子,根据电性关系,O2-不可能移向正极,A项错误;燃料电池不是在点燃的条件下发生的,B项错误;O2得电子,发生还原反应,通入空气的一极是正极,C项正确;丁烷失电子,发生氧化反应,通入丁烷的一极是负极,D项错误。
答案:C
5.解析:原电池是将化学能转变为电能的装置。其总反应式是:CH2===CH2+3O2===2CO2+2H2O,CH2===CH2应在负极上反应,O2应在正极上反应,反应过程中CH2===CH2失去电子,O2得到电子,K2CO3为电解质,负极反应为:CH2===CH2+6CO eq \\al(\s\up1(2-),\s\d1(3)) -12e-===8CO2+2H2O;正极反应为:3O2+6CO2+12e-===6CO eq \\al(\s\up1(2-),\s\d1(3)) 。
答案:A
6.解析:铅蓄电池是可充电电池,是二次电池,充电时电能转化为化学能,A项正确;在该电池中Pb板为负极,则电池工作时,电子由Pb板通过外电路流向PbO2板,B项正确;该电池工作时,负极的电极反应式为Pb-2e-+SO eq \\al(\s\up1(2-),\s\d1(4)) ===PbSO4,C项正确;在原电池工作时,阳离子向正极移动,则该电池工作时H+移向PbO2板,D项错误。
答案:D
7.解析:电池放电时,正极上氧气得电子生成OH-,则电极反应为O2+4e-+2H2O===4OH-,故A错误;电池放电时,负极反应为Li-e-===Li+,充电时阴极反应为放电时负极反应的逆过程,则阴极发生还原反应:Li++e-===Li,故B错误;金属锂能与盐酸反应生成氢气,所以电池中的有机电解液不可以用稀盐酸代替,故C错误;放电时空气极为电池正极,充电时电池正极接直流电源正极,故D正确。
答案:D
8.解析:HCHO失电子被氧化,在负极发生氧化反应,所以b为负极,a为正极,a极发生还原反应,故A正确;b为负极,HCHO在负极发生的反应为HCHO+H2O-4e-===CO2+4H+,故B正确;电池总反应为HCHO+O2===CO2+H2O,传感器工作过程中有H2O生成,所以H2SO4的浓度减小,故C错误;负极反应为HCHO+H2O-4e-===CO2+4H+,当电路中转移2×10-4ml电子时,消耗HCHO的物质的量为5×10-5ml,即质量为1.5mg,故D正确。
答案:C
9.解析:由题图可知,左边电极有电子流出,所以该电极为负极,电极上物质的主要变化为H2转变成H2O,发生氧化反应,右边电极为正极,电极上物质的主要变化为H+转变为H2,发生还原反应。由上述分析可知,右边电极为正极,发生还原反应,A项正确;负极的电极反应为H2-2e-+2OH-===2H2O,B项正确;正极的电极反应为2H++2e-===H2↑,故电池的总反应是OH-+H+===H2O,C项错误;由于右边电极为正极,左边电极为负极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动,D项正确。
答案:C
10.解析:两电极均为惰性电极,起导电作用,电极本身不参与反应。Pt1电极上通入的是SO2和H2O,得到的是H2SO4,S的化合价升高,SO2失电子发生氧化反应,所以Pt1电极为负极,则Pt2电极为正极。负极反应物为SO2和H2O,产物为H2SO4,则负极的电极反应为SO2+2H2O-2e-===SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+,A项正确;H+由负极通过质子交换膜移向正极,正极上O2得电子,发生还原反应生成H2O,电极反应为O2+4e-+4H+===2H2O,B项错误;放电时,电子由负极(Pt1电极)流出,经外电路流向正极(Pt2电极),C项正确;根据得失电子守恒可知,相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1,D项正确。
答案:B
11.解析:b极,NO eq \\al(\s\up1(-),\s\d1(3)) 转化为N2,N的化合价降低,发生还原反应,所以b极为正极,a极为负极,A项错误;电池工作时,Cl-(阴离子)移向负极,即左室,Na+(阳离子)移向正极,即右室,海水得以淡化,B项错误;每生成1mlN2消耗2mlNO eq \\al(\s\up1(-),\s\d1(3)) ,转移10ml电子,根据电荷守恒、元素守恒可得处理NO eq \\al(\s\up1(-),\s\d1(3)) 的电极反应为2NO eq \\al(\s\up1(-),\s\d1(3)) +6H2O+10e一===N2↑+12OH-,C项正确;每消耗1mlC6H12O6生成6mlCO2,转移24ml电子,D项错误。
答案:C
12.解析:放电时锌在负极发生氧化反应,根据总反应可知负极反应是Zn-2e-+2OH-===Zn(OH)2,电子由负极流出,通过外电路流向正极,每1mlK2FeO4发生反应,转移电子是3ml,数目是1.806×1024;充电时Fe(OH)3失去电子发生氧化反应。
答案:(1)Zn-2e-+2OH-===Zn(OH)2
(2)氧化 (3)负 正
(4)1.806×1024
13.答案:(1)H2 O2 (2)B
(3)
(4)CH4+10OH--8e-===CO eq \\al(\s\up1(2-),\s\d1(3)) +7H2O
14.解析:(1)①燃料电池中,通入氧化剂的电极是正极,通入还原剂的电极是负极,该反应中C化合价由+2价变为-2价,H化合价由0价变为+1价,所以CO是氧化剂,则通入CO的电极为正极,电极反应式为CO+4e-+4H+===CH3OH;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子,与水反应生成硫酸根离子和氢离子,电极反应式为SO2+2H2O-2e-===SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+;
③若A为NO2,B为O2,C为HNO3,则正极发生还原反应,氧气得电子生成水,电极反应式为O2+4e-+4H+===2H2O,负极发生氧化反应,电极反应式为NO2-e-+H2O===NO eq \\al(\s\up1(-),\s\d1(3)) +2H+。
(2)该燃料电池中,负极上一氧化碳、氢气失电子,与碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO eq \\al(\s\up1(2-),\s\d1(3)) ===3CO2+H2O。
答案:(1)①CO+4e-+4H+===CH3OH
②SO2+2H2O-2e-===SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+
③NO2-e-+H2O===NO eq \\al(\s\up1(-),\s\d1(3)) +2H+
(2)CO+H2-4e-+2CO eq \\al(\s\up1(2-),\s\d1(3)) ===3CO2+H2O
15.解析:(1)由图1可知A为燃料电池的正极,电极反应式为O2+4H++4e-===2H2O;B为燃料电池的负极,电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+。放电过程中,H+由负极区向正极区移动。葡萄糖燃料电池的总反应为C6H12O6+6O2===6CO2+6H2O,即1mlO2~1mlCO2,每消耗1mlO2,理论上生成标准状况下的CO2气体22.4L。
(2)由元素价态变化可知,a电极为负极,电极反应式为CO+O2--2e-===CO2,b电极为正极,电极反应式为O2+4e-===2O2-,总反应为2CO+O2===2CO2。这种一氧化碳分析仪工作时电子由电极a通过传感器流向电极b,O2-由电极b向电极a移动。
答案:(1)①正 ②O2+4H++4e-===2H2O ③负 正
④22.4L
(2)①CO+O2--2e-===CO2 ②b a a b电解质溶液
H2SO4溶液
KOH溶液
负极反应
正极反应
溶液的pH变化
电解质溶液
H2SO4溶液
KOH溶液
负极反应
2H2-4e-===4H+
2H2-4e-+4OH-===4H2O
正极反应
O2+4H++4e-===2H2O
O2+2H2O+4e-===4OH-
pH
变大
变小
化学苏教版 (2019)专题1 化学反应与能量第二单元 化学能与电能的转化达标测试: 这是一份化学苏教版 (2019)专题1 化学反应与能量第二单元 化学能与电能的转化达标测试,共8页。试卷主要包含了锌锰电池在生活中的用量很大,下列关于化学电源的叙述错误的是等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡达标测试: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡达标测试,共11页。试卷主要包含了解析等内容,欢迎下载使用。
化学选择性必修1第三单元 盐类的水解课后作业题: 这是一份化学选择性必修1第三单元 盐类的水解课后作业题,共9页。试卷主要包含了解析等内容,欢迎下载使用。