化学必修 第一册第二节 离子反应第1课时导学案
展开第1课时 电解质的电离
学习目标 | 核心素养 |
1.以变化的思想领会电离的概念,从而掌握电解质概念的内涵和外延。 2.能从宏观和微观相结合的角度认识酸、碱、盐的概念。 3.学会用电离方程式表示某些酸、碱、盐的电离。 | 1.通过对“电离概念”的学习,逐步提升科学探究和创新能力。 2.通过对“电离方程式书写”的学习,培养证据推理和模型认知意识。 |
新课情境呈现
电解质与细胞活动
细胞是生物体的结构和功能的基本单位。细胞被一层薄膜包裹着,细胞膜内外分别充满细胞液和体液。为了保证人体生理活动的正常进行,需要维持体内的电解质平衡,存在于细胞液和体液中的Na+、K+、Cl-等对这种平衡发挥着重要作用。人体神经和肌肉细胞内的Na+浓度是细胞外体液中的1/20,而细胞内的K+浓度则为细胞外体液中的30倍。Na+、K+等在细胞内外保持正常的平衡浓度,有助于神经和肌肉保持正常的、适当的应激水平。剧烈运动或天气炎热会引起人体大量排汗,Na+、K+、Cl-等离子随汗液排出,导致细胞液和体液中这些离子的浓度大为降低,出现电解质浓度失衡、紊乱,使神经和肌肉的应激受到影响,就会产生恶心、呕吐和肌肉痉挛等症状。因此,在高温环境中工作或从事剧烈运动的人们,要及时补充水分和盐分,以维持体内的电解质平衡。让我们走进教材,学习电解质的电离。
课前素能奠基
知识回顾
1.导电性实验证明:NaCl、NaOH、H2SO4的水溶液能够导电,蔗糖、酒精的水溶液不导电。
2.常见的酸有:HCl、H2SO4、HNO3(写化学式);常见的碱有:NaOH、KOH、Ba(OH)2和Ca(OH)2。
3.NaCl、Na2SO4等属于正盐;而NaHCO3属于酸式盐。
新知预习
一、电解质
1.定义
在水溶液里或熔融状态下能够导电的化合物。如:HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3等。
注意:(1)在水溶液里和熔融状态下都不能导电的化合物,叫非电解质。如:蔗糖、酒精、部分非金属氧化物、氨气等。
(2)单质和混合物既不是电解质也不是非电解质。
2.电解质溶液或熔融电解质导电的原因(以NaCl为例)
(1)电解质导电必须具备的条件:有自由移动的离子。
(2)NaCl属于电解质,固体中含有带电微粒Na+、Cl-,但这些离子不能自由移动,故氯化钠固体不导电。
(3)NaCl固体溶于水时,在水分子的作用下,Na+、Cl-进入水中,形成了能够自由移动的带电粒子,故NaCl溶液可导电。
(4)氯化钠固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-,故熔融NaCl也能导电。
二、电解质的电离
1.电离:
电离是电解质在水溶液里或熔融状态下离解成自由移动离子的过程。
2.表示方法——电离方程式:
(1)含义:用化学式和离子符号表示电离过程的化学方程式。
(2)举例(写出电离方程式)。
①酸的电离,如HCl:HCl===H++Cl-。
②碱的电离,如NaOH:NaOH===Na++OH-。
③盐的电离,如NaCl:NaCl===Na++Cl-。
点拨:电解质电离的条件是在水溶液中或熔融状态下。
3.从电离的角度认识酸、碱、盐:
(1)酸。
①定义:电离时生成的阳离子全部是H+的化合物是酸。
②实例。
(2)碱。
①定义:
电离时生成的阴离子全部是OH-的化合物是碱。
②实例。
(3)盐。
①定义:
电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物是盐。
②实例。
点拨:NaHSO4溶于水时能电离出H+,但阳离子还有Na+,故NaHSO4属于盐。
应用体验
1.已知Na与水反应可生成NaOH。下列叙述正确的是( D )
A.金属Na在熔融和溶于水时均能导电,所以Na是电解质
B.SO3溶于水形成的溶液能导电,所以SO3是电解质
C.通常情况下水不导电,所以水不是电解质
D.氯化氢在液态时虽不导电,但溶于水后能导电,所以氯化氢是电解质
解析:金属钠是单质,不是电解质,SO3本身在水中不电离,是非电解质,水本身能电离出H+和OH-,水是电解质,故选D。
2.下列物质中属于能导电的电解质的是( C )
A.KNO3固体 B.石墨
C.熔融的MgCl2 D.NaCl溶液
解析:KNO3固体是电解质,但不导电,A项错误;石墨是单质,不是电解质,B项错误;熔融的MgCl2属于电解质,也能导电,C项正确;NaCl溶液是混合物,不属于电解质。
3.下列关于溶液的导电性的叙述正确的是( C )
A.硝酸钾溶液能导电,所以硝酸钾溶液是电解质
B.固态氯化钾不导电,所以氯化钾不是电解质
C.氯化氢溶液能导电,所以氯化氢是电解质
D.SO2溶于水能导电,所以SO2是电解质
4.下列电离方程式中书写正确的是( A )
A.H2SO4===2H++SO
B.Ca(OH)2===Ca2++(OH)
C.NH4NO3===NH3+H++NO
D.NaHCO3===Na++H++CO
解析:Ca(OH)2、NH4NO3、NaHCO3的电离方程式分别是:Ca(OH)2===Ca2++2OH-,NH4NO3===NH+NO,NaHCO3===Na++HCO,故选A。
要点归纳
课堂素能探究
知识点
电解质及其导电性
问题探究:
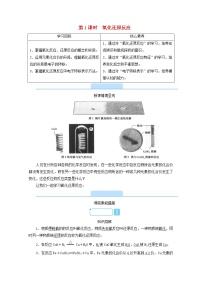
1.上图所示装置为试验物质导电性装置,在干燥的烧杯中依次分别加入下表中物质,观察灯泡是否变亮?加入烧杯中的物质是否是电解质?
2.通过以上实验,讨论:电解质本身是否一定导电?电解质导电的环境一般是什么环境?
3.如果将无水酒精或酒精水溶液放入上面的烧杯中,灯泡都不亮,则酒精是否属于电解质?
探究提示:1.
实验 | 物质 | 实验现象 | 物质的导电性 | 是否是电解质 |
实验1 | 干燥的NaCl固体 | 灯泡不亮 | 不导电 | 是 |
实验2 | 熔融NaCl | 灯泡亮 | 导电 | 是 |
实验3 | NaCl溶液 | 灯泡亮 | 导电 | 不是 |
2.电解质本身不一定能导电,电解质导电的环境为在水溶液中或熔融状态下。
3.酒精不属于电解质,而是一种非电解质。
知识归纳总结:
1.电解质和非电解质的比较:
| 定义 | 相同点 | 不同点 | 代表物 |
电解质 | 在水溶液里或熔融状态下能够导电的化合物 | 都是 化合物 | 一定条件下能电离产生离子 | NaCl,H2SO4,NaOH |
非电 解质 | 在水溶液里和熔融状态下都不导电的化合物 | 不能电离,不能导电 | 蔗糖,酒精 |
2.电解质概念的理解:
(1)电解质必须是化合物,所以前提必须是纯净物。与是否导电没有直接关系。例如,氯化钠溶液,虽然能导电,但是不能说氯化钠溶液是电解质,应说氯化钠是电解质。
(2)有些物质虽然能导电,但也不是电解质。例如,铜虽然能导电,但铜是单质,所以不是电解质。
3.电解质的种类:
种类 | 导电条件 |
酸 | 水溶液中 |
碱 | 水溶液中(难溶物除外)或熔融状态下(NH3·H2O除外) |
盐 | 水溶液中(难溶物除外)或熔融状态下 |
金属氧化物 | 熔融状态下 |
水 | 液态 |
4.判断物质是否为电解质的方法:
拓展视野
强电解质和弱电解质
实验表明,在相同温度下,相同浓度的盐酸比醋酸的导电性强,这是因为氯化氢在水中完全电离,而醋酸在水中只是部分电离。因此,相同浓度的盐酸和醋酸溶液含有的离子的浓度不同,导致两种溶液的导电能力不一样。
人们把在水溶液中能完全电离的电解质称为强电解质,如强酸(H2SO4、HNO3、HCl)、强碱[NaOH、KOH、Ba(OH)2]、大部分盐(NaCl、KNO3、CuSO4)等;把在水溶液中部分电离的电解质称为弱电解质,如弱酸(H2CO3、CH3COOH)、弱碱(NH3·H2O)等。水是一种极弱电解质。
典例1 俗话“养鱼先养水”。在鱼类养殖生产过程中,养殖水体的水质条件是养殖成败的关键因素之一。评价水质的好坏有以下几个指标。
1.养殖塘水环境中的溶氧量。池水中90%以上的溶解氧是靠水中植物的光合作用产生的,光合作用是①二氧化碳和水通过叶绿体生成②葡萄糖和氧气。
2.水体中氨氮的含量。水体中氨氮是以③非离子氨(NH3)和铵离子(NH)两种形式存在。水体中氨氮的升高可导致水体富营养化现象的产生。养鱼水体的氨氮主要来源于④饲料和⑤肥料。
3.水体中⑥硫化氢(H2S)的含量也是表征水体质量的因素。硫化氢在有氧条件下很不稳定,可通过化学或微生物作用转化为硫酸盐,因在底层水中有一定量的⑦活性铁,故可被转化为无毒的⑧硫或⑨硫化铁(Fe2S3)。
(1)上述短文中标有序号的物质,属于混合物的有④⑤(填序号,下同),属于电解质的有⑥⑨,属于非电解质的有①②③。
(2)社会上有些不法分子采用通电的方法捕鱼,会造成鱼类资源的严重破坏。河水为什么可以导电?河水是电解质吗?河水中含有大量的矿物质,大部分是盐类,盐是电解质,发生电离,使河水可以导电。河水属于混合物不是电解质。
解析:上述标有序号的物质中,属于混合物的是饲料和肥料,属于电解质的是硫化氢和硫化铁,属于非电解质的是二氧化碳、葡萄糖和非离子氨。
〔素养应用1〕下列物质属于电解质的一组是( B )
A.CO2、NH3、HCl
B.H2SO4、HNO3、BaCl2
C.H3PO4、H2O、Cu
D.液态KNO3、NaOH溶液、C2H5OH
解析:CO2、NH3属于非电解质,A选项不正确;Cu属于单质,既不是电解质,也不是非电解质,C选项不正确;NaOH溶液属于混合物,C2H5OH属于非电解质,D选项不正确。
知识点
电离方程式的书写
问题探究:根据知识点1中的【问题探究】可知:NaCl固体不导电,NaCl溶液和熔融NaCl可导电,据此探究下列问题:
1.NaCl固体为电解质,但其不能导电。这是为什么?
2.NaCl溶液可导电,将NaCl固体溶于水,发生了怎样的变化?
3.熔融NaCl可导电,加热NaCl固体使之熔融的过程中又发生了怎样的变化?
4.NaCl溶液和熔融NaCl能导电,与是否通电有关吗?
探究提示:1.NaCl固体中的阴、阳离子不能自由移动。
2.将NaCl固体溶于水,在水分子的作用下,Na+和Cl-扩散到水分子之间,变得能自由移动。
3.加热NaCl固体至熔融状态时,Na+和Cl-克服了微粒间原有的作用力,变得能自由移动。
4.无关。
知识归纳总结:
电离方程式的书写要求
(1)电离方程式左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。离子的个数用“2”“3”等标在离子符号之前。
(2)书写时要遵循质量守恒(即方程式两边原子种类和个数必须相同)和电荷守恒(即电离产生的阳离子所带的正电荷总数等于阴离子所带的负电荷总数)。
(3)书写电离方程式必须以事实为依据,不能主观臆造。
典例2 写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:Ba(OH)2===Ba2++2OH-。
②KHSO4:KHSO4===K++H++SO。
③HNO3:HNO3===H++NO。
④Na2CO3:Na2CO3===2Na++CO。
规律方法指导:NaHSO4在溶于水和熔融状态下,电离方程式不同:
①溶于水:NaHSO4===Na++H++SO;
②熔融状态:NaHSO4===Na++HSO,此时HSO不电离。
〔素养应用2〕下列电离方程式中正确的是( D )
A.Ca(OH)2===Ca2++2(OH-)
B.FeCl3===Fe2++3Cl-
C.H2SO4===H++SO
D.Al2(SO4)3===2Al3++3SO
解析:A项,氢氧根离子不应加括号;B项,FeCl3应电离出三价铁离子和氯离子;C项,氢离子前遗漏化学计量数2。
名师博客呈现
电解质与细胞活动
人体需要维持体内的电解质平衡,才能保证正常的生理活动。这其中,存在于体液中的Na+、K+、Cl-等离子发挥着重要的作用。人体大量排汗或腹泻时,Na+、K+、Cl-等离子会随汗液或排泄物排出,使电解质浓度失衡,人就会出现恶心、呕吐和肌肉痉挛等症状。因此,在高温环境中工作或从事剧烈运动的人以及有腹泻症状的人都要及时补充水分和盐分。
电解质饮料可以帮助人们在剧烈运动或大量流汗后及时、方便地补充电解质。电解质饮料首先要保证Na+、K+、Cl-等离子浓度满足人体电解质平衡的需要,有些品牌的电解质饮料还会提供Ca2+、Mg2+等其他生命活动所需离子。电解质饮料常常含有糖类物质用于补充能量,还会添加柠檬酸等用于调节口感的添加剂。在家中可以利用饮用水、食盐、蜂蜜等自制电解质饮料,但要注意控制电解质的浓度,1 L水中加入2 g左右的食盐即可。
某品牌电解质饮料的配料和电解质浓度说明
配料
饮用水、白砂糖、食品添加剂(柠檬酸、柠檬酸钠、氯化钠、氯化钾、苹果酸、葡萄糖酸-δ-内酯、谷氨酸钠、氯化钙、维生素C、食用香精)、西柚浓缩汁。
电解质浓度(平均值)
阳离子 mg/100 mL mmol/L
Na+ 49 21
K+ 21 5.4
Ca2+ 2 0.5
阴离子 mg/100 mL mmol/L
Cl- 60 16
C6H5O(柠檬酸根) 63 3.3
课堂达标验收
1.下列说法或者有关化学用语的描述正确的是( D )
A.NaCl溶于水在电流作用下电离成Na+和Cl-
B.NH4NO3电离时产生了NH和NO无金属离子,所以NH4NO3不是盐
C.HCl、H2SO4液态时都不导电,因此它们都是非电解质
D.Ba(OH)2在水中的电离方程式为Ba(OH)2===Ba2++2OH-
解析:NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+和Cl-,而不是电流的作用,A项错误;NH的性质与金属离子相似,NH4NO3是铵盐,B项错误;HCl、H2SO4液态时虽不导电,但在溶液中能导电,所以HCl和H2SO4都是电解质,C项错误。
2.已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。若有一定浓度的Ca(OH)2溶液,向该溶液中逐渐通入CO2。则:下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)的是( D )
解析:由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力也逐渐增大,当反应进行完全后,溶液导电能力基本保持不变,所以选D。
3.松花蛋于明朝初年问世,其腌制配方有多种,但主要配料为生石灰、纯碱和食盐。将一定比例的配料用水和黏土调成糊状,敷于蛋上,密封保存,数日后可食用。
(1)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有CaO+H2O===Ca(OH)2,Ca(OH)2+Na2CO3===CaCO3↓+2NaOH。(不考虑黏土中的物质可能参加的反应)
(2)松花蛋外的糊状物经溶解、过滤后,滤液中肯定含有的溶质是NaCl、NaOH,它们是(填“是”或“不是”)电解质。
(3)已知松花蛋上的“松花”主要成分是氢氧化锰(+2价)结晶。由此可知氢氧化锰不溶于(填“溶于”或“不溶于”)水,写出氢氧化锰在熔融状态下电离的方程式Mn(OH)2Mn2++2OH-。
解析:(1)发生反应有CaO+H2O===Ca(OH)2,Ca(OH)2+Na2CO3===CaCO3↓+2NaOH。
(2)滤液中肯定含有的溶质是NaCl和NaOH,分别属于盐类和碱类。它们都属于电解质。
(3)“松花”主要成分是氢氧化锰结晶,所以不溶于水,氢氧化锰在熔融状态下电离的方程式为Mn(OH)2Mn2++2OH-。
4.电解质溶液导电能力的强弱主要由自由移动的离子浓度的大小和离子所带电荷数决定。某兴趣小组同学在测定溶液的导电性实验时,采用如图所示的串联装置,闭合电键时,发现灯泡不亮。
(1)判断上述四个烧杯中的溶质的电解质类型。
(2)上述四个烧杯中哪个烧杯中的物质发生了电离?写出Cu(NO3)2和KOH溶液的电离方程式。
(3)小灯泡不亮的原因是什么?怎样才能使灯泡亮起来?
答案:(1)醋酸、硝酸属于酸,KOH属于碱,Cu(NO3)2属于盐。
(2)A、B、D烧杯中的溶质均发生了电离,C烧杯中的硝酸没有发生电离。Cu(NO3)2===Cu2++2NO,KOH===K++OH-。
(3)四个烧杯中只有C中纯硝酸没有自由移动的离子,不导电,整个装置没有形成闭合回路,灯泡不亮;当向C中加水时,HNO3发生电离而导电,整个装置形成闭合回路,灯泡亮。
鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解第1课时导学案: 这是一份鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解第1课时导学案,共16页。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第2课时学案: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第2课时学案,共12页。学案主要包含了氧化剂和还原剂,常见的氧化剂和还原剂,氧化性和还原性等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化第2课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化第2课时学案设计,共10页。学案主要包含了物质的转化等内容,欢迎下载使用。