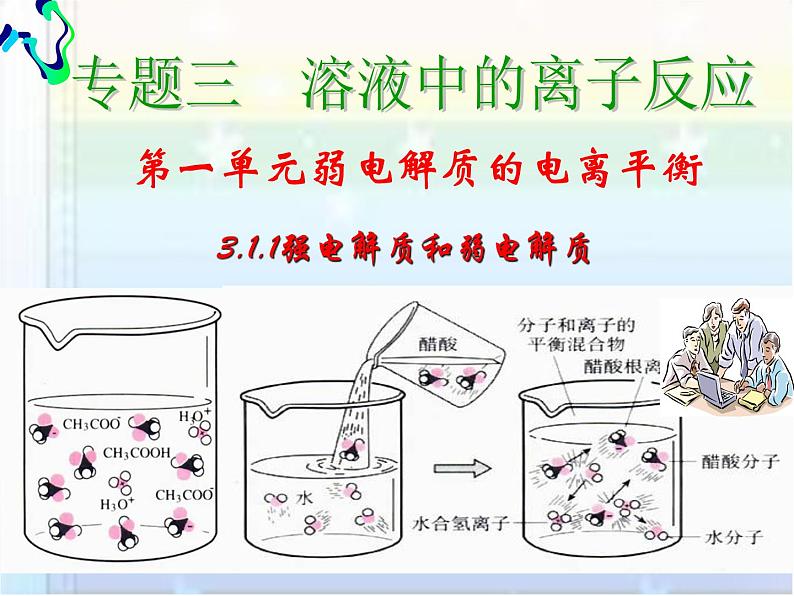



高中苏教版第一节 弱电解质的电离平衡说课课件ppt
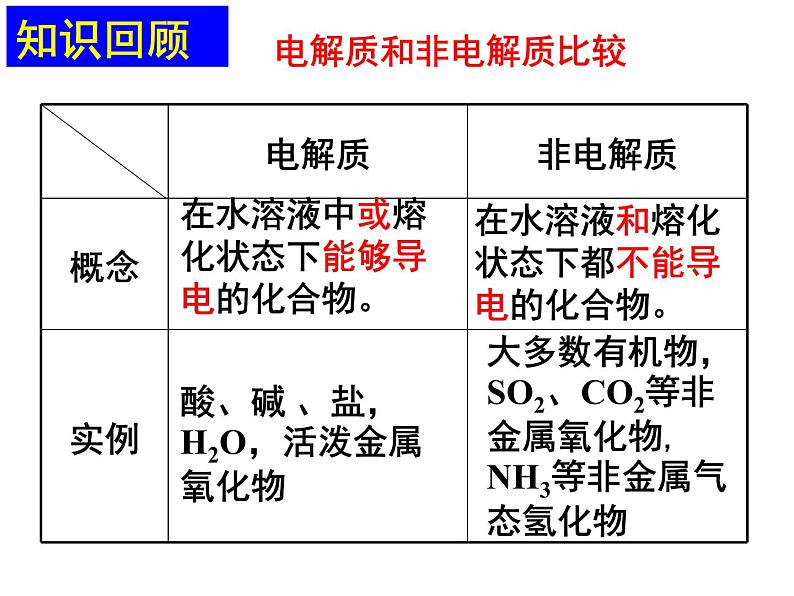
展开在水溶液中或熔化状态下能够导电的化合物。
在水溶液和熔化状态下都不能导电的化合物。
酸、碱 、盐,H2O,活泼金属氧化物
大多数有机物,SO2、CO2等非金属氧化物,NH3等非金属气态氢化物
1.石墨能导电,所以是电解质。2.由于BaSO4不溶于水,所以不是电解质。3.盐酸能导电,所以盐酸是电解质。4.SO2、NH3、Na2O溶于水可导电,所以均为电解质。
讨论以下几种说法是否正确,并说明原因。
2) CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身
3)难溶的盐(BaSO4等)虽然水溶液不能导电 但是在融化时能导电,也是电解质。
1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?
2.你能设计实验验证你的猜想吗?
电解质在水溶液中或熔化状态下离解成自由移动离子的过程
实验3-1:取体积相同,物质的量浓度相同的盐酸和醋酸,测量溶液的pH值并与等量镁条反应,观察实验现象。
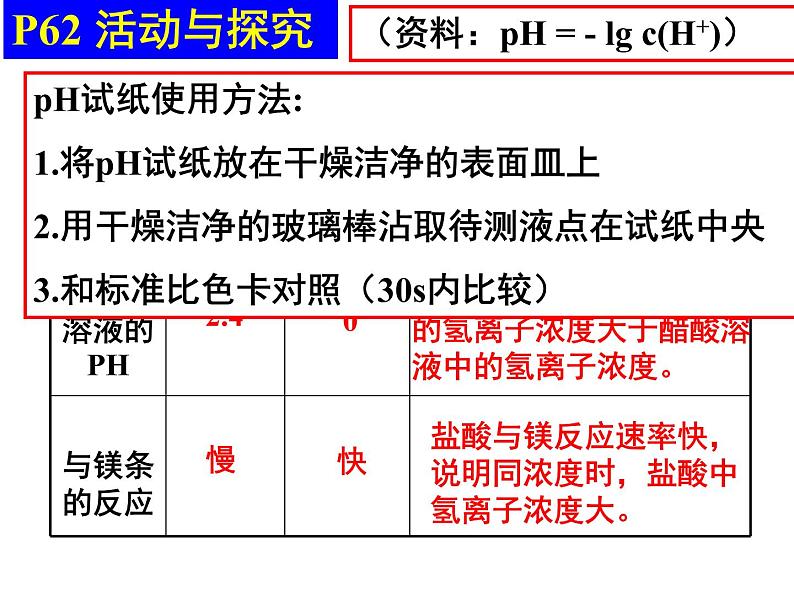
盐酸与镁反应速率快,说明同浓度时,盐酸中氢离子浓度大。
盐酸的PH小,说明盐酸中的氢离子浓度大于醋酸溶液中的氢离子浓度。
(资料:pH = - lg c(H+))
pH试纸使用方法:1.将pH试纸放在干燥洁净的表面皿上2.用干燥洁净的玻璃棒沾取待测液点在试纸中央3.和标准比色卡对照(30s内比较)
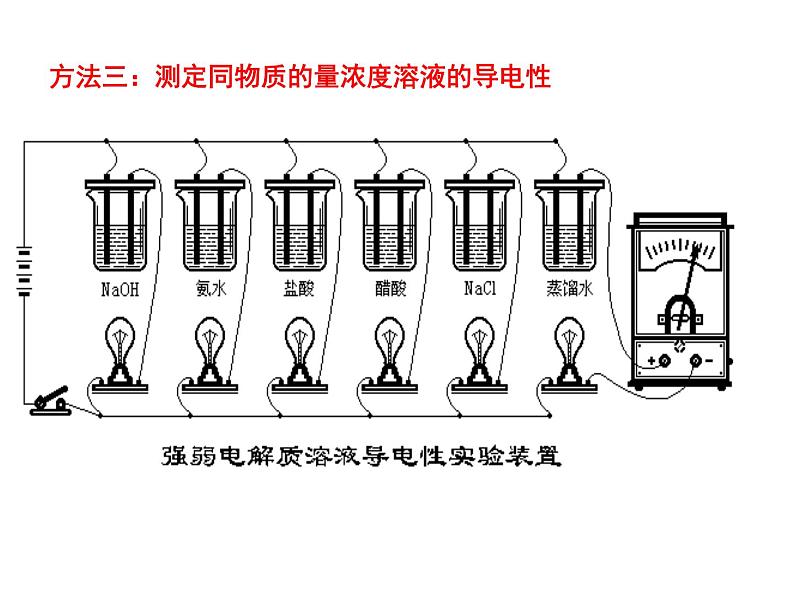
方法三:测定同物质的量浓度溶液的导电性
开始1ml/L HCl与镁条反应剧烈,说明1ml/L HCl中氢离子浓度大,即氢离子浓度为1ml/L,说明HCl完全电离;而开始1ml/L CH3COOH与镁条反应较慢,说明其氢离子浓度较盐酸小,即小于1ml/L,说明醋酸在水中部分电离。HCl是强电解质,CH3COOH是弱电解质。盐酸的电离程度要高于醋酸
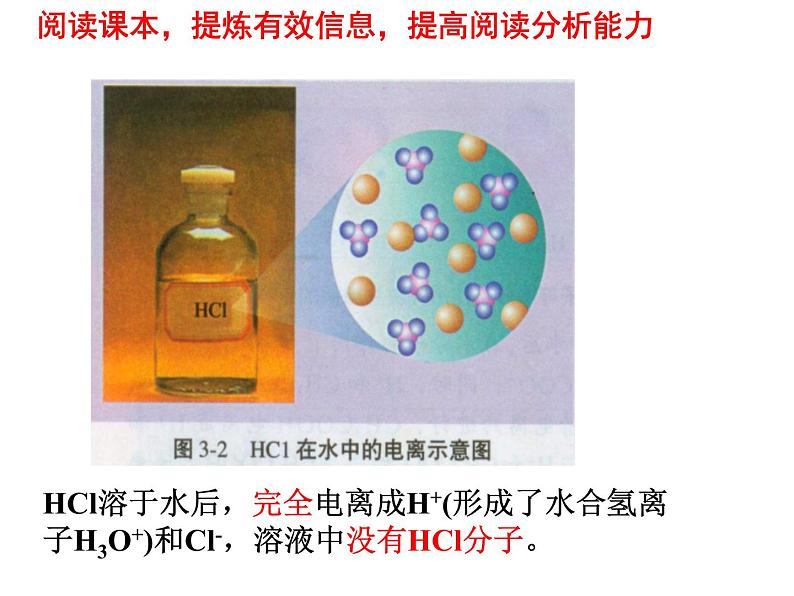
HCl溶于水后,完全电离成H+(形成了水合氢离子H3O+)和Cl-,溶液中没有HCl分子。
阅读课本,提炼有效信息,提高阅读分析能力
CH3COOH溶于水后,部分电离成H+和CH3COO-,溶液中有少量的H +和CH3COO- ,大部分是CH3COOH 分子。
强电解质: 弱电解质:
在水溶液里或熔融状态下全部电离成离子的电解质(其离子无分子化倾向)。包括大多数盐类、强酸、强碱、活泼金属氧化物。
在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水、极少数盐
NaCl = Na++Cl-
电解质强弱的区分标准:电解质在水溶液中的电离程度
试写出下列物质的电离方程式。
1. H2SO42. HAc3.Ba(OH) 24. Mg(OH)25. NH3•H2O6.NaHCO37. NaHSO4
H2SO4 = 2H++SO42-
NaHCO3 = Na++HCO3-
总结: 强等号、弱可逆、多元弱酸分步写,多元弱碱一步写。
Ba(OH)2=Ba2++2 OH -
NaHSO4 = Na++H++SO42-
CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。电解质的强弱与其溶解性有何关系?怎样区分强弱电解质?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离.
溶液导电性强弱与电解质强弱的关系
电解质溶液的导电能力的强弱与电解质本身的强弱并无关系,它取决于电解质溶液中自由移动离子的浓度及离子所带电荷。
思考并讨论1.难溶物一定是弱电解质吗?2.强电解质溶液的导电能力一定强吗?3.强电解质溶液的导电能力一定强于弱电解质吗?
强电解质和弱电解质的比较
阴、阳离子、弱电解质分子
离子化合物、部分共价化合物
强酸、强碱、绝大多数盐、大多数活泼金属氧化物等
弱酸、弱碱、少部分盐、水
相同浓度的氢氧化钠和氨水的电离程度有无差异?提出你的假设并设计实验加以验证,完成下表。
相同浓度的氢氧化钠和氨水的电离程度不同,且氢氧化钠的电离程度大于氨水。
分别测定0.1ml•L-1氢氧化钠和氨水的pH
氢氧化钠和氨水的pH分别是13和11
NaOH的电离程度比NH3•H2O大
强酸:HCl、H2SO4、HNO3、HClO4、 HBr、HI、HMnO4
强碱:NaOH、Ca(OH)2、Ba(OH)2 、KOH、RbOH…
弱酸:HF、HClO、H2CO3、H2SO3、 H3PO4、CH3COOH
弱碱:NH3·H2O、Fe(OH)2、 Fe(OH)3、……少部分盐:Pb(AC) 2
大部分有机物:除有机酸、碱、盐之外
非金属的氧化物:CO、CO2、SO2、SO3、 NO、NO2……
1、下列物质属于强电解质的是( ) A.H2CO3 B.CH4 C.NaHCO3 D.NaHSO4
2、下列说法正确的是 ( )A.强电解质一定是离子化合物,弱电解质一定是共价化合物B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物C.CO2的水溶液导电能力很弱,所以CO2是弱电解质D.属于共价化合物的电解质在熔化状态下一般不导电
3.在KHSO4的稀溶液和熔融状态下都存在的离子是A、H+ B、HSO4- C、SO42- D、K+
4.下列电离方程式中正确的是 A、NH3·H2O NH4++OH- B、NaHCO3 Na++HCO3-C、H2S 2H+ + S2- D、KClO3 K+ + Cl- + 3O2-
5.下列叙述中,能说明某化合物一定是弱电解质的是:A、该化合物水溶液不导电;B、该化合物饱和溶液导电能力较弱C、该化合物在熔融时不导电;D、该化合物溶于水中发生电离,溶质离子浓度小于溶质分子浓度
6.关于强弱电解质的导电性的正确说法是:A、由离子浓度决定;B、没有本质区别;C、强电解质溶液导电能力强,弱电解质溶液导电能力弱;D、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
7.下列说法正确的是A、强酸、强碱都是强电解质;B、可溶性碱都是强电解质;C、不溶于水的化合物都是弱电解质或非电解质;D、能导电的物质都是电解质
高中化学人教版 (2019)选择性必修1第一节 电离平衡备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡备课课件ppt,共23页。PPT课件主要包含了学习目标,新课导入,导电性,离子浓度,实验探究3,pH1,pH3,实验结果,强电解质,弱电解质等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡授课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡授课课件ppt,共15页。PPT课件主要包含了学习目标,复习回顾,②③⑤⑦,实验探究,实验结论,化合物,电解质,非电解质,强电解质,弱电解质等内容,欢迎下载使用。
高中化学第一单元 弱电解质的电离平衡课文配套课件ppt: 这是一份高中化学第一单元 弱电解质的电离平衡课文配套课件ppt,共30页。PPT课件主要包含了分点突破1,强电解质和弱电解质,分点突破2等内容,欢迎下载使用。













