

沪教版 (上海)九年级第一学期3.2 溶液当堂达标检测题
展开最新人教版九年级化学下册第九单元溶液同步训练试卷汇总
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、物质的溶解度随温度变化的曲线叫做溶解度曲线。利用溶解度曲线,可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.K点表示在t°C时,甲、乙的溶解度不相等
B.35°C时,将20g甲物质加入50g水中,充分溶解后得到的甲物质溶液的质量是70g
C.t°C时乙物质的饱和溶液,升温到35°C时仍是饱和溶液
D.甲物质的溶解度比乙物质大
2、在t℃时,向mg水中加入ng硫酸铜晶体,充分搅拌后得到硫酸铜溶液。有关说法正确的是
A.溶质的质量是ng B.溶剂的质量是mg
C.溶液的质量是(m+n)g D.溶解度是g/100g水
3、下列“一定”的说法正确的是
A.离子是带电粒子,所以带电的粒子一定是离子
B.置换反应会生成一种单质和一种化合物,则生成一种单质和一种化合物的反应一定是置换反应
C.分子由原子构成,则分子一定比原子大
D.饱和的硝酸钾溶液降温结晶后,一定仍为硝酸钾的饱和溶液
4、如图是A、B、C三种固体物质的溶解度曲线。下列说法正确的是
A.℃时, A的饱和溶液中溶质质量分数为
B.℃时,A、B、C三种物质的溶解度大小关系为
C.将℃时A、C的饱和溶液升温到℃,A、C两种溶液都会变成不饱和溶液
D.A中含有少量B,要提纯A通常可采用冷却热饱和溶液的方法
5、甲、乙、丙三种固体的溶解度曲线如图1所示并进行如图2的实验。下列说法错误的是
A.图2中试管内所盛饱和溶液的溶质为对应图1溶解度曲线中的丙
B.将甲、乙、丙饱和溶液从t2℃降温到t1℃,溶质的质量分数:甲=乙>丙
C.t3℃时,90g甲的饱和溶液中含40g溶质
D.当甲中混有少量乙时,可采用降温结晶的方法提纯甲
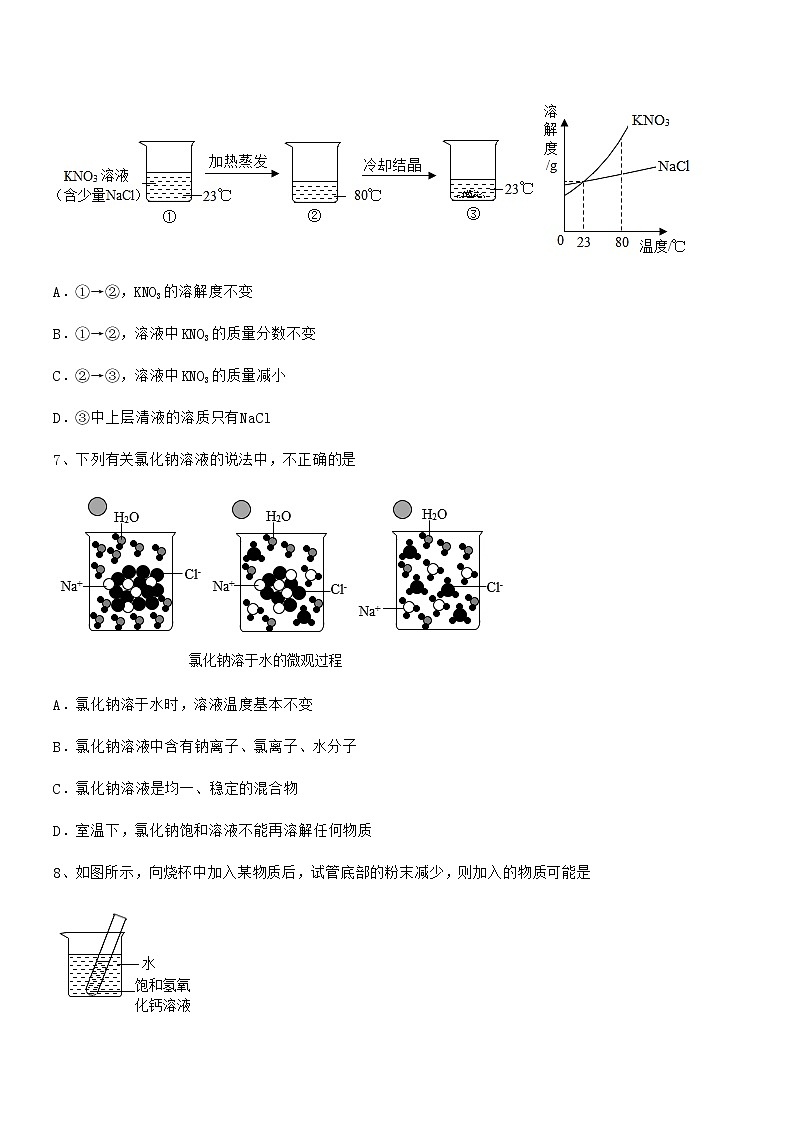
6、提纯含少量NaCl杂质的KNO3,部分实验过程如下,相关物质的溶解度曲线如图所示。下列说法正确的是
A.①→②,KNO3的溶解度不变
B.①→②,溶液中KNO3的质量分数不变
C.②→③,溶液中KNO3的质量减小
D.③中上层清液的溶质只有NaCl
7、下列有关氯化钠溶液的说法中,不正确的是
A.氯化钠溶于水时,溶液温度基本不变
B.氯化钠溶液中含有钠离子、氯离子、水分子
C.氯化钠溶液是均一、稳定的混合物
D.室温下,氯化钠饱和溶液不能再溶解任何物质
8、如图所示,向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是
A.氢氧化钠 B.碳酸钙
C.硝酸铵和氢氧化钙 D.氯化钠
二、填空题(每小题4分,共计20分)
1、如图所示是甲、乙两种固体的溶解度曲线,请回答:
(1)t1℃时,乙的饱和溶液中,溶质与溶剂的质量比为_________。
(2)t2℃时,将等质量的甲、乙分别配成饱和溶液所得溶液的质量:甲_________(填“>”“=”或“<”)乙。
(3)t2℃时将75g甲的饱和溶液稀释成质量分数为20%的溶液,需加水___________g。
2、如图是不含结晶水的甲、乙、丙三种固体物质的溶解度曲线,看图并回答下列问题。
(1)M点表示的含义是___________。
(2)t2℃时,将20g甲物质加入到50g水中,充分溶解后所得溶液的质量是___________g。
(3)t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t2℃,所得溶液中溶质质量分数由大到小的顺序是___________。
(4)若甲物质中混有少量乙物质,最好采用___________的方法提纯甲。
3、化学与我们的生产、生活息息相关。
(1)厨房用洗洁精除去油污,利用了洗洁精的_____作用。
(2)活性炭包能有效除去空气中的有害气体,因为是活性炭具有_________性。
(3)生活中铜用做导线,利用了铜的延展性和______性。
(4)喝了汽水后常常会打嗝,说明气体溶解度随着温度的升高而_____。
(5)扑灭森林火灾的有效方法之一,是将大火蔓延路线前的一片树木砍掉。其灭火原理是___。
4、影响气体溶解度的外界因素有___________。
5、现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是______或______。
三、计算题(每小题4分,共计36分)
1、某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g硫酸质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下图所示:
请回答下列问题:
(1)写出合金中金属(用R表示)与酸反应的化学方程式_________。
(2)根据已知条件列出求解第二次产生氢气质量(x)的比例式_________。
(3)该合金由铜与_________两种金属组成。
(4)该合金中铜的质量分数为_________。
(5)欲将上述合金样品中的铜转化为铜盐,可将上述最终混合物过滤,将滤渣、洗涤、烘干,然后在空气中加热,充分反应,可得到氧化铜的质量为_______,再经过某些反应就制得铜盐。
2、小樱同学在实验室进行有关浓硫酸溶液的实验,试剂瓶上的标签如下表所示。她从瓶中倒出20mL用于配制稀硫酸溶液。请计算:
浓硫酸溶液(H2SO4)500mL | |
溶质的质量分数 | 98% |
密度 | 1. 84 g/cm3 |
强腐蚀性,阴冷,密封储藏 | |
(1)这20mL浓硫酸溶液的质量为___________g。
(2)她将这20mL浓硫酸溶液与100mL水均匀混合,水的密度为1g/cm3所得稀硫酸溶液中溶质的质量分数是多少?(结果保留到小数点后一位)
3、实验室用34g5%的过氧化氢的水溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)参加反应的过氧化氢的质量为___g。
(2)生成氧气的质量是______?(请列式计算)
4、徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.4g |
(1)4.0g石灰石样品中碳酸钙的质量是__________g。
(2)求稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
5、 “黄铜”即铜锌合金,古代称为“俞石”。由于外观酷似黄金,常被不法商販冒充黄金出售。某实验小组为了辨别真伪,用该合金与稀盐酸反应,将三次实验所得相关的数据记录如下:
物质质量 | 第一次 | 第二次 | 第三次 |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
充分反应后,剩余物总质量/g | 144.6 | 184.6 | 149.6 |
(1)根据上表数据分析,合金中的锌与稀盐酸恰好完全反应时,所取合金与稀盐酸的质量比为___________。
(2)计算铜锌合金中的铜的质量分数为___________。
(3)计算第3次实验完全反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
6、有50g10%的食盐溶液,要使其溶质质量分数变为20%,有以下三种方法,请你进行计算。(写出计算过程)
(1)可加入多少克食盐?
(2)可蒸发多少克水?
(3)将其与溶质质量分数为25%的食盐溶液混合,需要25%的食盐溶液多少克?
7、为测定一瓶久置过氧化氢溶液的溶质质量分数,实验操作如图1所示,电子天平示数如图2所示。请计算:
(1)完全反应后生成氧气的质量为______。
(2)该过氧化氢溶液中溶质的质量分数。
8、在花卉市场上经常见到用营养液培育观赏植物。你会用无土栽培花卉吗?有一种无土栽培花卉的营养液的溶质质量分数为1.6%,它的成分含有磷酸铵和硝酸钾,且这两种溶质的质量比为1:3。
(1)营养液密封放置一段时间后______(填“会”或“不会”)出现浑浊现象,原因是______。
(2)500g营养液中含硝酸钾的质量是多少?(写出计算过程)
(3)欲将上述500g营养液中硝酸钾的质量分数增至1.5%,需要蒸发掉多少g的水?(设蒸发过程中无晶体析出)(写出计算过程)
9、50gCu、Zn混合物跟10%的稀硫酸恰好完全反应,生成氢气1g,求所得溶液中溶质的质量分数。(相对原子质量: H-1 S-32 O-16 Cu-64 Zn-65)
四、实验探究(每小题5分,共计20分)
1、为探究过氧化氢的制取O2的反应,同学们进行了以下实验。
初步探究:探究影响过氧化氢制取O2速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如图所示。
实验方案 | 序号 | 实验现象 |
烧杯1 | 木条复燃,燃烧很旺 | |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
(结论与解释)
(1)过氧化氢的制取O2属于四种基本反应类型中的______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是______(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是______。
(反思与评价)
(5)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
(6)实验室取68g过氧化氢溶液和2g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4g。则参加反应的过氧化氢溶液中溶质的质量分数为______。
2、实验室开放日小明和同学们一起来到实验室,对“影响食盐溶解速率的因素”开展了如下探究活动:
(提出问题)影响食盐溶解速率的因素有哪些?
(猜想与假设)猜想一:溶解速率可能与食盐的颗粒大小有关
猜想二:溶解的速率可能与水的温度有关
(设计并进行实验)实验一:请根据实验步骤和现象填写下表中的实验结论。
实验步骤 | 实验现象 | 实验结论 |
用两个烧杯各取20mL的水,一个烧杯中加入3g大食盐颗粒,一个烧杯中加入3g小食盐颗粒,分别用玻璃棒进行同等程度的搅拌,记录完全溶解时,需要的时间 | 大颗粒完全溶解45秒,小颗粒完全溶解28秒 | _____ |
实验二:请你根据实验结论完成下表。
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | 水的温度越高,溶解速率越快 |
(实验反思)小明结合上述两组实验,提出了影响溶解速率的另外一个因素是_____。
3、某化学兴趣小组探究硝酸铵、氯化钙、氯化钠三种物质溶于水过程中的热量变化。
(药品器材)水、硝酸铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等。
(实验探究)三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
实验 | 水的体积 | 所加物质 | 测量液体温度(℃) |
实验1 | 50 mL | 硝酸铵 | 15 |
实验2 | 50 mL | 氯化钙 | 28 |
实验3 | X | 氯化钠 | 21 |
实验4 | 50 mL | 无 | 22 |
(数据分析)
(1)表中X为________mL。
(2)比较实验2与实验4,可获得的结论是______。
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是_______。
(反思评价)
(4)经讨论认为本实验操作中存在缺陷,它是_____(可多选)。
A 实验操作过程没有采取较为严格的保温措施
B 加入物质的质量可能不相等
C 加入物质的种类不一样
4、高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾进行研究。
(1)①如图所示进行实验,高锰酸钾受热分解的化学方程式为_______。
②取一定量的高锰酸钾固体,充分加热,发现实际产生氧气的质量远高于理论数值。则可能的原因有_______(测定过程中产生的误差可忽略)。
(2)浓度为0.05%的高锰酸钾溶液有消炎、防感染扩散等作用。
①若用10g1%的高锰酸钾溶液稀释成0.05%的高锰酸钾溶液需要蒸馏水_______mL(水的密度是1g/mL)。
②在量取蒸馏水时,若俯视读数,则会导致高锰酸钾溶液得溶质质量分数_______(选填“大于”或“小于”)0.05%。
(3)经查阅资料得知KMnO4溶液呈中性、有腐蚀性,小组成员进行了以下实验:将铜片分别浸泡在4种不同的溶液中18小时,现象如下表。
编号 | Ⅰ | Ⅱ | Ш | Ⅳ | |
实验 | 25mL、0.1% KMnO4溶液 | 25mL、0.1% KMnO4溶液 +10滴浓硫酸 | 25mL蒸馏水+10滴浓硫酸 | 25mL、1% KMnO4溶液 +10滴浓硫酸 | |
铜片质量 | 实验前 | 0.54g | 0.54g | 0.54g | 0.54g |
实验后 | 0.54g | 0.52g | 0.54g | 0.43g | |
(解释与结论)
①通过对比实验Ⅱ和Ⅳ,得出的结论是_______。
②欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要进行对比实验的编号为_______。
③该实验中铜片被腐蚀的反应如下,补全该反应的化学方程式:
______
初中化学沪教版 (上海)九年级第一学期3.2 溶液课时作业: 这是一份初中化学沪教版 (上海)九年级第一学期3.2 溶液课时作业,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
沪教版 (上海)3.2 溶液同步训练题: 这是一份沪教版 (上海)3.2 溶液同步训练题,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2020-2021学年3.2 溶液课后练习题: 这是一份2020-2021学年3.2 溶液课后练习题,共15页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













