




化学键PPT课件免费下载
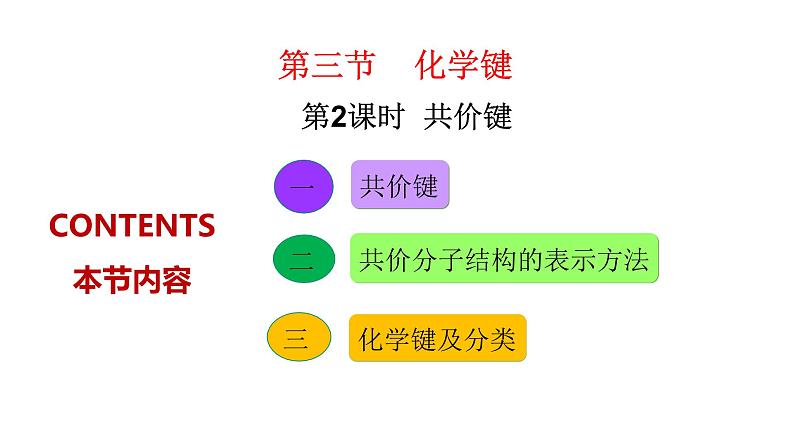
展开CONTENTS 本节内容
一、【课程的主要内容】
共价分子结构的表示方法
从微观角度理解氯气的形成过程
用电子式表示其形成过程为_______________________。
(1)定义:原子间通过___________所形成的相互作用叫做共价键(2)成键微粒:______(3)成键实质:共用电子对与成键原子的______作用(4)成键元素:一般是同种或不同种的_______元素(注:部分金属原子和非金属原子间也可形成共价键,如______)
(5)分类①极性共价键不同种原子间(如H—Cl)形成的共价键,共用电子对发生偏移,成键原子一方显正电性,一方显负电性②非极性共价键同种原子间(如H—H)形成的共价键,共用电子对不发生偏移,成键原子不显电性
(1)定义:以___________形成分子的化合物 (2)常见类型:_________________________________________________________________(3)关系:共价化合物_______含离子键,离子化合物中____含离子键
和少数盐(如AlCl3)等
非金属氢化物、非金属氧化物、酸、大多数有机物
二、【例题剖析】
【例2】下列关于共价键的说法中正确的是( )A.非金属单质分子中一定含有共价键B.只由非金属元素组成的化合物都是共价化合物C.非极性键只存在于双原子分子中D.不同元素组成的多原子分子中一定含有极性键,可能存在非极性键
【例1】下列物质中,含有共价键的是( )A.NaClB.MgC.HClD.CaO
【例3】下列说法错误的是( )A.含有共价键的化合物一定是共价化合物B.在共价化合物中一定含有共价键C.构成单质分子的微粒不一定含有共价键D.共价化合物中可能含有离子键
【例4】下列含有共价键的离子化合物是( )A.Na2O2 B.H2O2 C.MgCl2 D.AlCl3
【例5】下列含有非极性键的共价化合物是( )A.N2 B.Na2O C.N2H4 D.H2SO4
H2:_____N2:_______NH3:_______
用短线(“—”)代表1对共用电子对,有几对共用电子对画几条短线,略去所有的电子和电子对。这种表示分子里各直接相连的原子的成键情况的式子称为结构式。如氯分子可表示为“Cl—Cl”
分子结构模型
分子具有一定的空间结构,反映分子空间结构的模型通常有球棍模型和比例模型(1)球棍模型用小球代表原子(常用不同颜色和大小的球来区别不同的原子),用棍表示共价键(单键、双键、三键),通过球和棍连接反映分子结构的模型称为球棍模型
(2)比例模型按照合适的比例,以不同大小的球代表不同的原子,真实地表示原子的空间位置关系和分子结构的模型称为比例模型球棍模型和比例模型中,球的大小与原子半径的大小比例相一致
【例6】下列化学用语中,正确的是( )A.次氯酸的结构式:H—O—ClB.氮气的电子式:C.CO2分子的电子式:O==C==OD.用电子式表示溴化氢分子的形成过程:
【例7】下面是一些常见分子的比例模型,其中1个分子中含有共用电子对最多的是( )A.氢气B.氨气C.水D.二氧化硫
【例8】写出下列分子的结构式(1)N2:______________(2)H2O2:______________(3)CS2:______________(4)HClO:_____________
【例9】白磷分子的结构式如图,回答下列问题(1)白磷的分子式为__________。(2)白磷分子的空间结构为_________形。(3)31g白磷中含有_____NA个P—P键。(4)白磷与O2反应可能生成P4O6或P4O10,已知P4O6分子中P原子与P原子、O原子与O原子间不形成共价键,各原子都满足最外层8电子结构。该分子中共价键的数目为______。
三、【拓展学习】
化学反应的本质:一个化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程
离子化合物与共价化合物的比较
一般较低,少部分很高(如SiO2)
熔融状态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
分子间作用力
(1)概念:分子之间存在着一种把分子聚集在一起的作用力,又称范德华力(2)特点:分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质(3)变化规律 对于组成和结构相似的由分子构成的物质,相对分子质量越大,分子间作用力______,物质的_______越高
(1)概念:像NH3、H2O、HF这样的分子之间存在的一种比化学键弱、比范德华力稍强的相互作用称为氢键分子中与H原子形成共价键的非金属原子,如果吸引电子的能力很强,原子半径又很小,则使氢原子带部分正电荷,分子之间氢核与带部分负电荷的非金属原子之间相互吸引,这种静电作用就是氢键(2)形成条件:通常含有N—H、O—H、F—H的分子间易形成氢键,常见的化合物有NH3、H2O、HF、醇类等
(3)对物质性质的影响①分子间形成氢键使物质的熔点和沸点升高,因为熔化或汽化时必须破坏分子间的氢键,消耗较多的能量②分子间的氢键对物质的水溶性也有影响,如NH3极易溶于水③冰中水分子间形成氢键使冰的结构中有空隙,造成体积膨胀,因此冰的密度比水小
五、【典例分析】
【例10】判断正误(1)单质分子中一定含有共价键( )(2)CO2的电子式为 ( )(3)NaOH中含有离子键和极性键( )(4)化学键既可存在于分子内的原子间,又可存在于分子之间( )(5)氢键是化学键的一种( )(6)稀有气体不存在化学键( )(7)水分子稳定,是因为水分子间存在氢键( )
【例11】下列关于化学键的叙述中正确的是( )A.化学键存在于原子之间,也存在于分子之间B.两个原子之间的相互作用叫做化学键C.离子键是阴、阳离子之间的相互吸引力D.化学键通常是指直接相邻的原子或离子之间强烈的相互作用
【例12】在下列变化过程中,既破坏离子键又破坏共价键的是( )A.加热分解KClO3 B.NaOH溶于水C.加热分解HClO D.Na2CO3受热熔化
【例13】在下列物质中:A.氩 B.NaOH C.甲烷 D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2(1)只含离子键的物质是_____(填字母,下同);(2)既有离子键又有共价键的物质是_____;(3)只含极性键的物质是________;(4)含非极性键的物质是_____。
【例14】下面是中学化学实验中经常进行的操作,请将对应序号填在横线上。①碘的升华 ②加热熔化氢氧化钠 ③食盐溶解于水 ④氯化氢溶解于水 ⑤氧气溶解于水 ⑥过氧化钠溶解于水其中没有发生化学键断裂的是______;只发生离子键断裂的是_____;只发生共价键断裂的是____;既发生离子键断裂,又发生共价键断裂的是____。
乙醇与乙酸PPT课件免费下载: 人教版 (2019)高中化学必修 第二册课文《乙醇与乙酸》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
氮的固定PPT课件免费下载2023: 苏教版 (2019)高中化学必修 第二册课文《氮的固定》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
电离平衡PPT课件免费下载2023: 人教版 (2019)高中化学选择性必修1课文《电离平衡》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。













