














化学九年级下册课题1 生活中常见的盐一等奖ppt课件
展开第十一单元 盐 化肥
课题1 生活中常见的盐
设计说明 [来源:Z.Com][ 本课题的教学内容分为两部分,生活中常见的盐和复分解反应发生的条件。生活中常见的盐主要学习四种盐,包括氯化钠、碳酸钠、碳酸氢钠和碳酸钙。食盐是学生最熟悉的物质,由它可以引出学生认识盐的组成,进一步帮助学生认识盐的概念,引出课题生活中常见的盐。由它的晒制还可以引出粗盐提纯的实验,帮助学生通过实验认识粗盐中难溶性杂质去除的过程。碳酸钙也是学生比较熟悉的。学生在二氧化碳与氢氧化钙的反应产物中见过它,在实验室制取二氧化碳的反应物中也见过它。因此,碳酸钙可以成为学生学习其他碳酸盐的参照物。学生对碳酸钠、碳酸氢钠相对陌生,通过与碳酸钙比较,可以认识它们组成的相似性和不同点,通过化学实验的设计和实施,认识它们的物理性质和化学性质的相似性和不同点。 复分解反应是学生学习的重要反应类型,复分解反应发生的条件是本课题学习的难点。首先,可以让学生观察碳酸盐与酸反应、碳酸钠与氢氧化钙反应的化学方程式的特点,总结复分解反应的类型;然后,再回顾以往学过的化学反应类型,通过对比巩固学生对复分解反应类型的理解;之后,引导学生通过实验及讨论,认识复分解反应发生的条件,最后,给出两种物质,让学生判断能否发生复分解反应。通过步步深入的学习活动,让学生对知识的认识逐渐深入。 本课题内容比较丰富,难度较大,在学习方法上,要注意分类思想、归纳对比思想的应用,使学生由浅入深,层层推进,并且要避免盲目的拓展和拔高。 教学目标 【知识与技能】 1.了解盐的概念,能判断化合物的简单分类,掌握碳酸根离子检验的方法。 2.了解氯化钠的组成、来源,在生产、生活中的主要用途及在人体中的生理功能。 3.知道粗盐提纯的基本步骤,掌握过滤、蒸发操作技能及注意事项,并综合运用相关操作分离、提纯固体混合物。 4.了解碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途。 5.掌握复分解反应发生条件,并能根据复分解反应发生的条件判断酸,碱、盐之间的反应能否发生。 【过程与方法】 1.会对实验中出现的问题进行分析归纳,培养推导能力,能分析不正确实验操作带来的后果。 2.会观察实验现象,并能通过讨论,分析、归纳整理实验现象。 【情感、态度与价值观】 1.通过了解碳酸钠、碳酸氢钠和碳酸钙在生活中的主要用途,意识到化学与生产、生活的关系。 2.通过侯德榜的事迹,进行爱国主义教育,进一步增强学生学好化学的信心及对社会的责任心。 3.进一步增强学生推导、逻辑能力,提高化学素养。 重点难点 教学重点 1.氯化钠在生活中的主要用途。 2.过滤、蒸发等分离提纯物质的基本操作技能及操作要点。 3.碳酸根离子的检验方法。 4.酸、碱、盐的反应——复分解反应。 教学难点 1.分析粗盐提纯实验的误差,掌握其原因。 2.碳酸根离子的检验方法。 3.归纳复分解反应及其发生条件。 教学方法 1.通过学生的探究实验,引导学生正确推理,了解盐的化学性质以及碳酸根离子的检验方法。 2.通过对比分析,归纳出复分解反应的特点以及发生条件。 教具、学具 1.计算机多媒体教学系统、CAI课件等。 2.仪器:试管、带导管的胶塞、试剂瓶、滴管、托盘天平、药匙、烧杯、玻璃棒、铁架台(带铁圈)、漏斗、滤纸、剪刀、蒸发皿、酒精灯、火柴、纸等。 3.药品:粗盐、碳酸钠、碳酸氢钠、碳酸钙、盐酸、澄清石灰水、蒸馏水等。 授课时数 3课时
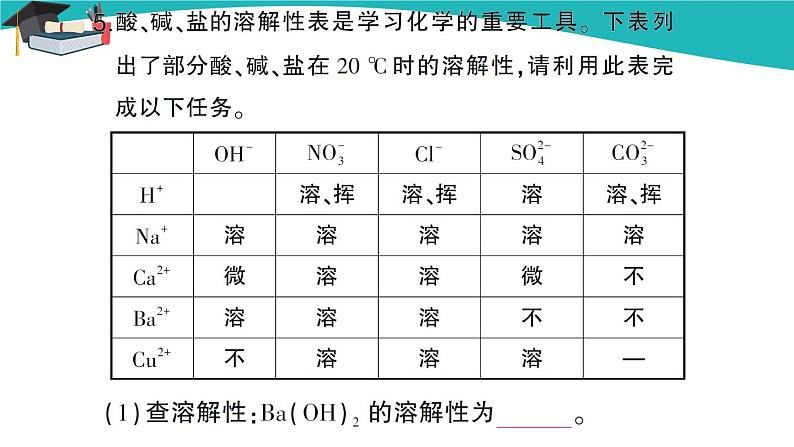
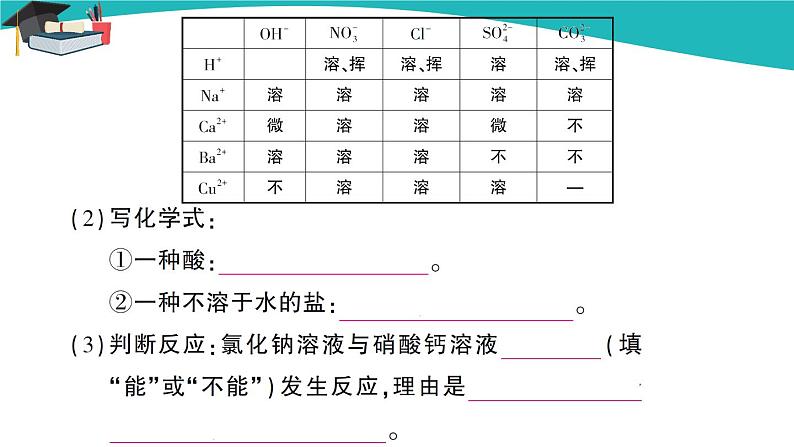
第2课时 碳酸根离子的检验及盐的性质 教学过程 回顾思考 1.由 和 构成的化合物叫做盐。我们生活中常见的盐除食盐外还有 、 、 、 等。 答案:金属离子或铵根离子 酸根离子 碳酸钠 碳酸氢钠 锰酸钾 碳酸钙(只要合理即可) 2.食盐的主要成分是 ,它是 (填“混合物”或“化合物”),是 色 体,易溶于水,其水溶液呈 性。 答案:NaCl 混合物 白 固 中 3.过滤时使用的玻璃仪器有哪些? 。蒸发时在什么时候停止加热? 。过滤能除去粗盐中的可溶性杂质吗? 。 答案:烧杯、玻璃棒、漏斗 待蒸发皿中出现较多固体时停止加热 不能 只能除去不溶性杂质 导入新课 【教师提问】焙制糕点经常要用到发酵粉,发酵粉的主要成分之一是NaHCO3,天安门前的华表是用大理石做的,大理石的主要成分是CaCO3,你知道它们都有哪些相同的性质吗? 讲授新课 三、碳酸钠、碳酸氢钠和碳酸钙 【学生阅读】学生阅读课本第73页内容,了解碳酸钠、碳酸钙、碳酸氢钠的用途。 【教师提问】你能写出这三种物质的化学式,说出它们的俗称吗? 【学生回答】碳酸钠:Na2CO3,俗称纯碱、苏打;碳酸氢钠:NaHCO3,俗称小苏打;碳酸钙:CaCO3。 【教师点拨】我们知道,碳酸钙在自然界中分布很广,我国神奇伟峻的喀斯特地貌就是因为这些地区地壳的主要成分是石灰岩(碳酸钙),而石灰岩与自然界中的二氧化碳、水能发生一系列反应,形成溶洞、钟乳石等。另外碳酸钙在生产生活中有很多用途,如作补钙剂和建筑材料等。 【教师展示】观看有关碳酸钙的图片。 【归纳总结】
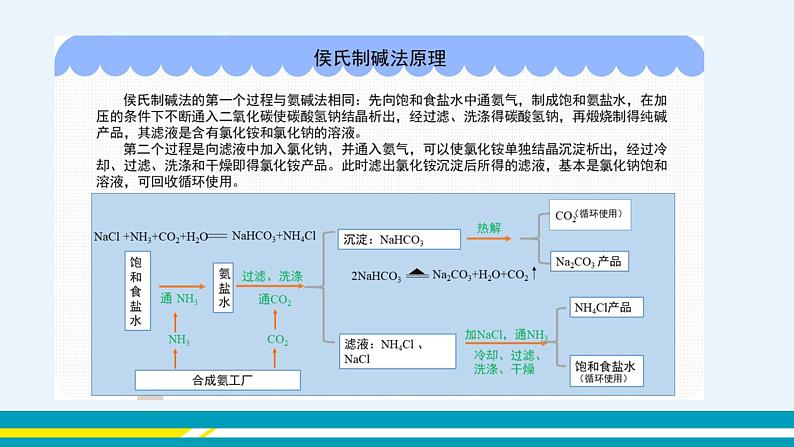
【教师提问】纯碱在化工生产中具有重要的用途,那我国纯碱工业发展的怎样呢? 【教师展示】我国制碱工业的先驱——侯德榜 【教师讲解】侯德榜的联合制碱法在制碱工业上的地位及对我国制碱工业发展的重要意义。 在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 【教师提问】观看盐酸腐蚀碳酸钙建材的图片,并写出实验室制备二氧化碳的化学方程式。 【学生回答】CaCO3+2HClCaCl2+CO2↑+H2O 【教师提问】生活中还有哪些盐能与盐酸反应产生二氧化碳气体?它们在化学式组成上有无共同点? 【归纳总结】含碳酸根离子或碳酸氢根离子。 【教师提问】碳酸钙能与盐酸反应产生CO2气体,碳酸钠和碳酸氢钠是否也能发生类似的反应? 【实验探究】向盛有0.5 g碳酸钠的试管里加入2 mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象。 用碳酸氢钠代替碳酸钠进行上述实验,并分析。
答案:
【学生回答】两次实验反应试管内都出现大量气泡,澄清石灰水均变浑浊。 【教师点拨】这两组物质反应都生成CO2气体。 【教师讲解】上述反应可以用化学方程式表示如下: Na2CO3+2HCl2NaCl+CO2↑+H2O NaHCO3+HClNaCl+CO2↑+H2O 【教师提问】通过上述三个反应的学习,发现它们有什么共同特点?由此你发现了什么?能做何归纳? 【归纳总结】含有碳酸根离子或碳酸氢根离子的盐都能与盐酸反应,生成二氧化碳气体。 【教师提问】你如何检验某物质里含碳酸根离子或碳酸氢根离子?需要哪些试剂? 【学生回答】取少量未知物,加入少量稀盐酸,看能否生成使澄清石灰水变浑浊的气体。 【归纳总结】碳酸根离子或碳酸氢根离子的检验 检验原理:组成里含有碳酸根离子或者碳酸氢根离子的盐都能与盐酸反应生成二氧化碳气体。 检验试剂:稀盐酸和澄清石灰水。 检验方法:取样品于试管中,加入适量的稀盐酸,有气体生成;把生成的气体通入澄清的石灰水,石灰水变浑浊,则证明此固体含有碳酸根离子或者碳酸氢根离子。 【教师提问】盐类物质通常具有哪些化学性质呢? 【实验探究】向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察现象。
答案:
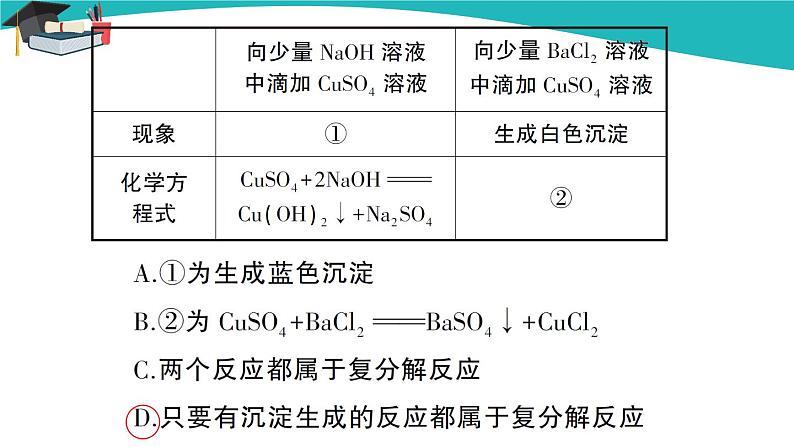
【归纳总结】现象:试管里出现白色沉淀。 分析:碳酸钠与氢氧化钙发生化学反应,生成一种白色难溶物。 【教师点拨】上述反应的化学方程式可以表示如下: Na2CO3+Ca(OH)2CaCO3↓+2NaOH 【教师提问】葛洪是我国古代著名的炼丹家。一次,葛洪之妻鲍姑用铁勺盛“曾青”(硫酸铜溶液),几天后,葛洪发现了一个奇妙的现象:铁勺变成了“铜勺”,葛洪的徒弟高兴地跳了起来:“点石成金啦!”请问:铁勺是怎样变成“铜勺”的? 【教师点拨】CuSO4+FeFeSO4+Cu 【教师提问】在医院,某病人服用硫酸钡和糖浆的混合物来检查肠胃,但是误服了碳酸钡,在胃酸的作用下会转化为有毒的氯化钡,这时,医生让病人立即服用硫酸钠进行解毒。硫酸钠为什么可以解毒? 【教师点拨】硫酸钡是不溶于酸的白色沉淀,氯化钡与硫酸钠反应生成了沉淀,就不会对人体造成危害。反应的化学方程式为Na2SO4+BaCl2BaSO4↓+2NaCl。 【归纳总结】四、盐的化学性质 1.盐+金属→新盐+新金属:CuSO4+FeFeSO4+Cu 2.盐+酸→新盐+新酸:CaCO3+2HClCaCl2+CO2↑+H2O 3.盐+碱→新盐+新碱:Na2CO3+Ca(OH)2CaCO3↓+2NaOH 4.盐1+盐2→新盐1+新盐2:Na2SO4+BaCl2BaSO4↓+2NaCl 课堂小结 本节课我们了解了三种盐的重要性质和用途,总结出了含碳酸根离子或碳酸氢根离子的盐的检验方法,并分析得出了盐的化学性质。 当堂达标 1.下面是一些常见物质的俗称,其中错误的是( ) A.碳酸氢钠——苏打 B.碳酸钠——纯碱 C.氯化钠——食盐 D.氢氧化钙——消石灰 答案:A 2.将某种固体放入稀盐酸中,有气泡产生,则这种固体肯定不是下列哪种物质( ) A.锌粒 B.纯碱 C.熟石灰 D.小苏打 答案:C 3.用序号填空:①Na2CO3 ②NaCl ③CaCO3 ④NaHCO3 (1)用作调味品的是______。 (2)用于生产玻璃和洗涤剂的是______。 (3)用作补钙剂的是______。 (4)发酵粉的主要成分之一是______。 答案:(1)② (2)① (3)③ (4)④ 4.草木灰是农家肥料,它的主要成分是一种含钾的盐。取一些草木灰加到盐酸中,生成的气体可使澄清的石灰水变浑浊。 (1)由此可推断草木灰的主要成分是________(填化学式)。 (2)写出反应的化学方程式:_______________________________。 答案:(1)K2CO3 (2)K2CO3+2HCl2KCl+H2O+CO2↑ 5.用石灰石、水、纯碱怎样制取烧碱?写出有关的化学方程式。 答案:CaCO3CaO+CO2↑ CaO+H2OCa(OH)2 Na2CO3+Ca(OH)2CaCO3↓+2NaOH 板书设计 第十一单元 盐 化肥 课题1 生活中常见的盐 第2课时 碳酸根离子的检验及盐的性质 三、碳酸钠、碳酸氢钠和碳酸钙 1.碳酸钠、碳酸钙、碳酸氢钠 2.或的检验 取少量未知物,加入少量稀盐酸,看能否生成使澄清石灰水变浑浊的气体。 四、盐的化学性质 1.盐+金属→新盐+新金属:CuSO4+FeFeSO4+Cu 2.盐+酸→新盐+新酸:CaCO3+2HClCaCl2+CO2↑+H2O 3.盐+碱→新盐+新碱:Na2CO3+Ca(OH)2CaCO3↓+2NaOH 4.盐1+盐2→新盐1+新盐2:Na2SO4+BaCl2BaSO4↓+2NaCl
|
人教版九年级下册课题1 生活中常见的盐评课课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐评课课件ppt,文件包含课题1生活中常见的盐第1课时pptx、课题1生活中常见的盐第2课时pptx、课题1生活中常见的盐第3课时pptx、课题1生活中常见的盐第4课时pptx、碳酸氢钠与酸反应mp4、碳酸钠与酸mp4、碳酸钠与盐酸微观实质mp4、碳酸钠碳酸氢钠与酸反应mp4、碳酸钠碳酸氢钠与酸反应mp4、硝酸银与氯化钠微观实质mp4、碳酸氢钠与酸反应mp4、硝酸银分解氯化钠与硝酸银反应的方程式mp4、盐酸与氢氧化钠反应微观实质mp4、实验11-2碳酸钠与氢氧化钙的反应mp4、复分解反应的实质1mp4、113粗盐中难溶杂质的去除mp4、碳酸钠与酸mp4等17份课件配套教学资源,其中PPT共85页, 欢迎下载使用。
初中化学人教版九年级下册课题2 化学肥料试讲课课件ppt: 这是一份初中化学人教版九年级下册课题2 化学肥料试讲课课件ppt,文件包含第1课时化学肥料ppt、课题2化学肥料ppt、第十一单元课题2docx等3份课件配套教学资源,其中PPT共57页, 欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐完美版ppt课件: 这是一份人教版九年级下册课题1 生活中常见的盐完美版ppt课件,文件包含第3课时物质的分类盐的化学性质ppt、第十一单元课题1《生活中常见的盐》第3课时pptx、第十一单元课题1docx等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。













