







高中化学人教版 (2019)必修 第二册第一节 认识有机化合物优秀ppt课件
展开知识点一 化学能与热能的相互转化
如图,我们知道有些燃烧反应能够释放出热能,那么其它反应的吸热和放热由什么决定的?请完成下列知识点:
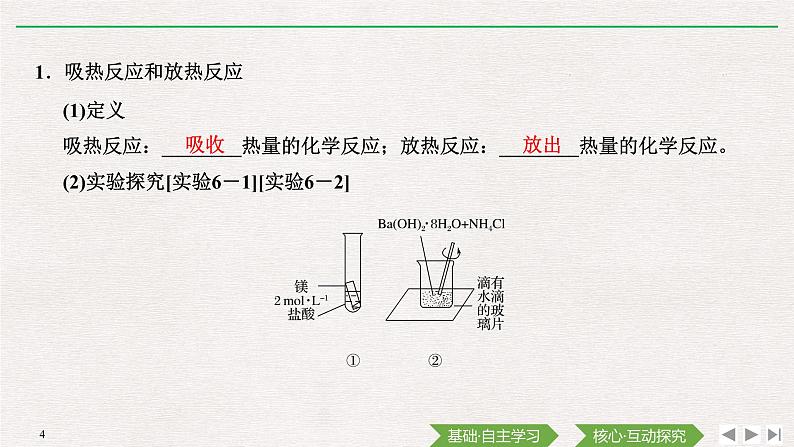
1.吸热反应和放热反应
(1)定义吸热反应:________热量的化学反应;放热反应:________热量的化学反应。(2)实验探究[实验6-1][实验6-2]
Mg+2H+===Mg2++H2↑
②Ba(OH)2·8H2O和氯化铵反应
常见的吸热反应有:大多数的分解反应,C和CO2、C和H2O的反应,Ba(OH)2·8H2O与NH4Cl的反应等。常见的放热反应有:大多数的化合反应,酸碱中和反应,金属与酸或水的反应,燃烧反应,爆炸反应等。
Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
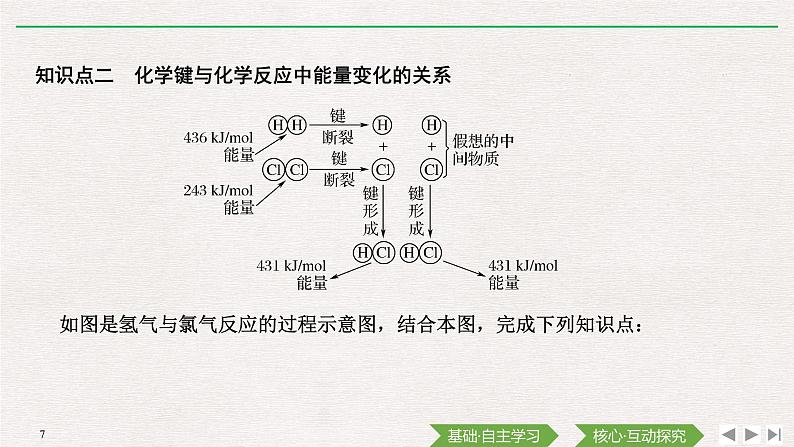
知识点二 化学键与化学反应中能量变化的关系
如图是氢气与氯气反应的过程示意图,结合本图,完成下列知识点:
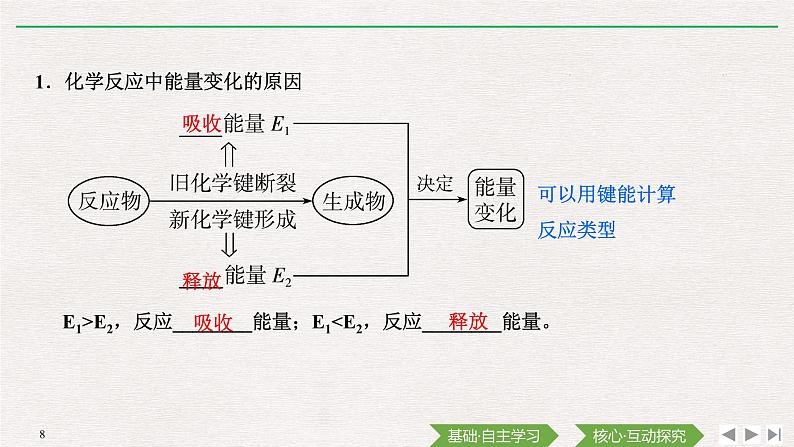
1.化学反应中能量变化的原因
可以用键能计算反应类型
E1>E2,反应________能量;E1
反应物总能量大于生成物总能量,反应________;反应物总能量小于生成物总能量,反应________。
3.化学反应中能量转化的形式
(1)化学反应的能量变化还可以看做是“储存”在物质内部的能量(________能)转化为________能、________能或________能等释放出来的过程。(2)化学反应的能量变化也可以看做是________能、________能或________能等物质外部的能量转化为物质内部的能量(________能)被“储存”起来的过程。
(1)化学键断裂需要吸收能量,化学键形成会放出能量( )(2)化学反应必然伴随能量变化( )(3)相同条件下由原子形成1 ml H—Cl 键所放出的能量与断开1 ml H—Cl 键吸收的能量相等( )(4)放出能量越多的反应通常生成物越不稳定( )(5)化学反应过程不一定都有能量变化( )(6)NaOH溶于水要释放能量( )(7)煤、石油和天然气都是化石能源( )(8)柴草燃烧时,化学能全部转化为热能( )
1.下列反应中,属于放热反应的是__________,属于吸热反应的是__________(填序号)。
答案 ②③④⑤⑥ ①⑦
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败 ⑦碳与水蒸气反应制得水煤气
2.某化学反应,设反应物总能量为E1,生成物总能量为E2。如果把化学反应中能量的变化看成是物质内部的能量与热能之间进行转变,则:
(1)若E1>E2,则该反应为__________热反应,该反应的过程可看成是“贮存”在物质内部的能量转化为________能而被释放出来的过程。(2)若E1
答案 (1)放 热(2)吸 吸收能量 热能转化为物质内部的能量而被“贮存”起来
1.不同化学反应所伴随发生的能量变化也不同。化学反应是吸热还是放热由什么决定?是不是放热反应不需加热,吸热反应都要加热?试举例说明。
提示 化学反应是吸热还是放热决定于反应物的总能量与生成物的总能量的相对大小,前者大于后者为放热反应,前者小于后者为吸热反应。有的放热反应需要加热才能发生,例如煤的燃烧就是放热反应,但需要加热或点燃引发反应;有的放热反应不需要加热,如磷的自燃。吸热反应大都需要加热,也有不需加热就能反应的,例如Ba(OH)2·8H2O固体与NH4Cl固体的反应。
2.NaOH溶于水放出热量、NaOH溶于水是放热反应吗?
提示 吸热反应和放热反应均是化学反应。注意明确某些吸热过程和放热过程不属于化学反应。如:NaOH固体溶于水,浓硫酸稀释属于放热过程;NH4NO3固体溶于水属于吸热过程,三者都不是化学反应,也就不属于吸热反应或放热反应。
学习任务1 化学键与化学反应中能量变化的关系
如图是氢气与氧气反应的示意图,结合本图完成下列讨论:
1.化学反应中能量变化的原因是任何化学反应中,旧键断裂时__________(填“吸收”或“放出”)的能量与新键形成时__________(填“吸收”或“放出”)的能量均不相等,所以任何化学反应都有能量变化。
2.氢能是一种绿色能源,H2在O2中燃烧,放出大量能量,说明2 ml H2和1 ml O2具有的总能量__________(填“大于”或“小于”)2 ml H2O具有的总能量。
3.NaCl溶于水,化学键有没有变化?如果仅从化学键角度分析,NaCl溶于水是吸热还是放热?
提示 NaCl溶于水,NaCl===Na++Cl-,只有化学键断裂,没有化学键形成,因此NaCl溶于水是吸收热量。
1.从化学键的角度理解化学反应过程中的能量变化
化学反应过程中的能量变化来源于化学反应过程中旧化学键断裂与新化学键形成时的能量变化。(1)若反应物中的化学键断开时吸收的能量高于生成物成键释放的能量,则该反应吸收能量,吸收的能量=反应物分解吸收的总能量-生成物形成释放的总能量。(2)若反应物中的化学键断开时吸收的能量低于生成物成键释放的能量,则该反应放出能量,放出的能量=生成物形成释放的总能量-反应物分解吸收的总能量。
2.从总能量的角度理解化学反应过程中的能量变化
一个确定的化学反应完成后的结果是吸收能量还是放出能量取决于反应物的总能量与生成物的总能量的相对大小。具体情况见下表:
【例题】 已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是(双选)( )
A.每生成2分子AB(g)吸收b kJ热量B.该反应热ΔH=+(a-b) kJ /mlC.该反应中反应物的总能量高于生成物的总能量D.断裂1 ml A—A和1 ml B—B键,吸收a kJ能量
解析 形成化学键放出热量,每生成2 ml AB放出b kJ热量,A项错误;该反应焓变=断裂化学键吸收热量-形成化学键所放出热量,所以焓变为ΔH=+(a-b)kJ/ml;B项正确;C.反应是吸热反应,依据能量守恒可知,反应中反应物的总能量低于生成物的总能量,故C项错误;断裂1 ml A—A键和1 ml B—B键,吸收a kJ能量,D项正确。
变式训练 根据下面的信息,判断下列叙述正确的是( )
学习任务2 (核心素养)吸热反应与放热反应的比较
吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。(2)根据化学键断裂或形成时的能量变化判断——用于计算。若断裂反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,属于放热反应,反之是吸热反应。
放热反应 吸热反应
(3)根据反应物和生成物的相对稳定性判断。由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。(4)根据反应条件判断。凡是持续加热才能进行的反应一般就是吸热反应。
【素养解题】[典例示范] 下列说法正确的是( )①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行A.只有③④B.只有①②C.①②③④D.②③④
1.已知反应A+B===C+D的能量变化如图所示,下列说法正确的是( )
A.该反应是放热反应B.只有在加热条件下才能进行C.反应物的总能量高于生成物的总能量D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
解析 根据图像可知反应物的总能量低于生成物的总能量,则反应是吸热反应。A.该反应是吸热反应,错误;B.反应条件与反应是放热反应还是吸热反应无关系,错误;C.反应物的总能量低于生成物的总能量,错误;D.反应吸热,则反应中断开化学键吸收的总能量高于形成化学键放出的总能量,正确。
解析 H2SO4与Ba(OH)2溶液混合,酸与碱发生中和反应,是放热反应;燃烧是指剧烈的发光、发热的反应,因而都是放热反应;复分解反应,有的是放热反应,如酸碱中和反应,有的是吸热反应,如氢氧化钡晶体与氯化铵晶体的反应。
2.生活中每时每刻都发生着各种化学反应,下列反应不一定属于放热反应的是( )
A.H2SO4与Ba(OH)2溶液的反应B.燃烧反应C.复分解反应D.中和反应
A.放出能量的反应B.吸收能量的反应C.氧化还原反应D.可逆反应
解析 依题意,断裂1 ml H—H键和1 ml I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 ml H—I键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以,该反应的正反应是放出能量的反应;根据反应式可知该反应是可逆反应,也是氧化还原反应。
4.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化:
下列说法中正确的是(双选)( )A.1 ml N2(g)与1 ml O2(g)反应吸收的能量为180 kJB.1 ml N2(g)和1 ml O2(g)具有的总能量小于2 ml NO(g)具有的总能量C.通常情况下,N2(g)与O2(g)混合能直接生成NO(g)D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
解析 A.1 ml N2(g)与1 ml O2(g)反应吸收的能量为946 kJ+498 kJ-2×632 kJ=180 kJ,A正确;B.1 ml N2(g)和1 ml O2(g)具有的总能量小于2 ml NO(g)具有的总能量,B正确;C.在放电条件下,N2(g)与O2(g)混合能直接生成NO(g),C错误;D.NO不是酸性氧化物,与NaOH溶液不反应,D错误。
5.如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL稀盐酸。
回答下列问题:(1)实验中观察到的现象是_____________________________________________________________________________________________________。(2)产生上述现象的原因是_______________________________________________________________________________________________。(3)写出有关反应的离子方程式__________________________________________________________________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
解析 (1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊。(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为:Mg+2H+===Mg2++H2↑,析出固体的离子方程式为:Ca2++2OH-===Ca(OH)2↓。(4)当反应物的总能量高于生成物的总能量时,反应是放热反应,则 MgCl2溶液和H2的总能量小于镁片和盐酸的总能量。
答案 (1)镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊(2)镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出(3)Mg+2H+===Mg2++H2↑、Ca2++2OH-===Ca(OH)2↓ (4)小于
高中第一节 化学反应与能量变化课前预习课件ppt: 这是一份高中第一节 化学反应与能量变化课前预习课件ppt,共33页。PPT课件主要包含了导入一,导入二,ABCD,课堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化授课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第一节 化学反应与能量变化授课课件ppt,共39页。
人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化获奖ppt课件: 这是一份人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化获奖ppt课件,文件包含配套新教材-高中化学-RJ-必修第二册-第六章第一节第1课时化学反应与热能ppt、第六章第一节第1课时化学反应与热能docx等2份课件配套教学资源,其中PPT共12页, 欢迎下载使用。













