





初中化学鲁教版九年级上册第三节 大自然中的二氧化碳课前预习ppt课件
展开大气中二氧化碳的产生途径:人和动植物的呼吸、化石燃料的燃烧、微生物的分解作用等。
大气中二氧化碳的消耗途径:植物的光合作用等。
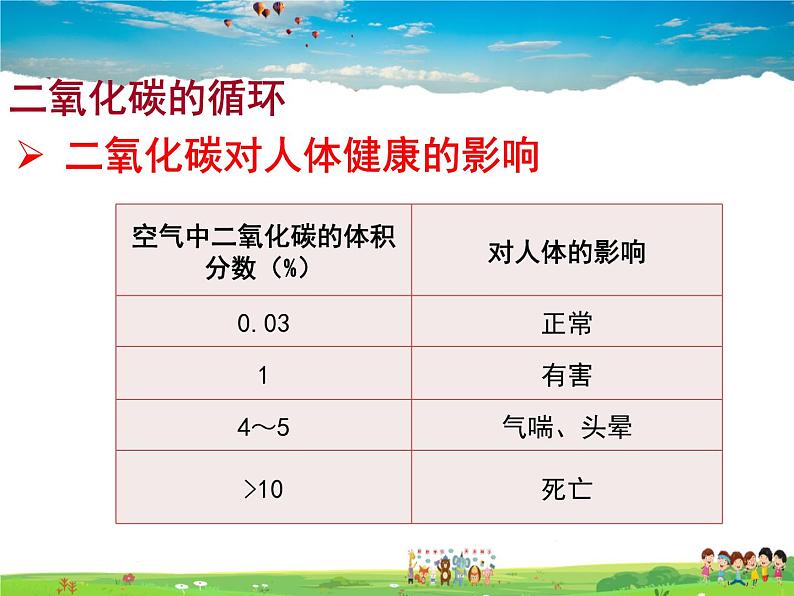
二氧化碳对人体健康的影响
当大气中的二氧化碳或某些其他气体的含量升高时,会增强大气对太阳光中红外线辐射的吸收,阻止地球表面的热量向外散发,使地球表面的平均气温上升,这就是所谓的“温室效应”
煤、石油、天然气消耗量急剧增加,向空气中排放大量的二氧化碳;森林遭到破坏,使二氧化碳的吸收量减少,从而造成空气中的二氧化碳含量不断上升
两极冰川融化,海平面上升淹没部分沿海城市
减少煤、石油、天然气等化石燃料的燃烧;开发新能源,利用太阳能、风能、地热能等;大力植树造林,严禁乱砍滥伐森林
一般情况下, 二氧化碳不能燃烧,也不支持燃烧。
二氧化碳不能供给呼吸。
二氧化碳能使澄清的石灰水变浑浊。
二氧化碳能和水反应生成碳酸。
CO2 + H2O = H2CO3
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
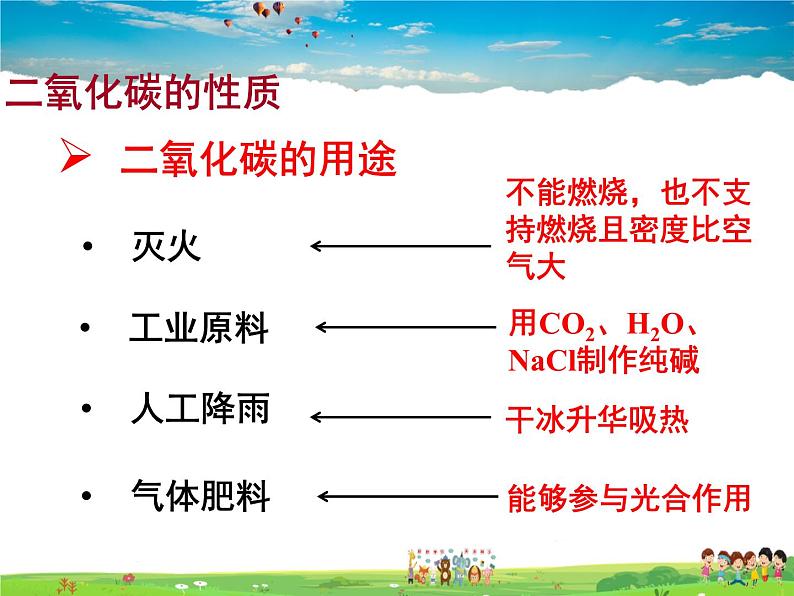
不能燃烧,也不支持燃烧且密度比空气大
用CO2、H2O、NaCl制作纯碱
石蜡+氧气 二氧化碳+水
列举你所知道的能生成二氧化碳的反应,与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由。
科学家研究发现:凡是含碳酸根离子(CO32-)的化合物都能与稀盐酸(HCl)或稀硫酸(H2SO4)等在常温下反应生成CO2。生产生活中常见的石灰石、大理石、蛋壳、贝壳、水垢等其主要成分都是碳酸钙(CaCO3),纯碱碳酸钠(Na2CO3),小苏打碳酸氢钠(NaHCO3)都可与以上两种酸反应制取CO2。
实验室制取二氧化碳的理想原料
石灰石(主要成分CaCO3)碳酸钠粉末(Na2CO3)稀盐酸(有效成分HCl)稀硫酸(有效成分H2SO4)
注意事项:(1)注意仪器的使用和药品的取用;(2)重点比较反应速率的快慢。
甲 乙 丙 丁
注意:①将半药匙碳酸钠粉末分别放入甲、丁试管中,两至三粒石灰石分别放入乙、丙试管中。②向甲、乙试管中分别倒入1/5试管的稀盐酸,丙、丁试管中分别倒入1/5试管的稀硫酸。 ③比较气泡产生的快慢。
虽然该反应能生成二氧化碳:CaCO3+H2SO4==CaSO4+H2O+CO2但生成的CaSO4微溶于水,覆盖在大理石表面,形成一层薄膜,使石灰石与酸不能接触,反应难以进行
稀盐酸与碳酸钠粉末反应
Na2CO3+2HCl=2NaCl+H2O+CO2
实验室制取二氧化碳的反应原理
CaCO3+2HCl=CaCl2+H2CO3
H2CO3=H2O+CO2↑
CaCO3+2HCl = CaCl2+H2O+CO2↑
实验室制取二氧化碳能不能用浓盐酸代替稀盐酸?
不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。
发生装置的选择:反应物的状态 固体和液体反应条件 不需要加热
实验室制取二氧化碳的装置选择
收集装置的选择:二氧化碳的密度比空气大;能溶于水,且与水反应,应选择向上排空气法收集。
实验室制取二氧化碳的几种简易装置
实验室制取二氧化碳的装置
装置气密性的检查方法:
2.从长颈漏斗向锥形瓶中加水,至水面没过长颈漏斗下端;
3.一段时间后若长颈漏斗中液面不再下降,说明装置气密性良好。
长颈漏斗必须液封导管应在橡皮塞下少许导管应接近集气瓶底部
防止气体从长颈漏斗口逸出
能充分排走集气瓶中的空气
检查气密性 ②
加大理石 ③
加稀盐酸 ④
实验室制取二氧化碳的步骤
氧气、二氧化碳实验室制法的比较
CaCO3+2HCl==CaCl2+H2O+CO2↑
总结实验室制取气体的一般思路
1.探究反应原理。2.探究反应的发生装置和收集装置。3.探究气体的检验和验满的方法。
化学九年级上册第三节 大自然中的二氧化碳示范课免费ppt课件: 这是一份化学九年级上册第三节 大自然中的二氧化碳示范课免费ppt课件,共24页。PPT课件主要包含了认识二氧化碳,你的猜想,你的实验方案,塑料瓶变瘪,二氧化碳能溶于水,CO2固体,人工降雨,干冰冷饮,下层蜡烛比上层先熄灭,不可燃等内容,欢迎下载使用。
化学九年级上册第三节 大自然中的二氧化碳图片ppt课件: 这是一份化学九年级上册第三节 大自然中的二氧化碳图片ppt课件,共31页。PPT课件主要包含了CO2气体,无色液体,雪花状固体,干冰的用途,实验一,想一想,我们应该做些什么呢,开发新能源,减少化石燃料的燃烧量,保护绿色植物等内容,欢迎下载使用。
2021学年第三节 大自然中的二氧化碳教学演示课件ppt: 这是一份2021学年第三节 大自然中的二氧化碳教学演示课件ppt,共60页。PPT课件主要包含了二氧化碳的循环,二氧化碳的制取,塑料瓶变瘪,二氧化碳能溶于水,你的猜想,提供仪器和药品,验证猜想,检验二氧化碳的反应,除去二氧化碳的反应,二氧化碳的用途等内容,欢迎下载使用。













