人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表第1课时教案
展开第一节 原子结构与元素周期表
课题 | 原子结构与元素周期表(第1课时) | 单元 | 4 | 学科 | 化学 | 年级 | 一年级 |
教材 分析 | 本节教学内容是人教版高中化学必修第一册第四章《物质结构 元素周期律》第一节《原子结构与元素周期表》的第一课时。该部分的教学内容涉及到原子结构的概念,原子核外电子数的规律特点,元素周期表的元素排布及其规律,同位素和核素的概念及相关内容,碱金属元素与卤族元素的物理与化学特性。随着元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,人们从微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念。本节安排了“原子结构的概念”和“原子核外电子数的规律特点”这两部分内容,是第四章第一节中开篇的知识点,引入了有关原子结构的相关概念和知识点。通过学习这部分知识,学生将熟悉并掌握原子结构的概念;学习并掌握原子核外电子数的规律特点;学通过概念和规律特点求解相关问题。通过本节内容的学习,学生将明确原子结构的特点,感受伴随原子结构的不同带来的化学元素不同的奇妙特性,由此得到启发:可以通过对原子结构的特点分析,推测出新化学元素的性质特点。 | ||||||
教学目标与核心素养 | 宏观辨识与微观探析:从宏观上学习不同元素的原子结构,从微观上辨析不同元素原子结构的区别与相似点,体会微观粒子的变化对宏观物质的性质的影响。 证据推理与模型认知:通过物质分类的基本模型,理解不同元素的相似或不同特点,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。 科学探究与创新意识:熟悉原子核外电子数的递变规律,熟练掌握通过原子结构分析元素性质的能力,体会化学研究过程中的科学方法。 科学精神与社会责任:通过对元素原子结构的学习和理解,掌握更高效的学习方法,建立高效学习的科学精神。 | ||||||
重点难点 | 1. 熟悉并掌握原子结构的概念。 2. 熟悉并掌握原子核外电子数的规律。 | ||||||
教学过程 |
教学环节 | 教师活动 | 学生活动 | 设计意图 |
导入新课 | 教师:丰富多彩的物质世界是由一百多种元素组成的。最初,人们通过分类整理的方法对元素之间的联系进行研究。随着元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,人们从微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念。 教师:元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。元素周期表的建立成为化学发展史上的重要的里程碑之一。 教师提问:20世纪初,原子结构的奥秘被揭示后,人们对元素周期表的认识更加完善。那么,原子结构与元素周期表之间有怎样的关系呢? 教师:引出本节课学习内容
| 认真倾听老师的描述,适当时候做好笔记。
在老师的带领下,对问题进行思考。引出本节课内容。
| 图文并茂,能够较快地让学生进入本节课堂学习。
简单的思维训练能够让学生不害怕对本节课知识点学习,感悟本节课的知识点。 |
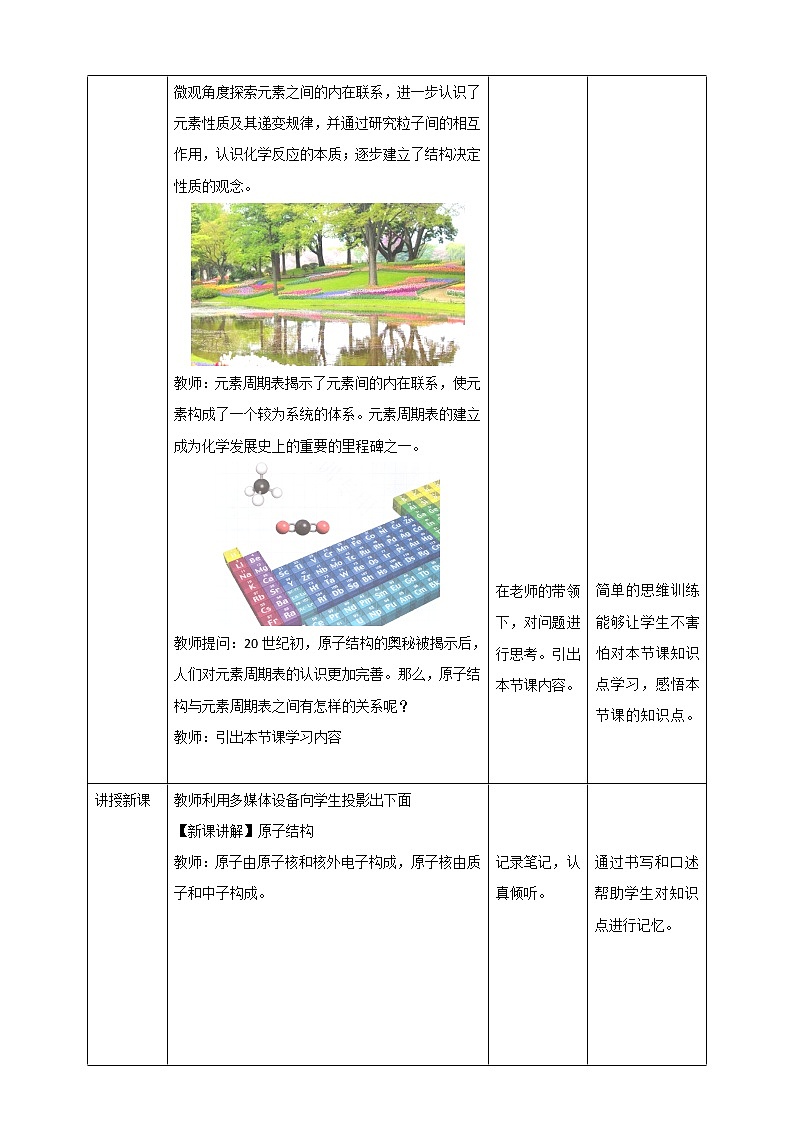
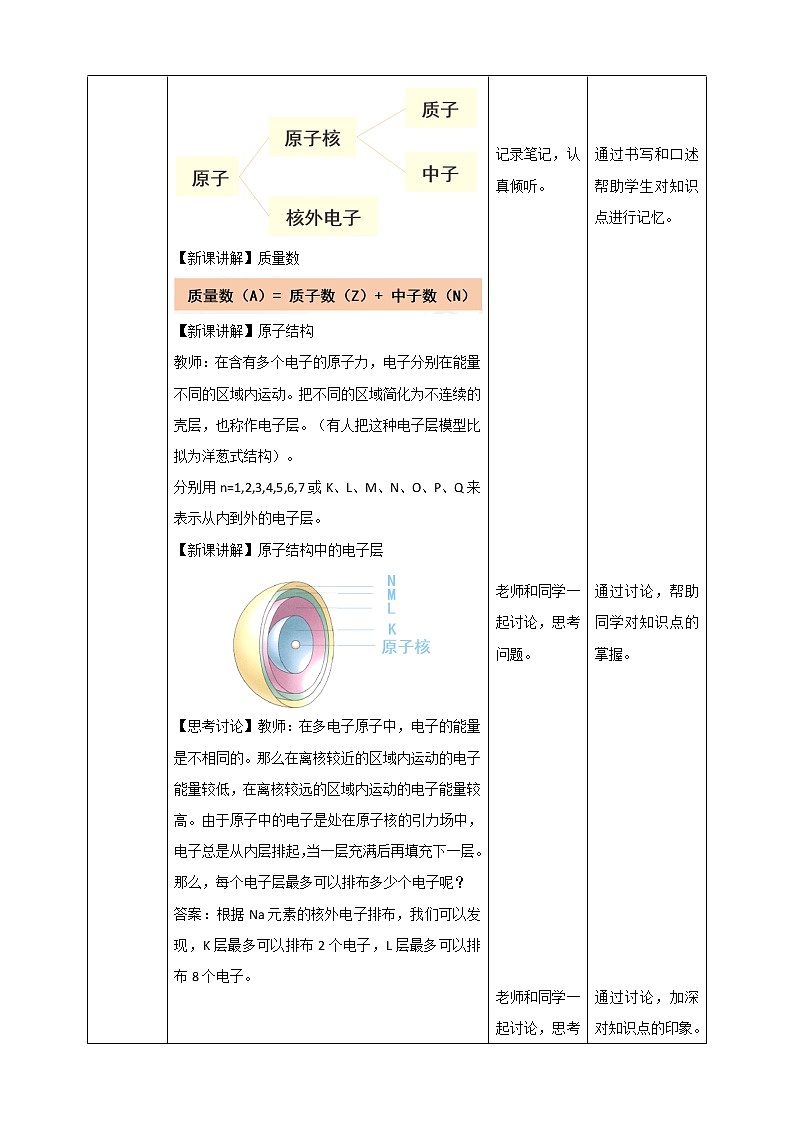
讲授新课 | 教师利用多媒体设备向学生投影出下面 【新课讲解】原子结构 教师:原子由原子核和核外电子构成,原子核由质子和中子构成。 【新课讲解】质量数 【新课讲解】原子结构 教师:在含有多个电子的原子力,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,也称作电子层。(有人把这种电子层模型比拟为洋葱式结构)。 分别用n=1,2,3,4,5,6,7或K、L、M、N、O、P、Q来表示从内到外的电子层。 【新课讲解】原子结构中的电子层 【思考讨论】教师:在多电子原子中,电子的能量是不相同的。那么在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。由于原子中的电子是处在原子核的引力场中,电子总是从内层排起,当一层充满后再填充下一层。那么,每个电子层最多可以排布多少个电子呢? 答案:根据Na元素的核外电子排布,我们可以发现,K层最多可以排布2个电子,L层最多可以排布8个电子。 【思考讨论】下表是稀有气体元素原子的电子层排布,根据表格回答问题。 (1)当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少? 答案:当K层为最外层时,最多能容纳2个电子数除了K层,其他各层为最外层时,最多能容纳8个电子数。 (2)次外层最多容纳的电子数是多少? 答案:次外层最多容纳18个电子数。 (3)你能归纳出第n层最多能容纳的电子数吗? 答案:纵向观察数据,K层最多容纳2个电子,L层最多容纳8个电子,M层最多容纳18个电子,N层最多容纳32个电子……利用数学归纳法,可以总结出第n层最多能容纳2n2电子数。 (4)请你根据所归纳的规律,用原子结构示意图表示核电荷数为1,6,11,15,17号元素原子的核外电子排布。 【思维启迪】原子核外电子数的规律 原子核外第n层最多能容纳的电子数为2n2 。 无论原子有几个电子层,其最外层中的电子数最多只有8个。(K层只有2个) 原子最外电子层有8个电子(最外层为K层时,最多只有2个电子)的结构是相对稳定的结构。 【思维启迪】原子结构模型 教师:原子结构模型是科学家根据科学猜想和分析,通过对原子结构的形象和描摹而建构的揭示原子本质的认知模型。 【新课讲解】元素周期表 1869年,俄国化学家门捷列夫在前人研究的基础上,将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。 【思考讨论】按照元素在周期表中的顺序给元素编号,得到原子序数。在发现原子的构成及结构之后,人们发现,原子序数与元素的原子结构之间存在着如下关系: 原子序数 = 核电荷数 = 质子数 = 核外电子数 【课堂达标】 1.填写下列横线 原子由_______和________构成,原子核由____和____构成。原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做______。 解析:原子由原子核和核外电子构成,原子核由质子和中子构成。原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。 2. 下列关于原子结构的说法正确的是( ) A.原子由原子核和核外电子构成 B.对于任何微粒,质子数等于核外电子数都成立 C.当微粒达到稳定结构时,最外层电子数一定是8 D.原子的质量等于原子核的质量 解析:选项A中,原子由原子核和核外电子构成,原子核由质子和中子构成,A项正确;选项B中,离子的质子数不等于核外电子数,B项错误;选项C中,由第一周期元素可知,最外层电子数小于8,C项错误;选项D中,原子的质量主要集中在原子核上,D项错误。因此选A。 3. 下列叙述不正确的是( ) A.同一周期原子半径从左到右依次减小 B.同一周期元素最高化合价从左到右不一定增大 C.同一主族元素的化学性质相同 D.同一主族元素的化学性质相似 解析:选项A中,同一周期原子半径从左到右依次减小,故A错误;选项B中,同一周期元素最高化合价从左到右不一定增大,故B错误;选项C和D中,同一主族元素的化学性质相同,故D错误,因此选C。 4. 短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( ) A.X与Y不可能位于同一主族 B.X与Y一定位于同一周期 C.X与Y可能形成共价化合物XY D.X与Y可能形成离子化合物XY 解析:选项A中,若短周期元素X、Y分别为Li与H时,原子序数相差2,二者位于同一主族,故A错误;选项B中,两种元素不一定处于同一周期,如钠元素和氟元素,故B错误;选项C中,短周期元素X、Y分别为C与O,可以形成共价化合物CO,故C正确。因此选C。 |
记录笔记,认真倾听。
记录笔记,认真倾听。
老师和同学一起讨论,思考问题。
老师和同学一起讨论,思考问题。
老师和同学一起讨论,思考问题。
老师和同学一起讨论,思考问题。
老师和同学一起讨论,思考问题。
记录笔记,认真倾听。
记录笔记,认真倾听。
同学们在老师的引导下,讨论。
学生自行思考,完成课堂练习。 |
通过书写和口述帮助学生对知识点进行记忆。
通过书写和口述帮助学生对知识点进行记忆。
通过讨论,帮助同学对知识点的掌握。
通过讨论,加深对知识点的印象。
通过讨论,加深对知识点的印象。
通过讨论,加深对知识点的印象。
通过讨论,加深对知识点的印象。
通过书写和口述帮助学生对知识点进行记忆。
通过书写和口述帮助学生对知识点进行记忆。
通过讨论,加深对知识点的印象。
通过对习题的解答,加深对知识点的巩固。 |
课堂小结 | 原子结构:原子由原子核和核外电子构成,原子核由质子和中子构成。 原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
原子核外电子数的规律:①原子核外第n层最多能容纳的电子数为2n2 。 ②无论原子有几个电子层,其最外层中的电子数最多只有8个。(K层只有2个) ③原子最外电子层有8个电子(最外层为K层时,最多只有2个电子)的结构是相对稳定的结构。 | 学生和老师一起快速回顾本次课的学习内容。 | 通过对课堂学习知识的总结,帮助同学们加深印象。 |
板书 |
| 学生在笔记本上对板书进行誊写。 | 方便学生课后回顾。 |
人教版 (2019)必修 第一册第一节 原子结构与元素周期表第1课时教案: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表第1课时教案,共5页。教案主要包含了思考·讨论等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表第1课时教学设计: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表第1课时教学设计,共5页。教案主要包含了思考·讨论等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一章 物质及其变化第一节 物质的分类及转化第3课时教学设计: 这是一份人教版 (2019)必修 第一册第一章 物质及其变化第一节 物质的分类及转化第3课时教学设计,共5页。教案主要包含了教学目标,教学重难点,教学过程,课堂小结,板书设计等内容,欢迎下载使用。













