




高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质课文ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质课文ppt课件,共52页。
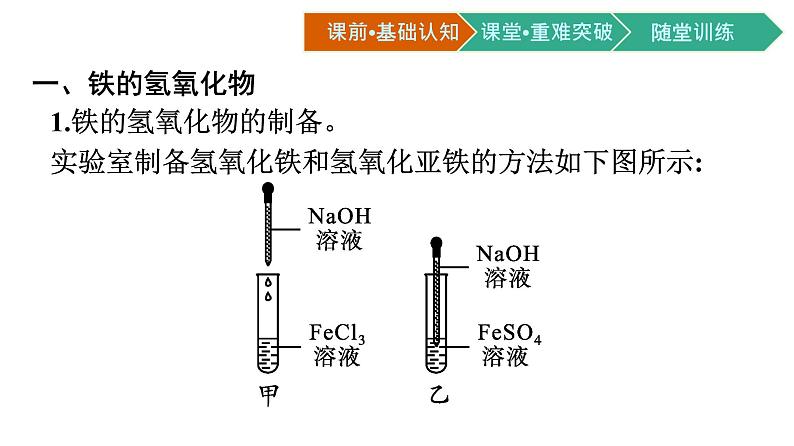
一、铁的氢氧化物1.铁的氢氧化物的制备。实验室制备氢氧化铁和氢氧化亚铁的方法如下图所示:
(1)图甲实验中观察到的现象是 有红褐色沉淀生成 。 反应的离子方程式是 Fe3++3OH-═Fe(OH)3↓ 。 (2)图乙实验中先观察到有 白色沉淀 生成,迅速变成 灰绿 色,最后变成 红褐 色,反应的化学方程式是 FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , 4Fe(OH)2+O2+2H2O═4Fe(OH)3 。
制备氢氧化亚铁时,“白色沉淀迅速变成灰绿色,最后变成红褐色”,沉淀颜色变化的原因是什么?说明Fe(OH)2具有什么性质?提示:这是因为白色氢氧化亚铁被溶解在溶液中的氧气氧化成了红褐色的氢氧化铁。说明氢氧化亚铁具有还原性。从Fe的化合价来看,Fe有+2、+3价,Fe(OH)2中的Fe是+2价,既有氧化性也有还原性,故氢氧化亚铁具有还原性。
2.铁的氢氧化物的性质。(1)氢氧化亚铁[Fe(OH)2]。①物理性质: 白 色固体, 不 溶于水。 ②化学性质。碱性:与盐酸反应的离子方程式为 Fe(OH)2+2H+═Fe2++2H2O 。 还原性:与氧气反应的化学方程式为 4Fe(OH)2+2H2O+O2═4Fe(OH)3 。
(2)氢氧化铁[Fe(OH)3]。①物理性质: 红褐 色固体, 不 溶于水。 ②化学性质。碱性:与盐酸反应的离子方程式为 Fe(OH)3+3H+═Fe3++3H2O 。
二、铁盐和亚铁盐1.常见的铁盐有 Fe2(SO4)3、FeCl3 等,常见的亚铁盐有 FeSO4、FeCl2 等。
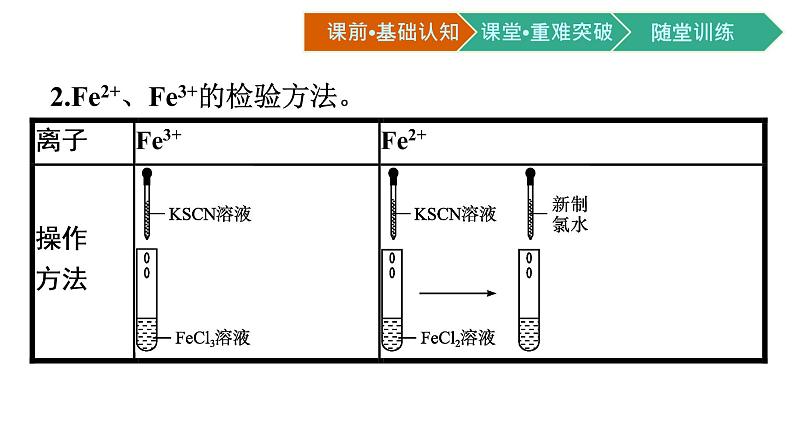
2.Fe2+、Fe3+的检验方法。
3.Fe2+与Fe3+的转化。
(1)实验现象:在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成 浅绿 色,再加KSCN溶液,溶液 不变色 ,再加入氯水后,溶液变成 红色 。 (2)上述实验中有关反应的离子方程式是 2Fe3++Fe═3Fe2+ , 2Fe2++Cl2═2Fe3++2Cl- 。 (3)结论:由上述实验可知,Fe3+遇到 较强 的还原剂,会被还原成Fe2+;Fe2+在 较强 氧化剂的作用下,会被氧化成Fe3+。
根据我们学习过的知识想一想Fe2+、Fe3+的检验方法有哪些? 提示:(1)观察法:含Fe2+的溶液呈浅绿色,含Fe3+的溶液呈棕黄色。(2)加碱法:加入NaOH溶液,若产生的白色沉淀迅速变为灰绿色,最后变为红褐色,则原溶液中含有Fe2+;若直接产生红褐色沉淀,则原溶液中含有Fe3+。
(3)加KSCN溶液,若无明显现象,再加新制氯水溶液变为红色,则原溶液中含有Fe2+;若溶液直接变为红色,则原溶液中含有Fe3+。
一 铁的氢氧化物重难归纳铁的氢氧化物。
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么在实验室里,用FeSO4溶液和NaOH溶液制备Fe(OH)2时,如何能长时间看到白色的Fe(OH)2沉淀呢?
提示:①Fe2+极易被氧化,所以FeSO4溶液要现用现配。②为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。③为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
典例剖析用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。(1)FeSO4溶液与NaOH溶液反应的离子方程式为 。 (2)用硫酸亚铁晶体配制上述FeSO4溶液时,为防止氧化还需加入 。 (3)除去蒸馏水中溶解的O2,常采用 的方法。
(4)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下,再挤出溶液,这样操作的理由是 ;如若不插入FeSO4溶液的液面以下就挤出NaOH溶液,产生的实验现象是 ,原因为 (用化学方程式表示)。
答案:(1) Fe2++2OH-══Fe(OH)2↓(2)铁屑(或还原铁粉)(3)煮沸(4)避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀 生成的白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O══4Fe(OH)3
解析:(2)用硫酸亚铁晶体配制FeSO4溶液时,为了防止Fe2+被氧化,通常在溶液中加入一些铁屑(或还原铁粉)。(3)除去蒸馏水中溶解的O2,常采用加热煮沸的方法。(4)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下再挤出,可以防止溶液在下落过程中接触氧气,从而避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀。
学以致用1.下列关于Fe(OH)2的制备能够成功的是( )。A.向FeCl2溶液中逐滴加入NaOH溶液B.向FeSO4溶液中逐滴加入氨水C.先将吸有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2D.取新配制的FeSO4溶液适量放入试管中,然后向试管内逐滴加入NaOH溶液
答案:C解析:Fe(OH)2的制备可用Fe2+的盐溶液与强碱或弱碱反应制得,但由于Fe(OH)2有很强的还原性,接触空气迅速被氧化生成Fe(OH)3,所以制备中特别注意隔绝 Fe(OH)2与空气的接触。
2.在如图所示的装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。(1)在试管Ⅰ里加入的试剂是 。 (2)在试管Ⅱ里加入的试剂是 。 (3)为了制得白色的Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开弹簧夹,塞紧塞子后的实验步骤是 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
答案:(1)稀硫酸、铁屑(2)NaOH溶液(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧弹簧夹(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
解析:(1)由所给试剂及装置特点知,试管Ⅰ为封闭系统,应为产生H2并赶尽溶液中的空气及液面上方空气的装置,故试管Ⅰ中加入的试剂为铁和稀硫酸。(2)试管Ⅱ中加入的试剂为NaOH溶液。(3)为确保实验在无氧状态下进行,必须把系统中的O2排除干净,故接下来的操作应为检验试管Ⅱ出口处排出的氢气纯度,当产生氢气较纯时再夹紧弹簧夹。(4)由于试管Ⅰ中产生的H2充满了Ⅰ、Ⅱ两支试管,外界空气不易进入,即Fe(OH)2是在H2的还原性气氛中产生的,故Fe(OH)2的白色沉淀可保持较长的时间。
二 铁盐和亚铁盐重难归纳1.Fe3+、Fe2+的检验。
(1)如何检验含Fe3+的溶液中是否有Fe2+?提示:由于溶液中含有Fe3+,利用NaOH溶液或KSCN溶液都无法证明溶液中是否含有Fe2+,可以利用Fe2+的还原性,向溶液中加入KMnO4酸性溶液,若溶液紫色褪去证明溶液中含有Fe2+。
(2)怎么除去FeCl2溶液中的少量Fe3+?从中你得出一个什么样的结论?提示:加足量的铁粉振荡、静置、过滤。其反应的离子方程式为2Fe3++Fe═3Fe2+。由此可知:含同一元素的不同价态的物质反应时,生成含该元素中间价态的物质,如:C+CO2 2CO。
(2)Fe2+既有氧化性又有还原性。可被强氧化剂(如Cl2、HNO3、KMnO4酸性溶液等)氧化为Fe3+,可被还原剂(Mg、Al、Zn、CO、C等)还原为Fe。(3)Fe3+具有较强的氧化性。可被还原剂(如Fe、Cu等)还原为Fe2+,被强还原剂(Mg、Al、Zn、CO等)还原为Fe。
典例剖析金属及其化合物在人类生活、生产中发挥着重要的作用。印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用FeCl3溶液作为“腐蚀液”,反应中有CuCl2和FeCl2生成。如下是某工程师为了从使用过的腐蚀废液中回收铜并重新获得FeCl3溶液所采用的工艺流程图:
请回答下列问题。(1)实验室中,检验溶液中存在Fe3+的试剂是 ,证明Fe3+存在的现象是 。 (2)写出FeCl3溶液与金属铜发生反应的离子方程式: 。 (3)写出上述流程图中加入或生成的有关物质的化学式:① ,② ,④ 。 (4)含有②的滤液与⑤反应的化学方程式为 。
答案:(1)KSCN溶液 溶液变成红色
解析:废液中含有FeCl2、CuCl2、FeCl3。向废液中加入过量Fe,发生反应的离子方程式为2Fe3++Fe══3Fe2+, Cu2++Fe══Fe2++Cu。然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe。向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2。向滤液中通入过量Cl2,发生反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-,从而得到FeCl3溶液。
学以致用1.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )。A.Cu2+B.Fe3+C.Fe2+D.H+答案:C解析:因所剩固体能被磁铁吸引,说明Fe有剩余。因2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2H++Fe═Fe2++H2↑,即Fe3+、Cu2+、H+可与Fe反应,不可能大量存在。
2.要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作的最佳顺序为( )。①加入足量氯水 ②加入足量KMnO4酸性溶液 ③加入少量KSCN溶液A.①③B.③②C.③①D.①②③答案:C解析:先加入少量KSCN溶液,若溶液不变红色,证明无Fe3+,然后加足量的氯水,若溶液出现红色,说明有Fe2+存在。
1.下列物质反应后一定有+3价铁生成的是( )。①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应后,再向其中加入新制氯水 ③Fe和Fe2O3的混合物溶于盐酸中A.①B.②③C.①②D.①②③
答案:C解析:①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原;②中Fe与稀硫酸反应只能生成Fe2+,但加入新制氯水后,氯水中的氯分子能将Fe2+氧化成Fe3+;③中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2,若铁是不足的,则溶液中可能存在Fe3+。
2.下列铁的化合物:①FeCl2 ②Fe(OH)3 ③FeCl3,其中能通过化合反应直接制得的是( )。A.①②B.②③C.①③D.①②③答案:D
3.只用一种试剂就可将AgNO3溶液、KSCN溶液、稀硫酸、NaOH溶液四种无色溶液区分开,该试剂是( )。A.BaCl2溶液B.CuCl2溶液C.FeCl3溶液D.FeCl2溶液答案:C解析:氯化钡溶液不能鉴别KSCN溶液和氢氧化钠溶液,氯化铜溶液和氯化亚铁溶液均不能鉴别KSCN溶液和稀硫酸。
4.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )。A.①②B.①③C.②③D.①②③
答案:B解析:因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中,③中液面上加植物油阻止了空气进入;②由于能接触到空气中的O2,故不能较长时间观察到白色沉淀。
5.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 ml·L-1 FeCl3溶液、0.1 ml·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式: 。
(2)设计实验方案,完成下列表格。
解析:(1)在反应中Fe2+做还原剂,体现其还原性,因此应选择氧化剂,所以选用新制氯水,反应为2FeCl2+Cl2═2FeCl3。(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe═3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2溶液中滴加KSCN溶液,溶液不变红。(3)向FeCl2溶液中加入锌粉,发生反应的离子方程式为Zn+Fe2+═Fe+Zn2+。
相关课件
这是一份人教版 (2019)必修 第一册第二节 金属材料教案配套ppt课件,共42页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料作业ppt课件,共29页。PPT课件主要包含了答案D等内容,欢迎下载使用。
这是一份高中化学必修一 3.1.2 铁的氢氧化物 铁盐和亚铁盐课件新,共18页。











