



鲁科版 (2019)选择性必修2第1章 原子结构与元素性质第2节 原子结构与元素周期表评课课件ppt
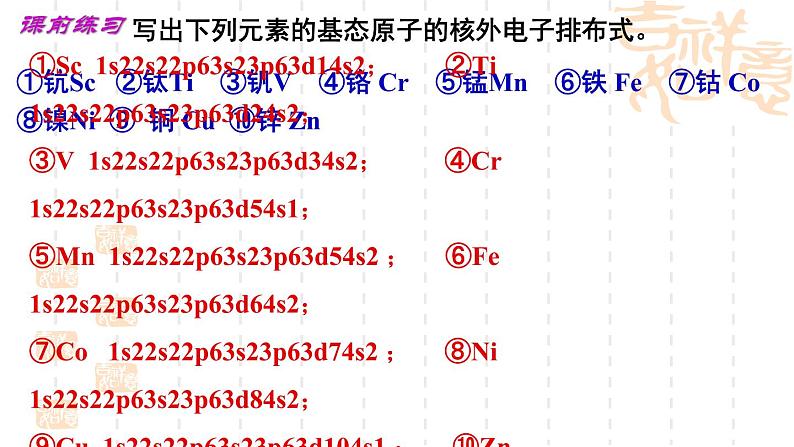
展开写出下列元素的基态原子的核外电子排布式。
①钪Sc ②钛Ti ③钒V ④铬 Cr ⑤锰Mn ⑥铁 Fe ⑦钴 C ⑧镍Ni ⑨ 铜 Cu ⑩锌 Zn
①Sc 1s22s22p63s23p63d14s2; ②Ti 1s22s22p63s23p63d24s2;③V 1s22s22p63s23p63d34s2; ④Cr 1s22s22p63s23p63d54s1;⑤Mn 1s22s22p63s23p63d54s2 ; ⑥Fe 1s22s22p63s23p63d64s2;⑦C 1s22s22p63s23p63d74s2 ; ⑧Ni 1s22s22p63s23p63d84s2;⑨Cu 1s22s22p63s23p63d104s1 ; ⑩Zn 1s22s22p63s23p63d104s2。
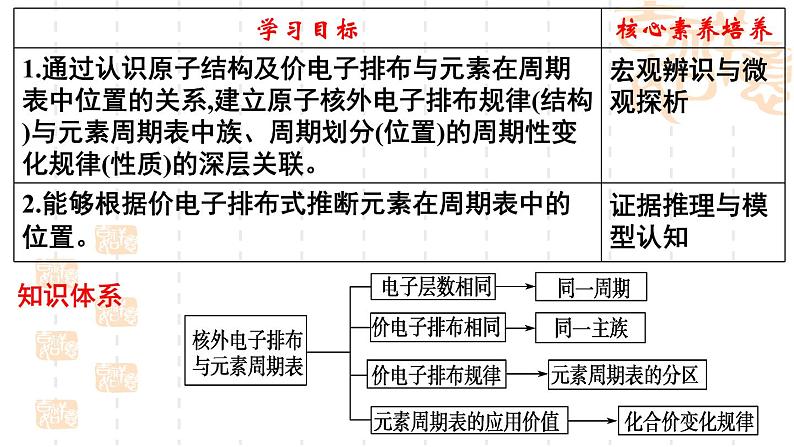
原子核外的电子排布、原子轨道的能级与周期表之间有什么样的关系?
阅读课本第15-16页,了解鲍林近似能级图,能级组与元素周期表的周期之间的对应关系,同一能级组和不同能级组间的能量关系。 价电子的概念,主族元素和过渡元素的原子的价电子的组成,价电子的表示方法。 原子核外的电子排布与周期表的周期划分的本质联系,周期与量子数n的关系。
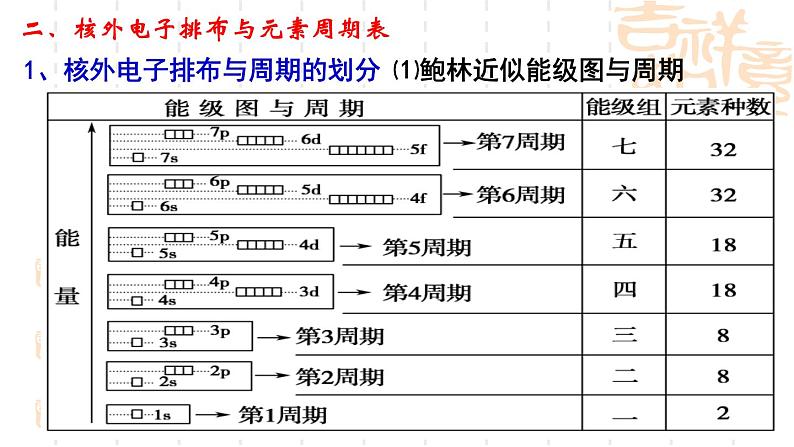
1、核外电子排布与周期的划分
⑴鲍林近似能级图与周期
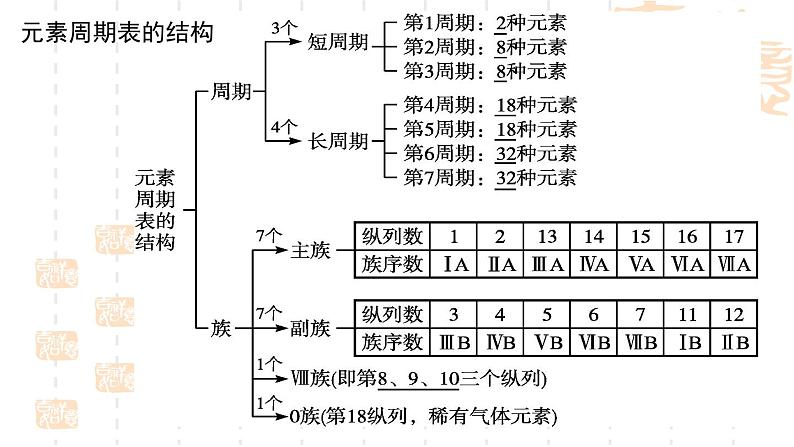
二、核外电子排布与元素周期表
⑶周期数与电子层数的关系
⑵原子核外电子排布与元素周期表中周期划分的本质联系
周期数=最外层电子所在轨道所处的 。
阅读课本第16页,了解核外电子排布与周期表中族的内在联系;每个族中价电子排布的特点,元素周期表的分组。
⑵特点 一般来说,同族元素原子的价电子数目相同。
2、核外电子排布与族的划分
⑴划分依据: 族的划分与原子的价电子数目和价电子排布密切相关。
(3)稀有气体→最外层电子排布:ns2np6(He除外)。
①主族元素: 主族元素族序数=价电子数,价电子电子排布:ns1~2或ns2np1~5。
②过渡元素: ⅠB~ⅡB族序数=ns电子数,ⅢB~ⅦB族序数=价电子数;价电子排布:(n-1)d1~10ns1~2。
⑷核外电子排布与元素周期表的分区按核外电子排布式中最后填入电子的能级符号可将元素周期表(ⅠB族、ⅡB族除外)分为s、p、d、f 4个区,而ⅠB族、ⅡB族这2个纵列的元素原子的核外电子因先填充满(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如图所示。
阅读课本第17~18页,了解元素化合价与原子核外电子排布尤其是价电子排布的密切关系;主族元素的最高化合价与价电子排布的关系;稀有气体元素的化合价和电子层结构的关系。 阅读《拓展视野》核外电子排布与元素周期表的分区,
②非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8。
⑸元素化合价与价电子排布的关系
①除Ⅷ族、ⅠB族的某些元素和0族元素外,(主族)元素的最高化合价等于所在的族序数。
③稀有气体元素原子的电子层结构是稳定结构,因此稀有气体元素的化合价在通常情况下为0。
1.指出下列元素在周期表中的位置:(1)基态原子的电子排布式为1s22s22p63s23p64s1的元素: 第___周期、____族。(2)基态原子的电子排布式为1s22s22p63s23p63d34s2的元素: 第____周期、____族。(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素: 第_____周期、_____族。(4)基态原子的电子排布式为1s22s22p63s23p5的元素: 第_____周期、_____族。
2.下列说法不正确的是( ) A.某基态原子外围电子排布式为4f75d16s2,该元素位于周期表中第6周期ⅢB族 B.在元素周期表中,s区、d区和ds区的元素都是金属元素 C.当碳原子的核外电子排布由 转变为 时,释放能量,由激发态转化成基态。 D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
3.已知某元素+3价离子的核外电子排布式为1s22s22p63s23p63d5,则该元素在元素周期表中的位置是( ) A.第3周期Ⅷ族,p区 B.第3周期ⅤB族,ds区 C.第4周期Ⅷ族,d区 D.第4周期ⅤB族,f区
4.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( ) A.基态原子的N层上只有一个电子的元素一定是ⅠA族元素 B.基态原子的价电子排布式为(n-1)d10ns2的元素一定是副族元素 C.基态原子的p能级半充满的元素一定位于p区 D.基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
5.(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第________周期________族;最高价氧化物的化学式为__________,砷酸钠的化学式是________。(2)已知下列元素在周期表中的位置,写出它们价电子排布式和元素符号:①第4周期ⅣB族________________、_____________________;②第5周期ⅦA族________________、_____________________。
6.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区C.f区、p区、ds区 D.s区、f区、ds区
7.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( ) A.两种元素原子的电子层上全部都是s电子 B.3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 C.最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 D.原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子
8.甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:(1)甲的元素符号是________;其轨道表示式为________________。(2)乙元素原子的最外层电子排布式为________,其在元素周期表中的位置是________。(3)甲属于________区元素,乙属于________区元素。
化学选择性必修2第3章 不同聚集状态的物质与性质本章综合与测试复习课件ppt: 这是一份化学选择性必修2第3章 不同聚集状态的物质与性质本章综合与测试复习课件ppt,共24页。PPT课件主要包含了各类晶胞的体积计算,空间利用率52%,空间利用率68%,空间利用率74%,同素异形体,sp2,sp3,混合型,④晶体中微粒的关系,MgNi3C等内容,欢迎下载使用。
2020-2021学年第3节 元素性质及其变化规律教学演示ppt课件: 这是一份2020-2021学年第3节 元素性质及其变化规律教学演示ppt课件,共24页。PPT课件主要包含了复习回顾,电离能的应用,LiNaK,s22s22p2,知识体系,阅读学习,电负性,电负性的变化规律,电负性的应用,②③⑤⑥等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第1节 共价键模型图文ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第1节 共价键模型图文ppt课件,共18页。PPT课件主要包含了知识体系,复习回顾,共价键,共价键的类型,σ键和π键,交流研讨,非极性键和极性键,总结共价键的分类,双键三键,非极性键等内容,欢迎下载使用。













