






初中化学人教版九年级下册课题 2 金属的化学性质教案配套课件ppt
展开
这是一份初中化学人教版九年级下册课题 2 金属的化学性质教案配套课件ppt,共17页。PPT课件主要包含了金属的化学性质,我会思考,结论1,我会探究,金属与酸反应,结论2,活动性Cu﹥Ag,活动性Al﹥Cu,活动性CuAl,我会总结等内容,欢迎下载使用。
金属和金属材料课题2 金属的化学性质
镁、铝等在常温下就能与氧气反应。
金即使在高温时也不与氧气反应。
铁、铜等在常温下几乎不与氧气反应,
但在高温时能与氧气反应。
4 +3O2 = 2Al2O3
2 +O2=2MgO
2Cu+O2 = 2CuO
1.大多数金属能与氧气反应
反应的剧烈程度不相同
铝的化学性质很活泼,在常温下就能和氧气反应,那为什么铝制品却很耐腐蚀?结合课本或网络谈谈你的看法。
的活动性较强, 次之, _______的活动性最弱.
得出判断金属活动性(活泼程度)的方法一:
依据金属与氧气反应的难易程度和剧烈程度。
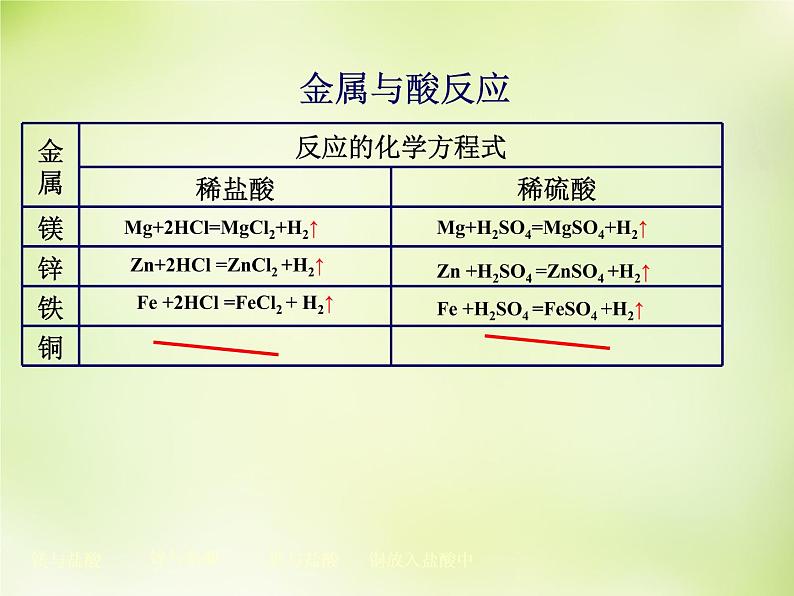
二 . 金属与稀盐酸、稀硫酸的反应
探究方法:A组:分别向装有等体积的相同形状的镁片、锌片、铁片、铜片的试管中加入等体积同种盐酸。 B组:分别向装有等体积的相同形状的镁片、锌片、铁片、铜片的试管中加入等体积同种稀硫酸。 观察发生的现象 , 比较反应的剧烈程度。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl =ZnCl2 +H2↑
Fe +2HCl =FeCl2 + H2↑
Mg+H2SO4=MgSO4+H2↑
Zn +H2SO4 =ZnSO4 +H2↑
Fe +H2SO4 =FeSO4 +H2↑
得出判断金属活动性的方法二:
根据金属是否与酸反应或反应的剧烈程度判断金属的活动性强弱
铁 镁 铜 锌四种金属的活动性由强到弱的顺序是.
Mg>Zn>Fe>Cu
铁与硫酸铜溶液的反应:Fe + CuSO4 == FeSO4 + Cu
铜丝表面生成银白色物质,溶液由无色逐渐变为蓝色。
铝丝表面生成红色物质,溶液由蓝色逐渐变为无色。
根据刚才的实验填写表格
铝与硫酸铜溶液的反应
铝、铜、银三种金属活动性由强到弱的顺序是 .
Al > Cu >Ag
得到判断金属活动性的方法三:
根据金属能不能把另一种金属从金属化合物的溶液中反应出来,判断金属活动性的强弱。
1.大多数金属能与氧气反应,生成氧化物。
2.大多数金属能与稀HCl或稀H2SO4反应
3.部分金属能与金属化合物的溶液反应
反应越容易,越剧烈,金属越活泼
金属能否与金属化合物的溶液反应
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。2、在金属活动性顺序里,位于氢前面的金属能置换出稀盐酸.稀硫酸中的氢。3、在金属活动顺序里,位于前面的金属 能把位于后面的金属从它们化合物的溶液中置换出来。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
小结: 这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
Fe + H2SO4 = FeSO4 + H2↑ Fe + 2HCl = FeCl2 + H2 ↑ Zn + H2SO4 = ZnSO4 + H2 ↑ Mg + 2HCl = MgCl2 + H2 ↑
讨论:对于下面的反应,从反应物和生成物物质分类的角度分析,这些反应有何共同特点?
相关课件
这是一份人教版九年级下册课题 2 金属的化学性质评课ppt课件,共17页。PPT课件主要包含了金属和氧气发生的反应,习题讲习,活动与探究一,置换反应等内容,欢迎下载使用。
这是一份人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质图文ppt课件,共31页。PPT课件主要包含了我会探究,前提测评,金属与氧气的反应,在常温能与氧气反应,高温也不与氧气反应,结论1,比一比,你知道吗,我会观察,气体燃烧等内容,欢迎下载使用。
这是一份2020-2021学年第八单元 金属和金属材料课题 2 金属的化学性质背景图ppt课件,共38页。PPT课件主要包含了动脑回顾,活动与探究,倒入稀硫酸,其顺序可表示为,CuAg,置换反应,金属活动性顺序,由强逐渐减弱,金属活动性顺序的探究等内容,欢迎下载使用。










