
高中化学人教版 (新课标)选修3 物质结构与性质第一节 晶体的常识教案
展开细读教材记主干
1.水晶属于晶体,有固定的熔点,而玻璃无固定的熔点,属于非晶体。
2.什么叫结晶?
提示:在一定条件下,固体物质从它的饱和溶液中以晶体的形式析出的过程。
3.晶体一定是固体,固体一定是晶体吗?
提示:晶体一定是固体,但固体不一定是晶体,如玻璃、橡胶等不属于晶体。
4.晶体与非晶体在外形上有何差别?
提示:晶体具有规则的几何外形,而非晶体不具有规则的几何外形。
[新知探究]
1.概念
(1)晶体:内部粒子(原子、离子或分子)在三维空间里按一定规律呈周期性有序排列。如NaCl晶体、I2晶体等。
(2)非晶体:内部粒子(原子、离子或分子)在三维空间里的排列呈现相对无序的分布状态。如橡胶、玻璃等。
2.获得晶体的途径
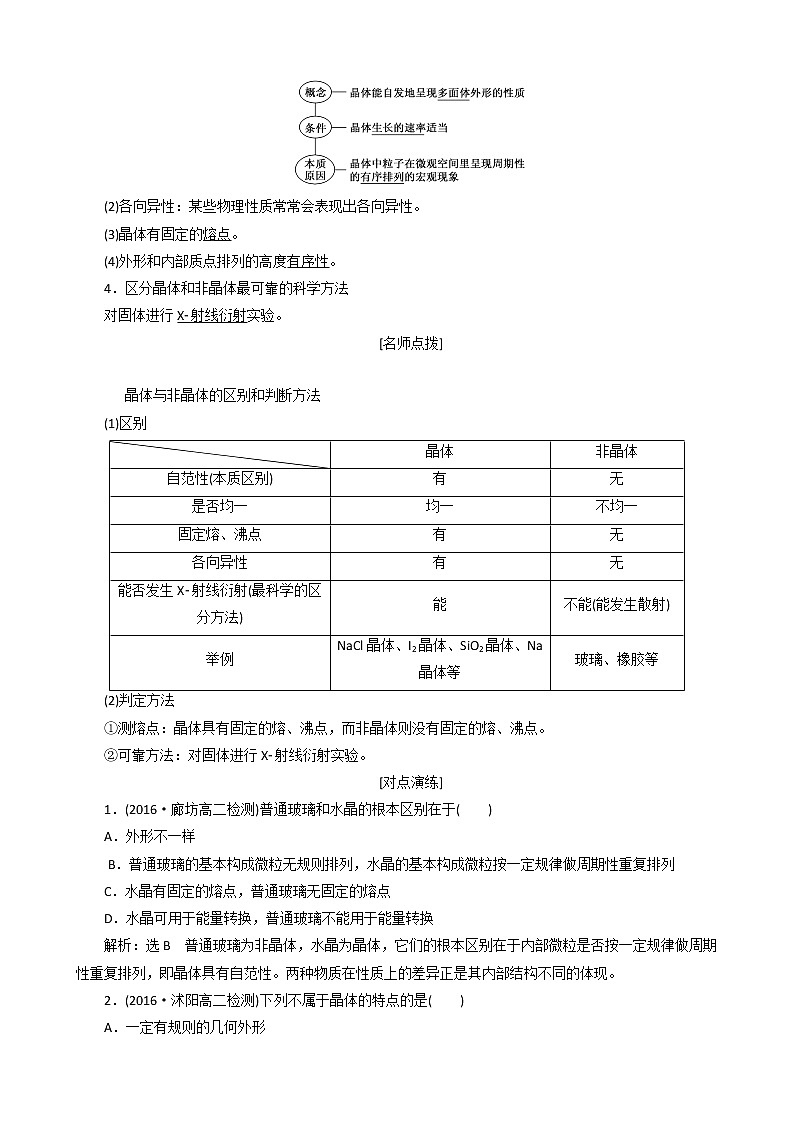
3.晶体的特点
(1)自范性
(2)各向异性:某些物理性质常常会表现出各向异性。
(3)晶体有固定的熔点。
(4)外形和内部质点排列的高度有序性。
4.区分晶体和非晶体最可靠的科学方法
对固体进行X射线衍射实验。
[名师点拨]
晶体与非晶体的区别和判断方法
(1)区别
| 晶体 | 非晶体 |
自范性(本质区别) | 有 | 无 |
是否均一 | 均一 | 不均一 |
固定熔、沸点 | 有 | 无 |
各向异性 | 有 | 无 |
能否发生X射线衍射(最科学的区分方法) | 能 | 不能(能发生散射) |
举例 | NaCl晶体、I2晶体、SiO2晶体、Na晶体等 | 玻璃、橡胶等 |
(2)判定方法
①测熔点:晶体具有固定的熔、沸点,而非晶体则没有固定的熔、沸点。
②可靠方法:对固体进行X射线衍射实验。
[对点演练]
1.(2016·廊坊高二检测)普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
解析:选B 普通玻璃为非晶体,水晶为晶体,它们的根本区别在于内部微粒是否按一定规律做周期性重复排列,即晶体具有自范性。两种物质在性质上的差异正是其内部结构不同的体现。
2.(2016·沭阳高二检测)下列不属于晶体的特点的是( )
A.一定有规则的几何外形
B.一定有各向异性
C.一定有固定的熔点
D.一定是无色透明的固体
解析:选D 晶体的特点是有规则的几何外形(由晶体的自范性决定)、固定的熔点及各向异性,但不一定是无色透明的固体,如紫色的碘晶体和蓝色的硫酸铜晶体等。
3.(2016·唐山高二检测)下列途径不能得到晶体的是( )
A.熔融态SiO2快速冷却
B.熔融态SiO2热液缓慢冷却
C.FeCl3蒸气冷凝
D.CuSO4溶液蒸发浓缩后冷却
解析:选A 晶体呈现自范性是需要一定条件的,即晶体生长的速率要适当。熔融态物质快速冷却时不能得到晶体,如熔融态SiO2快速冷却得到非晶体玛瑙,热液缓慢冷却则形成水晶。FeCl3、AlCl3等固体均易升华,其蒸气凝华则得到晶体。D项析出胆矾晶体(CuSO4·5H2O)。
[新知探究]
1.概念
晶胞是描述晶体结构的基本单元。
2.结构
习惯采用的晶胞都是平行六面体,晶体是由无数晶胞“无隙并置”而成。
(1)“无隙”:相邻晶胞之间没有任何间隙。
(2)“并置”:所有晶胞都是平行排列的,取向相同。
(3)所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
3.晶胞中原子个数的计算——均摊法
[名师点拨]
晶胞中粒子数的计算
(1)平行六面体晶胞中不同位置的粒子数的计算(均摊法)
(2)非平行六面体晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有 粒子属于该六边形。
[对点演练]
4.(2016·邢台高二检测)某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
解析:选B A位于正三棱柱的顶角,则有 的A属于该晶胞,该晶胞中含A的个数为6×=,B分为两类,位于侧棱上的B有 属于该晶胞,位于上下底面边上的B有 属于该晶胞,该晶胞含B原子个数为3×+6×=2,含C原子个数为1,则A、B、C三种原子个数之比为∶2∶1=1∶4∶2,故选B。
5.如图所示的甲、乙、丙三种晶体:
试写出:
(1)甲晶体的化学式(X为阳离子)________。
(2)乙晶体中A、B、C三种粒子的个数比________。
(3)丙晶体中每个D周围结合E的个数________。
解析:晶胞任意位置上的一个粒子如果被n个晶胞所共有,那么每个晶胞对这个粒子分得的份额就是。顶点粒子在立方体中实占,立方体面上粒子实占,立方体棱边上粒子实占,立方体内部粒子完全归晶胞所有。甲中X位于立方体体心,为1,Y位于立方体顶点,实际占有:×4= ;X∶Y=1∶=2∶1,所以甲的化学式为X2Y。乙中A占有 ×8=1,B占有 ×6=3,C占有1个,由此推出N(A)∶N(B)∶N(C)=1∶3∶1。丙中D周围E的个数与E周围D的个数相同,E周围有8个D,所以D周围有8个E。
答案:(1)X2Y (2)1∶3∶1 (3)8
1.(2016·福州高二检测)下列有关晶体和非晶体的说法中正确的是( )
A.具有规则几何外形的固体均为晶体
B.晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射
C.晶体研碎后即变为非晶体
D.将玻璃加工成规则的固体即变成晶体
解析:选B 晶体有整齐规则的几何外形,但是具有规则外形的不一定是晶体,例如玻璃,故A错误;晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射,故B正确;晶体研碎后并没有改变晶体的结构排列,故C错误;玻璃的内部结构无法规则的出现晶胞排列,故D错误。
2.下列关于晶体的性质叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
解析:选B 晶体的各向异性取决于微观粒子的排列具有特定的方向性,而对称性是微观粒子按一定规律做周期性重复排列的必然结果,二者并不矛盾,B项错误。
3.(2016·杭州高二检测)要得到较大颗粒的明矾晶体,在结晶时可如下操作( )
A.配制比室温高10~20 ℃明矾饱和溶液然后浸入悬挂的明矾小晶核,静置过夜
B.在沸水中配制明矾饱和溶液,然后急速冷却结晶
C.室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜
D.进行快速蒸发明矾饱和溶液至大量晶体析出
解析:选A 配制比室温温度高的明矾饱和溶液,当温度降低时,溶液的溶解度也降低,析出的明矾会附着在小晶核上,得到较大颗粒的明矾晶体,而沸水时配制饱和溶液或快速蒸发明矾饱和溶液至大量晶体析出,析出的只是明矾晶体,室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜,不会有晶体析出。
4.(2016·揭阳高二检测)如图所示是金属钠的晶胞示意图,该晶胞平均含有的钠原子数是( )
A.9 B.5
C.3 D.2
解析:选D 金属钠的晶胞中,有8个原子处于顶角上,有1个原子位于体心,故该晶胞平均含有的钠原子数为×8+1=2。
5.(2016·阆中高二检测)某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为( )
A.1∶3∶1 B.2∶3∶1
C.1∶2∶1 D.1∶3∶3
解析:选C 根据图片知,该小正方体中A原子个数=8×=1,B原子个数=4×=2,C原子个数=1,所以晶体中A、B、C的原子个数比为1∶2∶1,故选C。
6.(2016·衡水高二检测)(1)某晶体的其中一个晶胞的形状如图所示,8个顶点被X原子(○)占据,每面中心被Y原子(△)占据,立方体中心被Z原子(*)占据。则晶体中原子个数比为X∶Y∶Z=_________________________________。
(2)如图所示为甲、乙、丙三种晶体:
试推断甲晶体的化学式(X为阳离子)为________,乙晶体中A、B、C三种粒子的个数比是________,丙晶体中每个D周围结合E的个数是________个。
解析:(1)每个晶胞中有8个X原子,但每个X原子被8个晶胞共有,则每个晶胞中绝对占有的X的个数为×8=1;每个面上的Y原子被2个晶胞共有,则每个晶胞中绝对占有的Y的个数为×6=3,位于体心位置的Z原子完全被该晶胞所占有,故Z的个数为1。因此晶体中原子个数比为X∶Y∶Z=1∶3∶1。(2)利用均摊法找出晶胞中每个位置的粒子的利用率。甲中X位于立方体体心,有1个,Y位于立方体顶角,实际有×4=个,X∶Y=1∶=2∶1,故甲的化学式为X2Y;乙中A有×8=1个,B有×6=3个,C在体心,有1个,故A∶B∶C=1∶3∶1;丙中D被8个同样的晶胞共用,故结合E的个数是8个。
答案:(1)1∶3∶1 (2)X2Y 1∶3∶1 8
人教版 (新课标)选修5 有机化学基础第三章 烃的含氧衍生物第一节 醇 酚教案: 这是一份人教版 (新课标)选修5 有机化学基础第三章 烃的含氧衍生物第一节 醇 酚教案,共9页。教案主要包含了教学重点,教学难点,教学过程,实验注意事项,问题交流项目,教学重、难点,教学方法,问题交流等内容,欢迎下载使用。
化学第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法教学设计: 这是一份化学第五章 进入合成高分子化合物的时代第一节 合成高分子化合物的基本方法教学设计,共4页。教案主要包含了苯酚等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第一节 合成高分子化合物的基本方法教学设计: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第一节 合成高分子化合物的基本方法教学设计,共6页。教案主要包含了乙醇的化学性质,醇的化学性质规律等内容,欢迎下载使用。