






高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教学演示ppt课件
展开1.变化观念与平衡思想:从变化的角度认识化学平衡的移动,即可 逆反应达到平衡后,温度、催化剂改变,平衡将会发生移动而建 立新的平衡。2.证据推理与模型认知:通过实验论证说明温度、催化剂的改变对 化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模 型(勒夏特列原理)。
一、温度、催化剂对化学平衡移动的影响
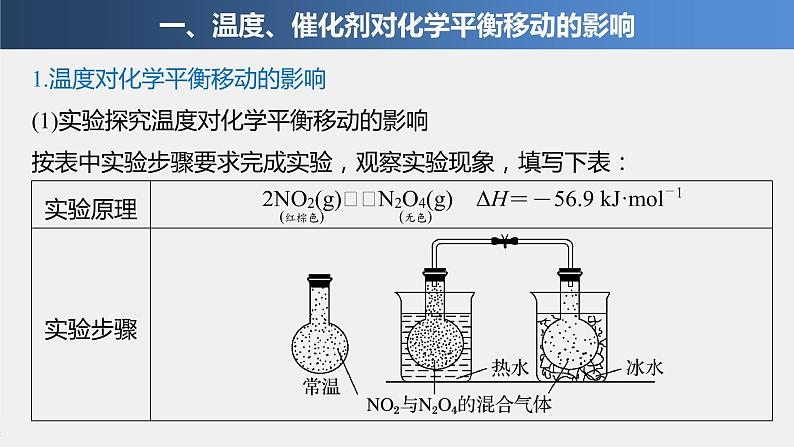
1.温度对化学平衡移动的影响(1)实验探究温度对化学平衡移动的影响按表中实验步骤要求完成实验,观察实验现象,填写下表:
(2)温度对化学平衡移动的影响规律①任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。②当其他条件不变时:温度升高,平衡向 方向移动;温度降低,平衡向 方向移动。
(3)用v—t图像分析温度对化学平衡移动的影响已知反应:mA(g)+nB(g) C(g) ΔH<0,当反应达平衡后,若温度改变,其反应速率的变化曲线分别如下图所示。
t1时刻,升高温度,v′正、v′逆均增大,但吸热反应方向的v′逆增大幅度大,则v′逆>v′正,平衡逆向移动。
t1时刻,降低温度,v′正、v′逆均减小,但吸热反应方向的v′逆减小幅度大。则v′正>v′逆,平衡正向移动。
2.催化剂对化学平衡的影响(1)催化剂对化学平衡的影响规律当其他条件不变时:催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。(2)用v—t图像分析催化剂对化学平衡的影响
t1时刻,加入催化剂,v′正、v′逆同等倍数增大,则v′正=v′逆,平衡不移动。
提醒 ①一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。②用速率分析化学平衡移动的一般思路
(1)温度可以影响任意可逆反应的化学平衡状态( )(2)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )(3)升高温度,反应速率加快,化学平衡正向移动( )(4)升高温度,反应速率加快,但反应物的转化率可能降低( )(5)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( )(6)升高温度,化学平衡常数增大( )(7)平衡移动,平衡常数不一定改变,但平衡常数改变,平衡一定发生移动( )
1.反应:A(g)+3B(g) 2C(g) ΔH<0,达平衡后,将反应体系的温度降低,下列叙述中正确的是A.正反应速率增大,逆反应速率减小,平衡向右移动B.正反应速率减小,逆反应速率增大,平衡向左移动C.正反应速率和逆反应速率都减小,平衡向右移动D.正反应速率和逆反应速率都减小,平衡向左移动
解析 降低温度,v正、v逆均减小,平衡向放热反应方向移动,即平衡正向移动。
2.改变温度可以使化学平衡发生移动,化学平衡常数也会发生改变,通过分析以下两个反应,总结出温度对化学平衡常数的影响规律。(1)N2(g)+3H2(g) 2NH3(g)化学平衡常数K1=___________,升温化学平衡逆向移动,K1_____(填“增大”或“减小”,下同),ΔH___0(填“>”或“<”,下同)。(2)CO2(g)+H2(g) CO(g)+H2O(g)化学平衡常数K2=_____________,升温化学平衡正向移动,K2_____,ΔH___0。
3.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
解析 根据题干中的表格可知,随着温度的升高,平衡常数逐渐增大,说明正反应为吸热反应。
回答下列问题:(1)该反应为_____(填“吸热”或“放热”)反应。
(2)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(3)在1 200 ℃时,某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为 2 ml·L-1、2 ml·L-1、4 ml·L-1、4 ml·L-1,则此时上述反应的平衡____________(填“向正反应方向”“向逆反应方向”或“不”)移动。
化学平衡常数的应用(1)判断反应进行的程度K值越大,该反应进行得越完全,反应物的转化率越大;反之,就越不完全,转化率越小。(2)判断反应的热效应①升高温度:K值增大→正反应为吸热反应;K值减小→正反应为放热反应。②降低温度:K值增大→正反应为放热反应;K值减小→正反应为吸热反应。
(3)判断反应是否达到平衡或反应进行的方向当Q=K时,反应处于平衡状态;当Q<K时,反应向正反应方向进行;当Q>K时,反应向逆反应方向进行。
1.定义如果改变影响平衡的条件之一(如温度、浓度、压强等),平衡将向着能够 这种改变的方向移动。简单记忆:改变―→减弱这种改变。
2.适用范围(1)勒夏特列原理仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可逆过程均不能使用该原理。此外,勒夏特列原理对所有的动态平衡(如溶解平衡、电离平衡和水解平衡等)都适用。(2)勒夏特列原理只适用于判断“改变影响平衡的一个条件”时平衡移动的方向。若同时改变影响平衡移动的几个条件,则不能简单地根据勒夏特列原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致时,才能根据勒夏特列原理进行判断。
(1)对于可逆反应,升高温度,若v正增大,则v逆减小,平衡正向移动( )(2)勒夏特列原理适用于所有的动态平衡( )(3)其他条件不变,若增大某反应物的浓度,则平衡向减少该物质浓度的方向移动,最终该物质的浓度减小( )(4)光照时,氯水颜色变浅,可用勒夏特列原理解释( )
1.已知:CO(g)+NO2(g) CO2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅,下列关于该反应的说法正确的是_______(填字母)。A.该反应为放热反应B.降温后CO的浓度增大C.降温后NO2的转化率增大D.降温后NO的体积分数增大E.增大压强混合气体的颜色不变F.恒容时,通入He气体,混合气体颜色不变G.恒压时,通入He气体,混合气体颜色不变
2.在一密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2)=1 ml·L-1,容器内压强为p,温度为T。(1)再向容器中通入N2,使其浓度变为2 ml·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是________________________。(2)缩小体积至平衡时的一半,并保持温度不变,再次达到平衡时压强p′的范围是__________。(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是__________。
1 ml·L-1
3.下列事实中,不能用勒夏特列原理解释的是____(填字母)。A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后 颜色变浅B.对2H2O2 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率C.反应:CO+NO2 CO2+NO ΔH<0,升高温度,平衡向逆反应方向 移动D.合成氨反应:N2+3H2 2NH3 ΔH<0,为使氨的产率提高,理论上 应采取低温高压的措施E.H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
解析 催化剂只能改变反应速率,对化学平衡的移动无影响。
勒夏特列原理只能解决与平衡移动有关的问题。不涉及平衡移动的问题都不能用勒夏特列原理解释,常见的有:(1)使用催化剂不能使化学平衡发生移动;(2)反应前后气体体积不变的可逆反应,改变压强可以改变化学反应速率,但不能使化学平衡发生移动;(3)发生的化学反应本身不是可逆反应;(4)外界条件的改变对平衡移动的影响与生产要求不完全一致的反应。
1.对于反应:2A(g)+B(g) 2C(g) ΔH<0,当温度升高时,平衡向逆反应方向移动,其原因是A.正反应速率增大,逆反应速率减小B.逆反应速率增大,正反应速率减小C.正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率 增大的程度D.正、逆反应速率均增大,而且增大的程度一样
解析 升高温度,正、逆反应速率均增大,但是两者增大的程度不一样,所以升高温度后,正、逆反应速率不再相等,化学平衡发生移动。当逆反应速率增大的程度大于正反应速率增大的程度时,平衡向逆反应方向移动。
2.下列事实不能用勒夏特列原理解释的是A.光照新制的氯水时,溶液的pH逐渐减小B.加催化剂,使N2和H2在一定条件下转化为NH3C.可用浓氨水和氢氧化钠固体快速制氨D.增大压强,有利于SO2与O2反应生成SO3
3.(2020·济南高二质检)只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是A.K值不变,平衡可能移动B.K值变化,平衡一定移动C.平衡移动,K值可能不变D.平衡移动,K值一定变化
解析 平衡常数只与温度有关,温度不变,平衡也可能发生移动,则K值不变,平衡可能移动,A正确;K值变化,说明反应的温度一定发生了变化,因此平衡一定移动,B正确;平衡移动,温度可能不变,因此K值可能不变,C正确;平衡移动,温度可能不变,因此K值不一定变化,D错误。
4.在高温、催化剂条件下,某反应达到平衡,平衡常数K= 。恒容时,升高温度,H2浓度减小。下列说法正确的是A.该反应的焓变为正值B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g)
5.在密闭容器中进行如下反应:CO2(g)+C(s) 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。(1)增加C(s),则平衡______(填“逆向移动”“正向移动”或“不移动”,下同),c(CO2)_____(填“增大”“减小”或“不变”,下同)。
(2)保持温度不变,增大反应容器的容积,则平衡________,c(CO2)_____。
解析 C为固体,增加C的量,其浓度不变,平衡不移动,c(CO2)不变。
解析 增大反应容器的容积,即减小压强,平衡向气体体积增大的方向移动,c(CO2)减小。
(3)保持反应容器的容积和温度不变,通入He,则平衡_______,c(CO2)_____。
(4)保持反应容器的容积不变,升高温度,则平衡________,c(CO)____。
解析 通入He,但容积和温度不变,平衡不会发生移动,c(CO2)不变。
解析 容积不变,升高温度,平衡向吸热方向移动,c(CO)增大。
题组一 温度、催化剂对化学平衡的影响1.已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是A.上述过程中,A烧瓶内正、逆反应速率均加快B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大C.上述过程中,A、B烧瓶内气体密度均保持不变D.反应2NO2(g) N2O4(g)的逆反应为放热反应
容器的容积不变,混合气体的质量不变,A、B烧瓶内气体密度都不变,C项正确;放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2的方向移动,降低温度平衡向生成N2O4的方向移动,故反应2NO2(g) N2O4(g)的正反应为放热反应,D项错误。
解析 升高温度,正、逆反应速率都增大,A项正确;B烧瓶内气体颜色变浅,说明平衡向生成N2O4的方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,B项正确;
2.在一密闭容器中,发生可逆反应:3A(g) 3B+C(正反应为吸热反应),平衡时,升高温度,气体的平均相对分子质量有变小的趋势,则下列判断中正确的是A.B和C可能都是固体B.B和C一定都是气体C.若C为固体,则B一定是气体D.B和C不可能都是气体
解析 正反应吸热,升温,平衡右移。若B、C都为固体,则气体的相对分子质量不变,故A错误;若C为固体,B为气体,平衡右移,气体的总质量减小,总物质的量不变,气体的平均相对分子质量减小,故B错误、C正确;若B、C都是气体,平衡右移,气体的总质量不变,总物质的量增加,则平均相对分子质量减小,故D错误。
3.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是A.a>b B.a=bC.a
题组二 多因素对化学平衡影响的分析4.在一定条件下,可逆反应达到化学平衡:I2(g)+H2(g) 2HI(g)(正反应是放热反应)。要使混合气体的颜色加深,可以采取的方法是A.降低温度 B.增大H2的浓度C.减小容器体积 D.增大容器体积
解析 降低温度,平衡正向移动,混合气体颜色变浅,A项错误;增大H2的浓度,平衡正向移动,c(I2)减小,混合气体颜色变浅,B项错误;减小容器体积相当于增大压强,平衡不移动,但c(I2)增大,气体颜色加深,C项正确;增大容器体积,c(I2)减小,气体颜色变浅,D项错误。
5.COCl2(g) CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列能提高COCl2转化率的措施是①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
解析 该反应为气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
6.在水溶液中存在反应:Ag+(aq)+Fe2+(aq) Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是A.升高温度 B.加水稀释C.增大Fe2+的浓度 D.常温下加压
解析 正反应放热,升高温度,平衡向逆反应方向移动,A错误;加水稀释,平衡向离子数目增多的方向移动,即平衡向逆反应方向移动,B错误;增大Fe2+的浓度,平衡向正反应方向移动,C正确;常温下加压对水溶液中的平衡移动几乎无影响,D错误。
7.一定温度下,在密闭容器中发生反应:N2O4(g) 2NO2(g) ΔH>0,反应达到平衡时,下列说法不正确的是A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平 衡颜色深B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物 质的百分含量不变C.若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向 正反应方向移动,再次平衡时N2O4的转化率将升高D.若体积不变,升高温度,再次平衡时体系颜色加深
解析 缩小容器体积,NO2的浓度变大,颜色加深,平衡向左移动使混合气体颜色又变浅,但依据“减弱不消除”可知,新平衡时NO2的浓度仍比原平衡大,即气体颜色比原平衡深;若压强不变,再充入N2O4气体,容器体积变大,达到新平衡与原平衡等效,因此新平衡时各物质的百分含量不变;若体积不变,向容器中再加入一定量的N2O4,则相对于原平衡,平衡向逆反应方向移动,再次平衡时N2O4的转化率将降低;若体积不变,升温,平衡正向移动,再次平衡时体系中NO2的浓度增大,气体颜色加深。
8.(2020·郑州高二检测)N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
下列说法中不正确的是A.500 s内,N2O5的分解速率 为2.96×10-3 ml·L-1·s-1B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1
B项,分析如下:2N2O5(g) 4NO2(g)+O2(g)起始浓度/ml·L-1 5.00 0 0转化浓度/ml·L-1 2.50 5.00 1.25平衡浓度/ml·L-1 2.50 5.00 1.25
C项,该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2;D项,达到平衡后,其他条件不变,将容器的体积压缩到原来的 ,相当于增大压强,平衡向左移动,则c(N2O5)>5.00 ml·L-1。
题组三 化学平衡移动的相关图像9.(2019·山东潍坊期中)对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生的影响与图像不相符的是
解析 改变温度会使v正、v逆都发生“突变”且升温向吸热反应方向移动,即逆向移动, v逆>v正。
A.温度为T1时,向该平衡体系中加 入KI固体,平衡正向移动
C.若T1时,反应进行到状态d时,一定有v正>v逆D.状态a与状态b相比,状态b时I2的转化率更高
解析 加入KI固体,c(I-)增大,平衡正向移动,A项正确;
a、b均为平衡点,a点温度低,该反应为放热反应,降低温度,平衡正向移动,则状态a时I2的转化率更高,D项错误。
题组四 勒夏特列原理的应用11.(2019·牡丹江第一高级中学高二月考)下列事实不能用勒夏特列原理解释的是①工业合成氨,反应条件选择高温 ②实验室可以用排饱和食盐水的方法收集氯气 ③使用催化剂可加快SO2转化为SO3的速率 ④硫酸工业中,增大O2的浓度有利于提高SO2的转化率A.②③ B.②④C.①③ D.①④
解析 ①工业合成氨的反应为放热反应,升高温度,平衡左移,不利于氨气的生成,不能用勒夏特列原理解释;②氯气溶于水的反应是一个可逆反应:Cl2+H2O H++Cl-+HClO,因为饱和食盐水中含有大量的氯离子,相当于在氯气溶于水的反应中增加了大量的生成物氯离子,平衡向逆反应方向移动,氯气溶解量减小,可以用勒夏特列原理解释;③催化剂不影响平衡移动,只能加快化学反应速率,所以不能用勒夏特列原理解释;④增大反应物O2的浓度,平衡向正反应方向移动,能增大SO2的转化率,可以用勒夏特列原理解释。综上所述,C项符合题意。
12.(2019·山东潍坊期中)关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①HUr(aq)+H2O(l) Ur-(aq)+H3O+(aq) ②Ur-(aq)+Na+(aq)NaUr(s) ΔH。下列叙述错误的是A.降低温度,反应②平衡正向移动B.反应②正方向是吸热反应C.降低关节滑液中HUr及Na+含量是治疗方法之一D.关节保暖可以缓解疼痛,原理是平衡②逆向移动
13.下列事实中,不能用勒夏特列原理解释的是A.夏天,打开啤酒瓶时会从瓶口逸出气体B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合 气体的颜色变浅
解析 A项中考查溶解平衡CO2(g) CO2(aq),压强减小,则平衡向逆反应方向移动,形成大量气体逸出;
C项中颜色加深的根本原因是体积减小,c(I2)浓度增大,由于是反应前后气体体积不变的反应,不涉及平衡的移动,则不能用勒夏特列原理解释。
14.现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为_____(填“吸热”或“放热”)反应,且m+n___(填“>”“=”或“<”)p。(2)减压使容器体积增大时,A的质量分数_____(填“增大”“减小”或“不变”,下同)。(3)若容积不变加入B,则A的转化率_____,B的转化率_____。(4)若升高温度,则平衡时B、C的浓度之比 将_____。(5)若加入催化剂,平衡时气体混合物的总物质的量_____。
解析 反应mA(g)+nB(g) pC(g)达到平衡后,升高温度时,B的转化率变大,说明平衡向正反应方向移动,正反应为吸热反应;减小压强时,混合体系中C的质量分数减小,说明平衡向逆反应方向移动,即m+n>p,A的质量分数增大;若容积不变加入B,平衡向正反应方向移动,A的转化率增大;
15.在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是______________;升高温度,NO的浓度增大,则该反应是_____(填“放热”或“吸热”)反应。
0.003 5 ml·L-1
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是__(填字母)。a.及时分离出NO2气体 b.适当升高温度c.增大O2的浓度 d.选择高效催化剂
解析 分离出NO2气体,反应速率减慢,加入催化剂,平衡不移动,升高温度该反应向逆反应方向移动,所以a、b、d均错误;增大反应物O2的浓度,反应速率增大,平衡向正反应方向移动,c正确。
16.将0.4 ml N2O4气体充入2 L固定容积的密闭容器中发生如下反应:N2O4(g) 2NO2(g) ΔH。在T1和T2时,测得NO2的物质的量随时间的变化如图所示:
(1)T1时,40~80 s内用N2O4表示该反应的平均反应速率为________ml·L-1·s-1。
(2)ΔH___(填“>”“<”或“=”)0。
解析 由图可知反应在T1比T2先达到平衡状态,所以T1>T2,由于T1平衡时n(NO2)比T2平衡时的多,故升高温度,平衡向生成NO2的方向移动,即向吸热反应方向移动,所以ΔH>0。
(3)改变条件重新达到平衡时,要使 的值变小,可采取的措施有____(填字母,下同)。A.增大N2O4的起始浓度 B.升高温度C.向混合气体中通入NO2 D.使用高效催化剂
(4)在温度为T3、T4时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是____。A.A、C两点的反应速率:A>CB.A、B两点N2O4的转化率:A>BC.A、C两点气体的颜色:A深,C浅D.由A点到B点,可以用加热的方法
解析 A项,由图可知:A、C两点平衡时温度相同,C点对应压强大,反应速率大;B项,由图可知:A、B两点平衡时压强相同,温度不同,A点NO2的体积分数大于B点,而反应:N2O4(g) 2NO2(g) ΔH>0,温度升高,平衡向右移动,NO2的体积分数增大,温度T4>T3,转化率A>B;
C项,由图像可知,A、C两点平衡时温度相同,C点对应压强大,NO2的浓度大,故气体颜色C点比A点深;D项,由B项分析知,A点平衡时温度T4高于B点平衡时温度T3,故由A点到B点需要降低温度。
化学第二节 化学平衡评课课件ppt: 这是一份化学第二节 化学平衡评课课件ppt,共37页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡作业ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡作业ppt课件,共41页。PPT课件主要包含了逆反应,升高温度,使用催化剂,减小压强,t5t6,t3t4,K0K3K5,2×10-3等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动教课内容课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动教课内容课件ppt,共60页。PPT课件主要包含了课时对点练等内容,欢迎下载使用。













