









- 2.1 第2课时 影响化学反应速率的因素 活化能-【新教材】人教版(2019)高中化学选择性必修一课件+课后习题 课件 2 次下载
- 2.2 第1课时 化学平衡状态-【新教材】人教版(2019)高中化学选择性必修一课件+课后习题 课件 1 次下载
- 2.2 第3课时 浓度、压强对化学平衡的影响-【新教材】人教版(2019)高中化学选择性必修一课件+课后习题 课件 1 次下载
- 2.2 第4课时 温度、催化剂对化学平衡的影响-【新教材】人教版(2019)高中化学选择性必修一课件+课后习题 课件 0 次下载
- 2.3 化学反应的方向-【新教材】人教版(2019)高中化学选择性必修一课件+课后习题 课件 3 次下载
化学选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡精品习题课件ppt
展开第二章化学反应速率与化学平衡
第二节 化学平衡
第2课时 化学平衡常数
课后篇素养形成
夯实基础轻松达标
1.关于平衡常数K,下列说法中正确的是( )
A.K值越大,反应速率越大
B.对任一给定的可逆反应,温度升高,K值增大
C.对任一给定的可逆反应,K值越大,反应物的平衡转化率越高
D.加入催化剂或增大反应物浓度,K值将增大
解析K值与催化剂、反应物的浓度、化学反应速率的大小无关,所以A、D错误;与反应温度有关,但是温度升高,K值可能增大也可能减小,B也错误。
答案C
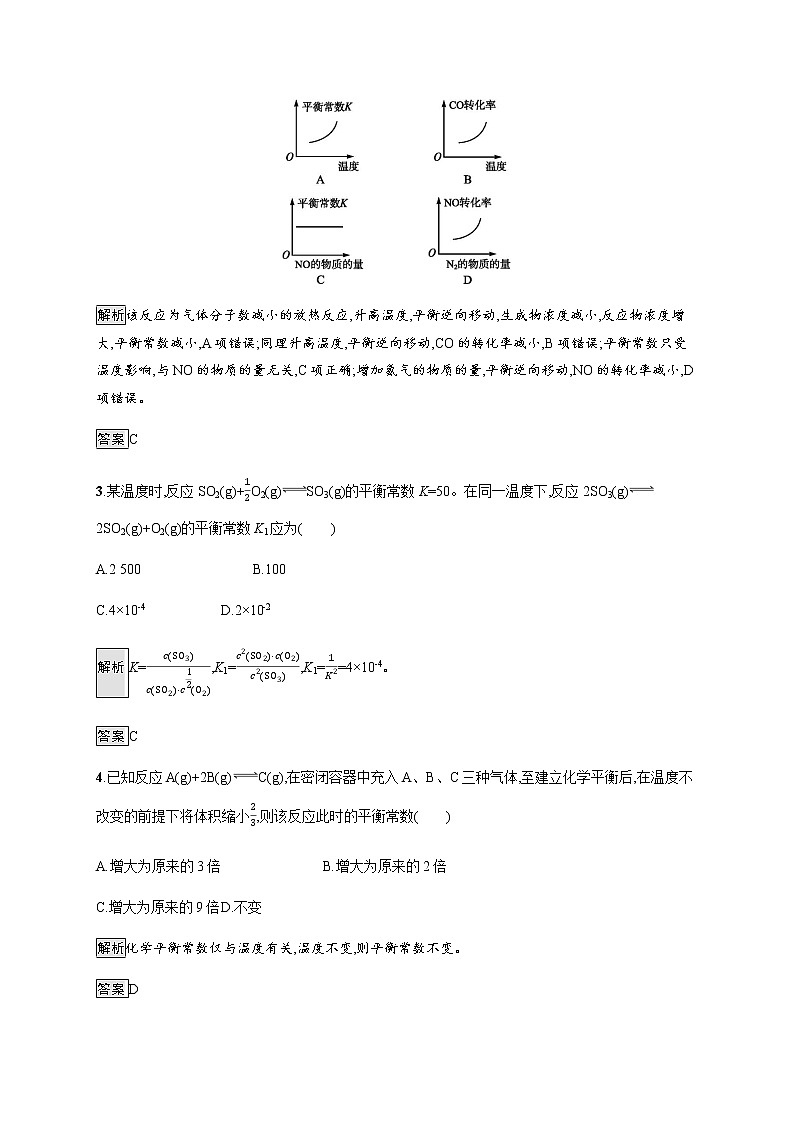
2.汽车尾气净化中的一个反应如下:
NO(g)+CO(g)N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
解析该反应为气体分子数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A项错误;同理升高温度,平衡逆向移动,CO的转化率减小,B项错误;平衡常数只受温度影响,与NO的物质的量无关,C项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D项错误。
答案C
3.某温度时,反应SO2(g)+O2(g)SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K1应为( )
A.2 500 B.100
C.4×10-4 D.2×10-2
解析K=,K1=,K1==4×10-4。
答案C
4.已知反应A(g)+2B(g)C(g),在密闭容器中充入A、B、C三种气体,至建立化学平衡后,在温度不改变的前提下将体积缩小,则该反应此时的平衡常数( )
A.增大为原来的3倍 B.增大为原来的2倍
C.增大为原来的9倍 D.不变
解析化学平衡常数仅与温度有关,温度不变,则平衡常数不变。
答案D
5.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K值分别是
①H2+F22HF K=1047
②H2+Cl22HCl K=1017
③H2+Br22HBr K=109
④H2+I22HI K=1
比较K值大小,可知各反应的正反应进行的程度由大到小的顺序是( )
A.①②③④ B.④②③①
C.①④③② D.无法确定
解析化学平衡常数越大,表示该反应的正反应进行的程度越大,故A正确。
答案A
6.已知298.15 K时,可逆反应Pb2+(aq)+Sn(s)Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则反应进行的方向是 ( )
A.向右进行 B.向左进行
C.处于平衡状态 D.无法判断
解析Q==1<K=2.2,故反应未达到平衡,反应向右进行。
答案A
7.下列反应在210 ℃达到平衡:
PCl5(g)PCl3(g)+Cl2(g) K=1 ①
CO(g)+Cl2(g)COCl2(g) K=5×104 ②
COCl2(g)CO(g)+Cl2(g) ③
(1)根据反应①的平衡常数K的表达式,下列等式必定成立的是 。
a.c(PCl5)=c(PCl3)=c(Cl2)=1
b.c(PCl5)=c(PCl3)·c(Cl2)=1
c.c(PCl5)=c(PCl3)·c(Cl2)
(2)反应②和反应③的K值的乘积是 。
(3)降低Cl2浓度,反应③的K值 (填“增大”“减小”或“不变”)。
解析(1)由K==1可知,成立的是c。
(2)反应②和反应③互为逆反应,二者K值是倒数关系,故K(②)·K(③)=1。
(3)浓度不影响平衡常数,故反应③K值不变。
答案(1)c (2)1 (3)不变
8.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是( )
A.平均相对分子质量
B.SO3(g)的转化率
C.
D.
解析将题中反应过程进行如下分析,假设在原容器上增加一个相同的容器(两容器有隔板),保持温度不变,向增加的容器中充入相同体积的SO3(g),则可建立与原平衡一样的平衡,此时A、B、C、D各项的值均不变;然后抽掉隔板,将两容器压缩为一个容器大小,则压强增大,平衡逆向移动,气体的总物质的量减小,但总质量不变,因此平均相对分子质量增大;SO3(g)的转化率减小;c(SO2)、c(SO3)均增大,但c(SO3)增大的程度比c(SO2)增大的程度大,则增大;可看作该反应的平衡常数的倒数,而平衡常数只与温度有关,故不发生变化。
答案B
提升能力跨越等级
1.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)2H2O(g) K2=2×1081
2CO2(g)2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,反应2H2O(g)2H2(g)+O2(g)的平衡常数K=5×10-82
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2
D.以上说法都不正确
解析A项,K1=。B项,K==5×10-82,正确。C项,平衡常数越大,放出O2的倾向越大,故三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2。
答案B
2.某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数为( )
A.3.2×103 B.1.6×103
C.8.0×102 D.4.0×102
解析SO3的起始浓度为0.05 mol·L-1,则分解的SO3的浓度为0.05 mol·L-1×20%=0.01 mol·L-1,所以平衡时SO2、O2、SO3的浓度分别为0.01 mol·L-1、0.005 mol·L-1、0.04 mol·L-1。化学平衡常数K==3.2×103。
答案A
3.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于( )
A.5% B.10%
C.15% D.20%
解析 N2+3H22NH3
起始量(mol) 2 8 0
转化量(mol) 2
平衡量(mol) 6
氮气的体积分数为 mol÷(+6+) mol=≈15%。
答案C
4.在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应CO(g)+H2O(g)CO2(g)+H2(g),达到平衡时测得n(H2)=0.5 mol,下列说法不正确的是 ( )
A.在该温度下,反应的平衡常数K=1
B.平衡常数与反应温度无关
C.CO的平衡转化率为50%
D.平衡时n(H2O)=0.5 mol
解析 CO(g)+H2O(g)CO2(g)+H2(g)
起始/mol 1 1 0 0
转化/mol 0.5 0.5 0.5 0.5
平衡/mol 0.5 0.5 0.5 0.5
由以上方程式及数据判断可得,A、C、D项正确。平衡常数与反应温度有关,B项错误。
答案B
5.在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,发生反应CO(g)+H2O(g)CO2(g)+H2(g),当反应达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是( )
A.平衡后CO的体积分数为40%
B.平衡后CO的转化率为25%
C.平衡后水的转化率为50%
D.平衡后混合气体的平均相对分子质量为24
解析设达到平衡时,反应消耗的CO的体积为x。
CO(g) + H2O(g)CO2(g)+H2(g)
起始: 30 mL 20 mL 0 0
变化: x x x x
平衡: 30 mL-x 20 mL-x x x
由题意知:20 mL-x=x,故x=10 mL。
故平衡后CO的体积分数为×100%=40%,CO的转化率为×100%≈33.3%,H2O的转化率为×100%=50%,平衡后混合气体的平均相对分子质量不变,仍为=24。
答案B
6.在25 ℃时,恒容密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1 600
C.改变压强可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
解析X、Y、Z三种物质的浓度变化之比为:(0.1-0.05)∶(0.2-0.05)∶(0.1-0)=1∶3∶2,故化学方程式为X(g)+3Y(g)2Z(g),K==1 600。平衡常数K与温度有关,与压强无关。
答案C
7.830 K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。用H2O表示的化学反应速率为 。
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”或“否”),此时v(正) (填“大于”“小于”或“等于”)v(逆)。
(3)若降低温度,该反应的K值将 。
解析(1) CO(g)+H2O(g)CO2(g)+H2(g)
2 3 0 0
1.2 1.2 1.2 1.2
0.8 1.8 1.2 1.2
该反应的平衡常数K==1,v(H2O)==0.3 mol·L-1·s-1。
(2)反应进行到某时刻时,c(H2)=c(CO2)=0.5 mol·L-1,c(CO)=0.5 mol·L-1,c(H2O)=1.5 mol·L-1,Q=<K,因此反应未达到平衡状态,向正反应方向进行。
(3)降低温度,平衡向正反应方向移动,K值增大。
答案(1)1 0.3 mol·L-1·s-1
(2)否 大于
(3)增大
8.某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应Fe(s)+CO2(g)FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
(1)0~8 min,v(CO)= mol·L-1·min-1。
(2)已知:反应Fe(s)+CO2(g)FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
根据表中数据,计算反应CO2(g)+H2(g)CO(g)+H2O(g)的K。
①温度为973 K时:K= 。
②温度为1 173 K时:K= 。
解析(1)v(CO)==0.062 5 mol·L-1·min-1。
(2)Fe(s)+CO2(g)FeO(s)+CO(g) K1=;
Fe(s)+H2O(g)FeO(s)+H2(g) K2=;
而CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=,故973 K时,K=≈0.62;1 173 K时,K=≈1.29。
答案(1)0.062 5 (2)①0.62 ②1.29
贴近生活拓展创新
在80 ℃时,将0.4 mol的四氧化二氮气体充入2 L已抽成真空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100 s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b (填“<”“=”或“>”)c。
(2)20 s时,N2O4的浓度为 mol·L-1,0~20 s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80 ℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明平衡时 。
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大
解析(1)根据题中信息,知
N2O4(g)2NO2(g)
开始浓度/(mol·L-1): 0.20 0
20 s时浓度/(mol·L-1): 0.14 0.12
40 s时浓度/(mol·L-1): 0.10 0.20
60 s时浓度/(mol·L-1): 0.09 0.22(此时达到平衡)
所以b>c。
(2)20 s时c(N2O4)=0.14 mol·L-1,v(N2O4)=-
=0.003 mol·L-1·s-1。
(3)平衡常数K=≈0.54。
(4)K值越大,说明正向反应进行的程度越大,反应进行越完全,反应物转化率越大,故A、B、D正确。
答案(1)N2O4(g)2NO2(g) >
(2)0.14 0.003 mol·L-1·s-1
(3) 0.54
(4)ABD
人教版 (2019)选择性必修1第二节 电解池获奖习题课件ppt: 这是一份人教版 (2019)选择性必修1第二节 电解池获奖习题课件ppt,文件包含42第2课时电解原理的应用课件新教材人教版2019高中化学选择性必修一共32张PPTpptx、42第2课时电解原理的应用课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池优质习题ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池优质习题ppt课件,文件包含41第2课时化学电源课件新教材人教版2019高中化学选择性必修一共37张PPTpptx、41第2课时化学电源课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀习题ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀习题ppt课件,文件包含32第2课时pH的计算课件新教材人教版2019高中化学选择性必修一共28张PPTpptx、32第2课时pH的计算课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。













