





- 专题9 第一单元 金属的冶炼方法 课件PPT 课件 8 次下载
- 专题9 阶段重点突破练(六) 课件PPT 课件 8 次下载
- 专题9 第二单元 第2课时 反应条件的控制 课件PPT 课件 8 次下载
- 高中化学专题检测试卷(一) 课件PPT 课件 7 次下载
- 高中化学必修第二册专题检测试卷(二) 课件PPT 课件 6 次下载
高中化学苏教版 (2019)必修 第二册第三单元 含氮化合物的合理使用精品ppt课件
展开1.依据化合价理论,结合实验探究,掌握Fe、Fe2+、Fe3+相互转化的 途径,强化变化观念。2.通过实验探究学会Fe2+、Fe3+的检验方法,培养证据推理意识,提 升实验探究能力与创新意识。
一、Fe2+、Fe3+的相互转化与检验
二、铁单质、Fe3+、Fe2+之间的相互转化关系
1.铁元素的存在铁在自然界中可以以_____形态(主要存在于陨石中)存在,但主要以____价和____价_______的形态存在,地壳中含量居第____位,仅次于氧、硅和铝。
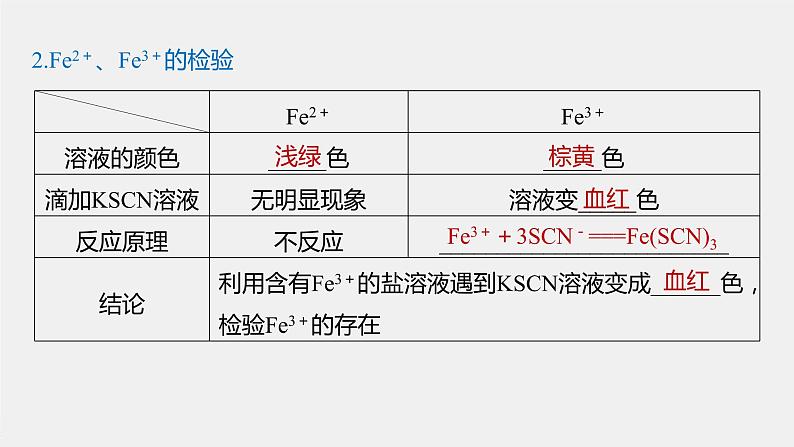
2.Fe2+、Fe3+的检验
Fe3++3SCN-===Fe(SCN)3
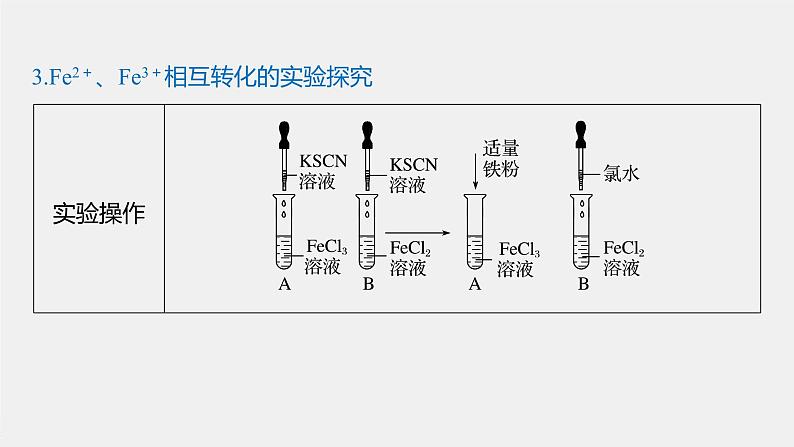
3.Fe2+、Fe3+相互转化的实验探究
2Fe3++Fe===3Fe2+
2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3
(1)向某溶液中滴加氯水,后滴加KSCN溶液,溶液变血红色,则原溶液中有Fe3+( )(2)向溶液中加入KSCN溶液,溶液变血红色,说明溶液中含有Fe3+,不含Fe2+( )(3)向FeCl3溶液中滴加KSCN溶液,出现红色沉淀( )
1.证明一个未知溶液中含有Fe2+,而不含有Fe3+的方法是什么?
2.Fe3O4中铁有+2价和+3价,通过所学的知识,有同学设计了一个实验来证明两种价态的存在,其方法为取少量固体溶于硫酸,将所得溶液分成两份,其中一份加入KSCN溶液,发现溶液_________,说明含有Fe3+;将另一份中加入少量的酸性KMnO4溶液中,发现酸性KMnO4溶液___________,说明含有Fe2+,这个实验中Fe2+表现_____性。
(1)检验溶液含有Fe2+、不含Fe3+的步骤
(2)Fe2+和Fe3+的混合溶液中检验Fe2+的方法通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+有干扰)。
1.Fe只具有_____性。可被弱氧化剂(H+、S等)和Fe3+氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。举例:Fe+2H+===__________;2Fe+3Cl2 ______。
2.Fe2+既有_____性又有_____性。可被强氧化剂[Cl2、KMnO4(H+)、空气中的O2、H2O2等]氧化为Fe3+;可被还原剂(CO、C等)还原为Fe。举例:2Fe2++H2O2+2H+===_____________;FeO+CO _________。3.Fe3+只具有_____性,可被弱还原剂(Cu等)和Fe还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。举例:2Fe3++Fe===______;______+Cu===_______+Cu2+Fe2O3+3CO ___________。
(1)FeCl2不能通过化合反应制得( )(2)同价态含铁物质间的转化一般可通过复分解反应实现( )(3)不同价态的含铁物质间转化必须通过氧化还原反应实现( )(4)FeCl3溶液可用于铜制印刷线路板制作,是因为FeCl3能从含Cu2+的溶液中置换出铜( )(5)将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红,检验Fe(NO3)2晶体是否已氧化变质( )(6)用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2( )
1.如何除去FeCl3溶液中的Fe2+,并写出离子方程式。提示 向溶液中加入适量氯水。2Fe2++Cl2===2Fe3++2Cl-。2.为什么在配制FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?提示 Fe2+易被氧化成Fe3+,加入铁粉或铁钉发生反应2Fe3++Fe===3Fe2+。
3.FeCl3可用作印刷电路铜板腐蚀剂(HCl—FeCl3),印刷铜制电路板的腐蚀液回收再利用一直是研究的热点。思考回答下列问题:(1)蚀刻铜板主要反应的离子方程式为______________________________,氧化剂是_______________。(2)腐蚀结束后,废腐蚀液中含有的金属阳离子有__________________。(3)检验废腐蚀液中是否含有Fe3+的方法是_________________________________________________________________________________________。
2Fe3++Cu===2Fe2++Cu2+
FeCl3(或Fe3+)
Fe3+、Fe2+和Cu2+
取少量待测液于试管中,加入KSCN溶液,若溶液变为红色,则证明含有Fe3+;反之,则不含Fe3+
(4)腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
①步骤Ⅰ所加试剂和操作分别为________________________;有关离子方程式:________________________________________________________________。②可实现步骤Ⅱ转化的物质或方法是____________(填一种即可);有关离子方程式:_________________________________________________________________。
过量铁粉和稀盐酸,过滤
2Fe3++Fe===3Fe2+、Cu2++Fe===Cu+Fe2+、2H++Fe===Fe2++H2↑
2Fe2++Cl2===2Fe3++2Cl-(或2Fe2++H2O2+2H+===
2Fe3++2H2O)
铁单质、Fe2+和Fe3+的性质
(1)Fe有变价,所以反应后的产物与氧化剂的强弱及反应条件有关。
1.(2020·福建莆田一中高一月考)下列关于Fe2+和Fe3+的叙述中,错误的是A.Fe2+的水溶液为浅绿色B.Fe3+的水溶液为黄色C.Fe3+具有氧化性,Fe2+具有还原性D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
解析 常见水溶液有颜色的离子有Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、 (紫色),故A、B项正确;通常情况下,铁的化合价有0价、+2价、+3价,Fe2+处于中间价态,既能得电子,又能失电子,所以既有氧化性,又有还原性,一般认为Fe3+处于最高价,因此具有氧化性,C项正确;Fe3+溶液中滴入含SCN-的溶液,生成红色可溶性物质,不是红色沉淀,D项错误。
2.(2019·河北衡水月考)某化学小组为验证Fe3+与Fe2+能够相互转化,进行如下实验。下列分析不合理的是A.解释现象ⅰ的反应:2Fe3++Fe===3Fe2+B.实验②与③可以调换顺序C.溶液变红涉及反应:Cl2+2Fe2+===2Cl-+2Fe3+D.氧化性:Cl2>Fe3+>Fe2+
解析 向FeCl3溶液中加入过量铁粉,铁与Fe3+反应生成Fe2+,溶液由黄色变为浅绿色,A正确;先加氯水,Fe2+被氧化为Fe3+,再加KSCN溶液,溶液变红,无法检验Fe2+,B错误;滴入氯水后,Fe2+被氧化为Fe3+,C正确;由反应方程式可知,氧化性:Cl2>Fe3+>Fe2+,D正确。
解析 B项中的Cl-也能使酸性KMnO4溶液褪色。
3.下列有关物质检验方法不合理的是A.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色, 该溶液中一定含有Fe2+B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2C.检验绿矾晶体是否已氧化变质,可将绿矾晶体溶于稀H2SO4后滴加 KSCN溶液,再观察溶液是否变红D.向某溶液中加入NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+
4.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是A.只需滴加KSCN溶液B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色C.先滴加氯水,再滴加KSCN溶液后显红色D.滴加氢氧化钠溶液,立即产生红褐色沉淀
解析 只滴加KSCN溶液,根据溶液是否显红色,能检验出溶液中是否含有Fe3+,无法验证Fe2+的存在,故A错误;KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,故B正确;先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故C错误;滴加NaOH溶液,产生红褐色沉淀,只能证明存在Fe3+,故D错误。
5.铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:(1)Fe与过量盐酸反应可以制取FeCl2,若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可分别选用_____(填字母)。a.Cl2 b.Fe c.Cu d.KMnO4
(2)Fe2O3+3NaClO+4KOH 2K2FeO4(高铁酸钾)+3NaCl+2H2O①还原剂是_______,具有______性。②用单线桥表示该反应的电子转移情况。
答案 +4KOH 2K2FeO4(高铁酸钾)+3NaCl+2H2O
题组一 Fe2+、Fe3+的检验1.有NaCl、FeCl3、FeCl2、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是A.盐酸 B.烧碱溶液C.硫氰化钾溶液 D.硝酸银溶液
解析 将过量NaOH溶液分别加入题述几种溶液中,无明显现象的是NaCl,生成白色沉淀且迅速变为灰绿色最后变为红褐色的是FeCl2,立即生成红褐色沉淀的是FeCl3,生成白色沉淀且沉淀颜色无变化的是MgCl2。
2.下列离子的检验方法合理的是A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含 有Fe2+C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为 红褐色,说明原溶液中含有Fe2+,不含有Mg2+
解析 ①Fe3+与SCN-生成红色Fe(SCN)3;②Fe2+遇到OH-生成白色Fe(OH)2沉淀;③Fe3+遇到OH-生成红褐色Fe(OH)3沉淀。A项中现象可以证明存在Fe3+,但无法确定Fe2+是否存在,错误;B项中现象可以证明通入Cl2后存在Fe3+,但原溶液是只存在Fe2+,还是只存在Fe3+或Fe2+、Fe3+均含有,不能确定,错误;Fe(OH)2转化为红褐色Fe(OH)3时会干扰其他白色沉淀的观察,所以当含Fe2+的溶液中含有其他能与碱生成白色沉淀的离子时,也同样出现D项所述现象,D项错误。
解析 检验的原理是Fe3+遇SCN-显红色,而Fe2+遇SCN-不显红色。加入KSCN溶液不显红色证明无Fe3+,再加新制氯水,如有Fe2+则可被氧化为Fe3+,遇SCN-显红色。酸性KMnO4溶液也能氧化Fe2+,但因其本身呈紫色,使Fe3+与SCN-的反应现象不明显,因此不选用酸性KMnO4溶液。
3.要证明某溶液中不含Fe3+而可能含Fe2+,有如下实验操作:①加足量新制氯水;②加足量酸性KMnO4溶液;③加少量KSCN溶液。则最佳顺序是A.①③ B.③②C.③① D.①②③
解析 该反应中铜元素化合价升高,被氧化,为还原剂;铁元素化合价降低,被还原,Fe3+为氧化剂;生成物中没有单质,不是置换反应;该反应为离子反应。
题组二 铁盐、亚铁盐的性质4.刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生的反应为Cu+2Fe3+===2Fe2++Cu2+。根据该反应判断下列说法不正确的是A.铜是还原剂B.Fe3+具有氧化性C.该反应是置换反应D.该反应属于离子反应
5.下列实验设计及其对应的离子方程式均正确的是A.把铁片插入CuSO4溶液中,验证古代湿法冶铜:2Fe+3Cu2+===2Fe3+ +3CuB.某溶液中滴入KSCN溶液显红色,说明含Fe3+:Fe3++3SCN-=== Fe(SCN)3C.FeCl3溶液中加入铜粉:Fe3++Cu===Fe2++Cu2+D.若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺 序,可用Zn、Cu和AgNO3溶液:Zn+2Ag+===Zn2++2Ag
解析 A中正确的离子反应为Fe+Cu2+===Fe2++Cu;C中离子反应为2Fe3++Cu===2Fe2++Cu2+;D中Zn、Cu均能与AgNO3发生置换反应生成Ag,则不能比较Zn、Cu的金属性,D错误。
6.(2020·天津市蓟州区月考)下列关于铁及其化合物的说法中正确的是A.赤铁矿的主要成分是Fe3O4B.某溶液中先加入KSCN溶液无现象,再通入Cl2,发现溶液变红,则证 明原溶液含有Fe2+C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,生成红色沉淀D.Fe与水蒸气在高温下发生反应生成Fe2O3和H2
解析 赤铁矿的主要成分是Fe2O3,A错误;磁铁矿粉末溶于盐酸后生成氯化亚铁、氯化铁和水,加入KSCN溶液,溶液变为红色,不是生成红色沉淀,C错误;Fe与水蒸气在高温下发生反应生成Fe3O4和H2,D错误。
7.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是A.滴入KSCN溶液 B.加入铁粉C.通入氯气 D.加入铜粉
解析 Fe+2FeCl3===3FeCl2,故可用Fe除去FeCl2中的FeCl3。
题组三 铁单质、Fe2+、Fe3+之间的相互转化关系8.已知下述四个实验均能发生化学反应:
下列判断不正确的是A.实验①中铁钉只做还原剂B.实验②中Fe2+只显还原性C.实验③中发生的是置换反应D.上述实验证明:氧化性:Fe3+>Cu2+>Fe2+,Fe2+遇KSCN溶液无红色 物质生成
解析 ①中发生反应Fe+Cu2+===Fe2++Cu,其中铁做还原剂,A正确;②中发生反应2Fe2++Cl2===2Fe3++2Cl-,其中Fe2+做还原剂,表现还原性,B正确;③中发生反应为Cu+2Fe3+===2Fe2++Cu2+,不属于置换反应,C不正确;氧化性:由①知Cu2+>Fe2+,由③知Fe3+>Cu2+,即Fe3+>Cu2+>Fe2+,由④可知Fe2+遇KSCN溶液不生成红色物质,D正确。
9.下列物质能通过化合反应直接制得的是①FeCl2 ②FeCl3 ③Fe(OH)3 ④Fe3O4A.只有①②③ B.只有②③C.只有①③④ D.全部
解析 铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化。
10.(2019·哈尔滨高一检测)同学们用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 ml·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______________。
解析 氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变血红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________。
2Fe2++Cl2===2Fe3++2Cl-
解析 煤油不溶于水,密度比水小,分层后可以隔离溶液与空气,排除氧气对实验的影响。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变血红,煤油的作用是________________________________。
隔绝空气(排除氧气对实验的影响)
解析 CCl4层显紫色说明有单质碘生成,这是由于铁离子氧化碘化钾,发生反应的离子方程式为2Fe3++2I-===2Fe2++I2。
(4)丙同学取10 mL 0.1 ml·L-1 KI溶液,加入6 mL 0.1 ml·L-1 FeCl3溶液混合。取2 mL此溶液于试管中,加入1 mL CCl4充分振荡、静置,CCl4层显紫色,发生反应的离子方程式为_______________________。
2Fe3++2I-===2Fe2++I2
解析 向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢将亚铁离子氧化为铁离子,反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________________________________。
H2O2+2Fe2++2H+===2Fe3++2H2O
1.选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂顺序能达到实验目的的是
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。溴水符合条件,实验现象是溴水颜色变浅,酸性KMnO4溶液也符合条件:5Fe2++ +8H+===5Fe3++Mn2++4H2O,实验现象是溶液的紫色变浅。乙组,在Fe2+存在的条件下检验Fe3+,用KSCN溶液检验Fe3+即可,Fe2+不会造成干扰。
2.下列离子方程式正确的是A.将氨水滴入到FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓B.氧化铁与盐酸反应:Fe2O3+6H+===2Fe3++3H2OC.向FeCl3溶液中加入铁粉:Fe+Fe3+===2Fe2+D.向氯化亚铁溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl-
解析 A项,在书写离子方程式时,弱电解质NH3·H2O不能拆写成离子的形式;C项,离子方程式中除遵循元素守恒外,电荷也必须守恒,正确的离子方程式应为Fe+2Fe3+===3Fe2+;D项,只符合元素守恒,不符合电荷守恒,正确的离子方程式应为2Fe2++Cl2===2Fe3++2Cl-。
3.在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是A.Cu2+ B.Fe3+ C.Fe2+ D.H+
解析 因所剩固体能被磁铁吸引,说明Fe有剩余,2Fe3++Fe===3Fe2+,Cu2++Fe===Cu+Fe2+,2H++Fe===Fe2++H2↑,即Fe3+、Cu2+、H+可与Fe反应,不可能存在较多。
4.将金属铁、铜投入FeCl3溶液中充分反应,下列对反应情况设想的评价正确的是
解析 因离子的氧化性强弱顺序为Fe3+>Cu2+>Fe2+。如果Fe3+足量,Fe3+可将铁和铜全部氧化且Fe3+可能还有剩余,A错误;当铁剩余时,溶液中不会存在Cu2+,B错误;当铜剩余时,溶液中肯定无Fe3+,一定有Fe2+,可能有Cu2+,C错误。
5.向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是A.加入KSCN溶液一定不变红色B.溶液中一定含Fe2+C.溶液中一定含Cu2+D.剩余固体中一定含Cu
解析 溶液中Fe3+、Cu2+均具有氧化性,且氧化性:Fe3+>Cu2+,若加入的铁粉是少量的,Fe3+有剩余,加入KSCN溶液仍会变血红,但若Fe3+有剩余,则不会有Cu置换出来,即没有固体存在。铁粉无论与Fe3+还是与Cu2+反应,均生成Fe2+,若铁粉是过量的,则Cu会被完全置换出来,溶液中无Cu2+。
6.小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。 (1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是_____________________________________________________________。(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 ml·L-1 FeCl2溶液、KSCN溶液、新制氯水。①对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为____________。
因为Fe2+中铁元素的化合价处于中间价态,既可以升高也可以降低
②若小明计划在0.1 ml·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是__________________________(写离子方程式),溶液由浅绿色变为_____色。③实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选____________滴入小明所得的混合液中,并通过溶液出现______色的现象,证明小明的观点和实验方案都是正确的。
Cl2+2Fe2+===2Cl-+2Fe3+
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2反应时,Fe2+还做氧化剂吗?①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成____(填化学符号,下同),若Fe2+在反应中表现出还原性应转化成_____。②实际上Fe2+的还原性较强,实验室中的FeCl2溶液常因氧化而变质。除杂的方法是______________,相关反应的离子方程式:____________________。
2Fe3++Fe===
7.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 ml·L-1 FeCl3溶液,0.1 ml·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式_________________________________。
===2FeCl3(答案合理即可)
解析 在反应中Fe2+做还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,反应为2FeCl2+Cl2===2FeCl3。
(2)设计实验方案,完成下列表格。
解析 向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe===3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2的溶液中滴加硫氰化钾溶液后,溶液不变红。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为________________________。
解析 向FeCl2的溶液中加入锌粉,离子反应为Zn+Fe2+===Fe+Zn2+。
Fe2++Zn===Zn2+
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、 、H2O和一种未知离子X,已知 在反应中得到电子,则X是_____。
解析 已知 是氧化剂,Mn2+为还原产物,则题目提供的Fe3+是氧化产物,故还原剂为Fe2+,即X为Fe2+。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度图片课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度图片课件ppt,共11页。PPT课件主要包含了学习目标,不能自发进行,不需借助外力,方向性,混乱或无序,混乱度,熵增原理,归纳总结,复合判据等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修3第二单元 科学家怎样研究有机物教课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修3第二单元 科学家怎样研究有机物教课课件ppt,共15页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第二单元 化学反应的方向与限度优质ppt课件: 这是一份苏教版 (2019)选择性必修1专题2 化学反应速率与化学平衡第二单元 化学反应的方向与限度优质ppt课件,共60页。PPT课件主要包含了内容索引,自发反应,课时对点练,方向性,不能自动进行,自动进行,正反应,正误判断,应用体验,自发进行等内容,欢迎下载使用。













