




专题19 化学工艺流程题-2021年中考化学二轮专题课件(人教版)
展开废旧金属的回收利用工艺
一、解题思路分析1.总览全题,找出原料和目标产物;2.在流程图上找主线;3.围绕主线精读流程(重点是对原料进行预处理和物质的分离方法),推断相关物质,并写出相关的化学方程式;4.若有超出考纲的内容,尝试回归题目,在题目中寻找答案。
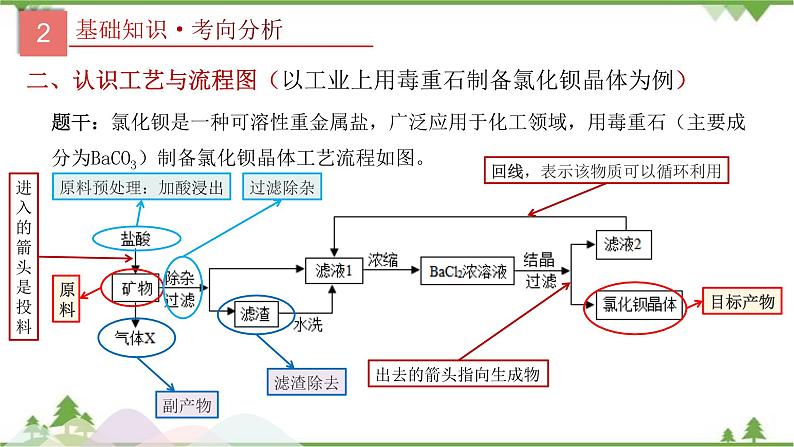
二、认识工艺与流程图(以工业上用毒重石制备氯化钡晶体为例)
题干:氯化钡是一种可溶性重金属盐,广泛应用于化工领域,用毒重石(主要成分为BaCO3)制备氯化钡晶体工艺流程如图。
回线,表示该物质可以循环利用
三、常见的工艺与流程类型
(1)常见对原料进行预处理的方法 ①加酸(酸浸)或加碱(碱浸):使原料中的物质与酸或碱反应形成溶液; ②粉碎(研磨):增大反应物的接触面积,加快反应速率或使反应更充分。 ③灼烧(煅烧):使固体或杂质在高温下分解。(2)常见的除杂方法: ①调pH除杂:利用物质的酸碱性调节溶液的PH,使某些离子转化为沉淀; ②试剂除杂:根据物质的化学性质,加入相应的试剂除去某些杂质; ③氧化除杂:利用氧化剂进行物质转化;(3)常用的分离方法: ①过滤(适用于难溶性固体和液体混合物的分离);②蒸发结晶;③降温结晶(操作过程:蒸发浓缩→冷却结晶→过滤→洗涤→干燥);④洗涤和烘干等
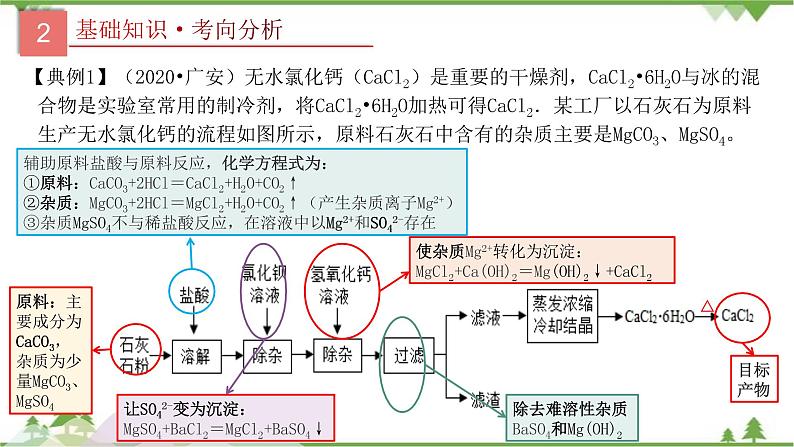
【典例1】(2020•广安)无水氯化钙(CaCl2)是重要的干燥剂,CaCl2•6H2O与冰的混合物是实验室常用的制冷剂,将CaCl2•6H2O加热可得CaCl2.某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO3、MgSO4。
原料:主要成分为CaCO3,杂质为少量MgCO3、MgSO4
辅助原料盐酸与原料反应,化学方程式为:①原料:CaCO3+2HCl=CaCl2+H2O+CO2↑②杂质:MgCO3+2HCl=MgCl2+H2O+CO2↑(产生杂质离子Mg2+)③杂质MgSO4不与稀盐酸反应,在溶液中以Mg2+和SO42-存在
让SO42-变为沉淀:MgSO4+BaCl2=MgCl2+BaSO4↓
使杂质Mg2+转化为沉淀:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
除去难溶性杂质BaSO4和Mg(OH)2
(1)过滤和蒸发均用到的玻璃仪器是 。(2)石灰石溶解时,杂质MgCO3发生反应的化学方程式为 ,该反应是 (填基本反应类型)(3)加入BaCl2溶液除去的杂质离子是 ,加入氢氧化钙溶液除杂的化学方程式为 。(4)由CaCl2•6H2O得到CaCl2是 变化(填“物理”或“化学”)。
MgCO3+2HCl=MgCl2+H2O+CO2↑
Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2
【变式训练】(2020•泰安)无水氯化钙在工业上有广泛的用途。以石灰石矿粉(含有SiO2、Fe2O3、MgSO4等杂质)为原料,生产无水氯化钙的流程如图:
回答下列问题:(1)从流程图中推知:SiO2具有的化学性质是 。(2)氧化铁与盐酸反应的化学方程式为 。(3)滤渣3中除有Ca(OH)2外,还有 、 (填化学式,下同)。(4)产品中的杂质除极少量H2O外,最有可能含的是 。
Fe2O3+6HCl═2FeCl3+3H2O
主要包括海水中提取食盐、金属镁、溴等物质。
(1)粗盐的提纯:粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+、Mg2+、SO42-等可溶性杂质。·不溶性杂质可以用过滤的方法除去,步骤为: 、 、 ;·可溶性杂质中的SO42-、Ca2+、Mg2+则可通过加入BaCl2、NaOH和Na2CO3溶液生成沉淀而除去,最后蒸发水分得到较纯净的精盐。提纯步骤如下: ①溶解; ②加入过量BaCl2溶液去除SO42-,化学方程式为: ; ③加入过量NaOH溶液去除Mg2+,化学方程式为: ; ④加入过量Na2CO3溶液去除Ca2+及BaCl2中的钡离子(加入BaCl2溶液和Na2CO3溶液的顺序不能颠倒),化学方程式为: 、 ;
BaCl2+Na2SO4═BaSO4↓+2NaCl
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl
Na2CO3+CaCl2═CaCO3↓+2NaCl
⑤过滤; ⑥向滤液中加入适量HCl除去过量NaOH、Na2CO3,: 、 ; ⑦蒸发结晶。
HCl+NaOH═NaCl+H2O
Na2CO3+2HCl═2NaCl+CO2↑+H2O
(2)海水提镁 ·Ca(OH)2的生成:CaCO3===CaO+CO2↑ (分解反应) CaO+H2O==Ca(OH)2 (化合反应) ·MgCl2+Ca(OH)2 ===Mg(OH)2↓+CaCl2 (复分解反应)·Mg(OH)2+2HCl===MgCl2+2H2O (复分解反应)·MgCl2通电Mg+Cl2↑ (分解反应)
【例2】(2020•常州中考节选)2020年6月23日,我国长征五号B运载火箭搭载第55颗北斗导航卫星发射成功,北斗三号全球卫星导航系统星座部署全面完成。人造地球卫星的结构材料常用镁合金等,金属镁可从海水中提取,工艺流程如图:
原料1:主要含NaCl和MgCl2
原料2:主要为CaCO3
制Ca(OH)2:CaCO3===CaO+CO2↑CaO+H2O===Ca(OH)2
NaCl的饱和溶液,含MgCl2
使Mg2+转化为沉淀Mg(OH)2并过滤:MgCl2+2Ca(OH)2=Mg(OH)2↓+CaCl2
加稀盐酸溶解:Mg(OH)2+2HCl===MgCl2+2H2O
电解:MgCl2 Mg+Cl2↑
(1)粗盐经过溶解、过滤、蒸发后得到的精盐是 (选填“纯净物”或“混合物”)。(2)反应②的过程是 (选填“放热”或“吸热”)过程。(3)“母液”中含MgCl2,以上①~④步化学反应中未涉及的反应类型是 。a.化合反应 b.分解反应 c.复分解反应 d.置换反应(4)已知某海域海水中总的含盐量约为3.5%,盐中镁元素的质量分数约为3.7%,则海水中镁元素的质量分数约为 (保留两位有效数字),由此可知,用海水晒盐后剩余的“母液”来提取镁,而不直接用海水的主要原因是 。
海水中镁元素含量很低,“母液”中镁元素含量较高
【例3】(2020•长春)粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程:
原料:主要成分为NaCl,杂质为少量Na2SO4、CaCl2、MgCl2及泥沙
使杂质Mg2+转化为沉淀:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
让Ca2+和Ba2+变为沉淀:Na2CO3+CaCl2═CaCO3↓+2NaClBaCl2+Na2CO3═BaCO3↓+2NaCl
除去过量的OH-和CO32-:HCl+NaOH═NaCl+H2ONa2CO3+2HCl═2NaCl+CO2↑+H2O
回答下列问题:(1)操作1相当于实验室中的 操作;(2)沉淀1的化学式为 ;(3)加入过量试剂1的目的是 ;(4)滤液4中含有的阴离子是 (填离子符号)。
除去溶液中的硫酸根离子
Cl﹣、OH﹣、CO32﹣
【变式训练】(2019•烟台)烟台有漫长的海岸线,蕴藏着丰富的海洋资源。
(1)海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是 (填字母序号)。A.膜分离法的原理与滤纸过滤原理类似 B.膜分离法还可以浓缩海水中的盐类物质C.膜分离法也是一种分离混合物的方法 D.该膜分离法的目的是除去海水中的不溶物
(2)粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42﹣等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液③加入过量的NaOH溶液; ④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是 (填字母序号),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是 。A.①③②④⑤⑥ B.③②①④⑤⑥ C.③①②⑤④⑥ D.②③①⑤④⑥(3)海水资源综合利用的部分途径如图2。①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是 。②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是 。③海水制镁。实际生产中,步骤Ⅲ常选用 作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是 。
除去过量的氢氧化钠和碳酸钠
NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
3.废旧金属的回收利用工艺
[相关知识](1)金属的化学性质
①活泼金属与酸反应:金属+酸→盐+氢气
条件:金属在金属活动性顺序中排在氢之 ;酸指的是 和 。
②与盐反应:金属+盐溶液→新盐+新金属条件:金属(钾、钙、钠除外)的活动性强于盐中金属阳离子对应的金属;盐必须可溶于水。
(2)金属活动性顺序及应用
【例4】(2020•新疆)从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
金属铝、铁位于氢之前,可以与稀硫酸反应:Fe+H2SO4=FeSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑
FeSO4、Al2(SO4)3
金属铜与稀硫酸、氧气供热生成硫酸铜:2Cu+2H2SO4+O2===2CuSO4+2H2O
(1)图中“操作”的名称是 。(2)写出所得贵重金属中任意一种成分的化学式 。(3)写出①中发生的化学反应方程式 或 (任写一种);该反应的基本类型为 。(4)写出②中发生的化学反应方程式 。
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4═Al2(SO4)3+3H2↑
2Cu+2H2SO4+O2 2CuSO4+2H2O
【变式训练】(2020•广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图:
(1)该废酸液的pH 7(填“<”或“>”)。操作Ⅰ的名称为 。(2)电石渣转化为石灰乳的过程会 (填“吸收”或“放出”)热量。
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是 和 (填化学式)。(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 。(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 ,pH较低时产率较低的主要原因是 。
1.(2019•白银)以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)如图所示,下列说法不正确的是( )
A.X是N2 B.分离空气属于物理变化 C.尿素属于氮肥 D.煤与氧气的反应吸收热量
题型1 物质的制备工艺
2.(2020•南宁)广西蕴含丰富的铝土资源,铝工业是广西传统优势产业,某工厂用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取Al2O3,提取流程如图所示:
已知Ⅰ.NaOH+Al(OH)3═NaAlO2+2H2O Ⅱ.NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3(1)“酸浸”时,通常将铝土矿进行粉碎处理,“粉碎”的主要目的是 。(2)经检验,滤渣Ⅰ的主要成分是SiO2,由此推测SiO2的性质有 (填序号)。A.难溶于水 B.化学性质很活泼 C.不能与盐酸反应 D.不能与NaOH溶液反应(3)溶液Ⅱ中含有的溶质是 (用化学式表示)。(4)滤渣Ⅲ加热时,生成Al2O3和一种常见的氧化物,请写出反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
增大反应物接触面积,使反应更快、更充分
NaOH、NaCl、NaAlO2
2Al(OH)3 Al2O3+3H2O
3.(2020•长春)接触法生产硫酸的工艺流程如图:
(2)写出第4步化学反应方程式 ;(3)第1步至第4步流程中涉及到的物质,属于氧化物的有 (用化学式表示);(4)若用3.2吨硫为原料,则理论上能产出98%的浓硫酸 吨。
回答下列问题:(1)第1步反应中将液态硫喷入反应器的目的是 __________________________________________;
H2S2O7+H2O=2H2SO4
SO2、SO3、H2O
4.(2020•益阳)以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的主要工艺流程如图:
已知:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。(1)操作Ⅰ、Ⅱ的名称是 。(2)滤渣a的主要成分是 (填化学式)。(3)“酸浸”时稀硫酸与镁矿石主要成分发生反应的化学方程式是 。(4)“加热”过程中发生 反应(填基本反应类型)。
MgCO3+H2SO4=MgSO4+H2O+CO2↑
5.(2019•梧州)制备高纯硅和二氧化硅主要工艺流程如图所示。
(1)2019年,我国华为公司推出了5G商用芯片。制造芯片要用到高纯硅,硅属于 元素(填“金属”或“非金属”)。(2)反应①的化学方程式为:SiO2+2C Si+2CO↑,从氧化还原反应角度分析,C发生了 反应。(3)用于制造光导纤维的高纯二氧化硅,可利用反应②制备,同时生成一种可循环使用的物质,该反应的化学方程式为 。整个工艺流程中,还可以循环利用的另一种物质是 。
SiCl4+O2 SiO2+2Cl2
6.(2018•昆明)金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成份为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
(1)反应①的化学方程式为 。(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12:71的比例参加反应,相应的化学方程式为 。(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为 。
H2TiO3 H2O+TiO2;
2FeSO4 Fe2O3+SO2↑+SO3↑
TiO2+2C+2Cl2 TiCl4+2CO;
7.(2018•泰安)从海水中制备纯碱和金属镁的流程如图所示:
下列说法错误的是( )A.流程Ⅰ中依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液和适量稀盐酸去除杂质B.流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳C.上述流程涉及到三种基本反应类型D.流程Ⅳ、V是通过化学方法富集氯化镁
8.(2019·荆门) 氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料,生产氯气和氢氧化钠,模拟流程如下: (1)试剂A与试剂B的组合为__________(填序号) ①KOH ②NaOH ③K2CO3 ④Na2CO3(2)操作A需使用玻璃棒,玻璃棒的作用是__________; (3)流程中Mg元素必须转化成 __________(填化学式)才能完全除去。 (4)写出电解NaCl溶液的化学方程式______________________________________; (5)该工业副产品H2目前还不能作为燃料被广泛应用,其理由______________________________________(答一条即可)
H2不易储存和运输或生产H2的成本高
2NaCl+2H2O H2↑+Cl2↑+2NaOH
9.(2019•淄博)实验室有一瓶除去难溶性杂质的粗盐样品,其中还含有少量的氯化镁和氯化钙。为了得到较纯净的食盐晶体,同学们设计如下实验方案,请你参与他们的实验探究。
(1)实验过程中,向粗盐水中先加入过量的氢氧化钙溶液,再加入过量的碳酸钠溶液,依次加入的目的是 ,写出两种盐之间发生反应的化学方程式 。(2)实验过程中,用到的操作有 ,得到食盐晶体时,应在 中进行。
除去MgCl2、CaCl2和过量的Ca(OH)2
CaCl2+Na2CO3═CaCO3↓+2NaCl
10.(2018•常州)氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是 。
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
①你认为碱样品中含有Na2CO3的原因是 ,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是( ) a.酚酞 b.稀盐酸 c.澄清石灰水②李老师设计和完成了如下实验来判断碱样品的等级。称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
氢氧化钠与二氧化碳反应生成碳酸钠
11.(2020•贵港)碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域。制取碳酸钾的工艺流程示意图如图:
根据如图表信息,回答下列问题:(1)生成碳酸钾的化学方程式为 。(2)上述流程中可循环使用的物质是 ,NH4Cl在农业上可用作 。(3)得到K2CO3晶浆的结晶方法是 。(4)上述流程中洗涤K2CO3晶体应选用 (填序号)。①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
2KCl+CO2+2NH3+H2O=K2CO3↓+2NH4Cl
12.(2019•贺州)利用含氧化铜和氧化锌的工业废料,经过处理后可得到铜和七水硫酸锌(ZnSO4•7H2O)晶体,主要流程如图:
(2)步骤②中加入过量的物质C的目的是 (用化学方程式表示)。(3)步骤③的操作是 。(4)步骤④的操作是蒸发浓缩、 、过滤。
题型3 废旧金属的回收利用和环保工艺
(1)步骤①中过量的物质A是 (填化学式)。
Zn+CuSO4═ZnSO4+Cu
13.(2019•镇江)用废铜屑生产硫酸铜晶体(CuSO4•5H2O)的流程如下:
(1)“溶解”时需要加热,但温度不宜过高,原因是 。(2)“系列操作”包括:除杂、蒸发浓缩、 、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、 。(3)“洗涤”时为减少晶体损失,最好选用 (选填序号)。a.热水 b.冰水 c.95%的酒精溶液
14.(2020•株洲)覆铜板是制作印刷线路板的基本材料。覆铜板中的金属Sn占2﹣10%,Cu占90﹣98%.简易工艺流程如图:
a.溶解性不同 b.密度不同 c.沸点不同(2)步骤④中涉及的分离操作是 (填操作名称)。(3)通过步骤⑤和⑥所得洗涤液的pH 7(填“>”、“<”、“=”)。(4)设计步骤⑦的主要目的是 。(5)步骤⑨中涉及的主要化学方程式为 。
(1)将废旧镀锡覆铜板粉碎后,通过步骤②可将其分离为有机树脂材料(固体)和铜锡粉。根据化学常识回答,此工艺利用的是 的
Sn(OH)4 SnO2+2H2O↑
15.(2019·淮安)胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
查阅资料:氧化锌能溶于氢氧化钠溶液。(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起________作用。(2)“灼烧”完全(已充分反应)的判断依据是____________________。(3)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、__________________________________等。(4)“酸溶”时,发生反应的化学方程式是______________________________________。
加热(或增大氢氧化钠溶液的浓度)
CuO+H2SO4===CuSO4+H2O
16.(2019·南宁)工业上利用某废渣【含FeSO4、Fe2(SO4)3及少量CaO和MgO】制备高档颜料铁红(主要成分为Fe2O3)和回收(NH4)2SO4。具体生产流程如下:
【背景信息】 a.氧化还原反应中,会有元素化合价发生变化。 b.3Fe2(SO4)3+12NH3·H2O===(NH4)2Fe6(SO4)4(OH)12↓(铵黄铁矾晶体)+5(NH4)2SO4 (1)步骤③中操作Y的名称是__________。
(2)加入物质X溶解废渣,X应选用_______(填序号)。 A.盐酸 B.硫酸 C.氨水 D.氢氧化钠 步骤①酸浸时,生成盐的化学方程式为___________________________________ (任写一个)。
(3)步骤②通入氧气氧化的目的是______________________________;工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe2+氧化率的变化规律:__________________________________。
MgO+H2SO4===MgSO4+H2O
温度越高,pH值越小,氧化率越高
将FeSO4氧化成Fe2(SO4)3
1.(2020•萨尔图区校级模拟)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。
已知Zn(OH)2溶于强碱形成可溶性盐。有关该流程的说法不正确的是( )A.滤渣Ⅰ中一定有铜B.加酸溶解废弃物时,有氢气生成需要通风并远离火源C.调节pH可用NaOH,不能过量D.滤液Ⅰ中一定有3种溶质
2.(2021•河南模拟)为除去粗盐中的泥沙、MgCl2、CaCl2和Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按如图流程进行实验。
(1)操作Ⅰ和操作Ⅱ中均使用的一种玻璃仪器是 。(2)写出加入NaOH溶液时发生反应的化学方程式 。(3)加入适量稀盐酸的作用是什么? 。
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
除去滤液中过量的氢氧化钠和碳酸钠
3.(2021•郫都区校级模拟)如图是工业制备硝酸的生产过程示意图。
(1)步骤①反应中负极产生的气体其有的化学性质有(写两条) 。(2)步骤②发生的是 变化(填“物理”或“化学”);从微观角度解释NO和NO2化学性质不同的原因 。(3)步骤④中发生反应的化学方程式为 。(4)制取硝酸过程中可循环使用的物质是 。
4NH3+5O2 4NO+6H2O
4.(2020•商南县模拟)氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如图:
(1)推测草酸的化学式是: 。(2)“操作A”后得到草酸锌和溶液,“操作A”的名称是 。(3)“酸溶”后生成的氯化锌和草酸铵在“沉锌”过程中发生复分解反应反应的化学方程式是 。(4)高温灼烧时反应的化学方程式是:ZnC2O4 ZnO+CO↑+CO2↑,该反应中碳元素的化合价有 种。
ZnCl2+(NH4)2C2O4═ZnC2O4↓+2NH4Cl
5.(2020•嘉鱼县二模)高纯氧化钙是用于电子工业的重要无机化工原料。用硝酸钙溶液制备高纯氧化钙的工艺流程如图:
(1)玻璃棒在操作Ⅰ中的作用是 。(2)写出灼烧时反应的化学方程式 。(3)该工艺流程中可循环使用的物质是 (写名称)。(4)上述流程中的副产物NH4NO3在农业生产中最重要的 肥。
CaCO3 CaO+CO2↑
2024山东中考化学二轮专题复习 专题六 工艺流程题(课件): 这是一份2024山东中考化学二轮专题复习 专题六 工艺流程题(课件),共45页。PPT课件主要包含了答案D,碳酸钙,FeOH3,氢氧化钠溶液,复分解,温室效应加剧,CO2,NaOH溶液,稀硫酸或稀盐酸,加热至质量不再减少等内容,欢迎下载使用。
2024内蒙古中考化学二轮专题突破 专题五 工艺流程题(课件): 这是一份2024内蒙古中考化学二轮专题突破 专题五 工艺流程题(课件),共39页。PPT课件主要包含了类型1物质制备流程,稀盐酸,降温结晶,BaOH2,NaClO3,Cl2和NaCl溶液,Fe2O3,化合反应,SO3,碳酸钙等内容,欢迎下载使用。
2024湖南中考复习 人教版化学 专题五 工艺流程题 课件: 这是一份2024湖南中考复习 人教版化学 专题五 工艺流程题 课件,共28页。PPT课件主要包含了专题突破·明技法,②①③④,较多量固体,生石灰,有机物,Fe2+,SiO2和Fe,强化训练·检成效,CaO,置换反应等内容,欢迎下载使用。













