






高中化学人教版 (新课标)必修2第三节 化学键教课ppt课件
展开第三节 化学键第1课时 离子键
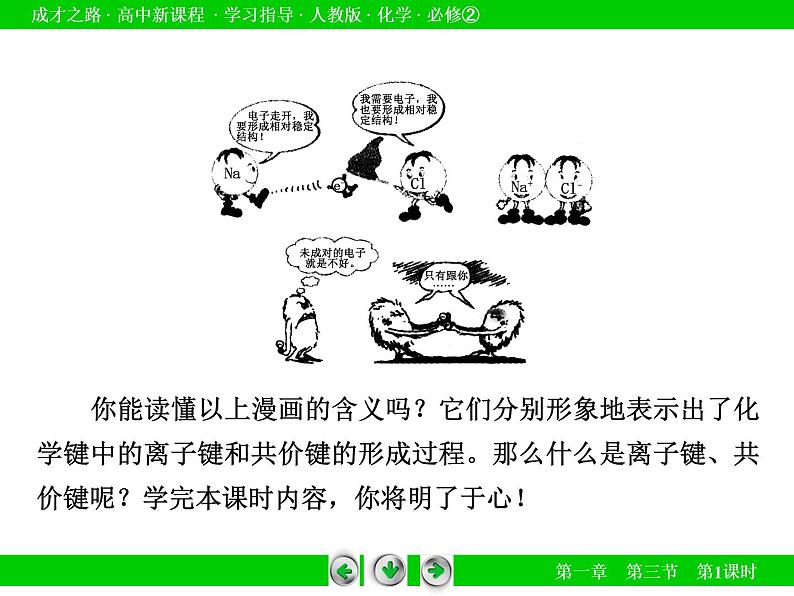
1654年格里克在德国马德堡做了著名的马德堡半球实验,16匹马的力量居然没有把两个合在一起的抽空空气的铜球拉开!当原子和原子结合为分子时,原子之间存在着强烈的相互作用——化学键,化学反应中要拆开原子间的化学键就如同马德堡半球实验那样难!什么是化学键?常见的化学键有哪些?请让我们一块走进教材第三节化学键。同学们先看下图:
你能读懂以上漫画的含义吗?它们分别形象地表示出了化学键中的离子键和共价键的形成过程。那么什么是离子键、共价键呢?学完本课时内容,你将明了于心!
●学习目标1.了解离子键的含义。2.能用电子式表示简单离子化合物的形成过程。●新知预习1.Na与Cl2的反应钠在Cl2中剧烈燃烧,火焰呈________________色,产生__________,化学方程式____________________________。
2.NaCl的形成由钠原子和氯原子的核外电子排布可看出,钠原子要达到8电子的稳定结构,就需__________1个电子;而氯原子要达到8电子的稳定结构则需_________1个电子。钠与氯气反应时,钠原子的_______________________转移到氯原子的最外电子层上,形成_______________________的钠离子和带负电的__________。带相反电荷的钠离子和氯离子,通过_________结合在一起,从而形成与单质钠和单质氯性质完全不同的氯化钠。
3.离子键定义:__________________________________ _______________。4.离子键实质:_____________________________。5.离子化合物:____________________。例如:_________________________________________;通常:__________与______________形成离子化合物。
阴、阳离子间的静电作用
由离子键构成的化合物
KCl、MgCl2、CaCl2、ZnSO4、NaOH
带相反电荷离子之间的相互作用称为
●自主探究1.离子键形成的本质原因是什么?
2.离子键存在于哪些物质中?提示:离子化合物中一定存在离子键。离子键存在于大多数强碱、盐、金属氧化物等离子化合物中。例如:NaOH、NaCl、NaHCO3、NH4NO3、Na2O2、CaO等均属于离子化合物。但离子化合物中不一定只有离子键,还可能有其他的化学键。
●教材点拨1.NaCl的形成过程(1)金属钠与氯气反应的实验
实验步骤:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热,待钠熔化时,将盛有氯气的集气瓶倒扣在钠的上方,观察现象。给钠加热,待钠熔成小球时,立即扣上盛有Cl2的集气瓶。若加热时间过长或温度太高,钠会在空气中燃烧,生成Na2O2。
(2)氯化钠的形成氯化钠的形成过程也可通过下图简单表示:
2.离子键(1)离子键的定义带相反电荷离子之间的相互作用称为离子键。也可以理解为使阴、阳离子结合成化合物的静电作用,叫做离子键。
温馨提示:①成键微粒:阴离子、阳离子。②成键本质:静电作用。静电作用包括阴、阳离子间的静电吸引作用和电子与电子之间、原子核与原子核之间的静电排斥作用。③成键原因a.原子相互得失电子形成稳定的阴、阳离子。b.离子间吸引与排斥处于平衡状态。c.体系的总能量降低。④存在范围:离子键存在于大多数强碱、盐及金属氧化物中。
(2)离子键的形成条件和过程①形成条件:活泼的金属原子容易失去电子,成为金属阳离子;活泼的非金属原子容易得到电子,成为非金属阴离子。阴、阳离子通过静电作用形成离子键。所以,活泼的金属(如K、Na、Ca、Mg等)与活泼的非金属(如F2、Cl2、Br2、O2、S等)化合时,都能形成离子键。②形成过程:(3)证明某化合物一定存在离子键的方法是看在熔融状态下能否导电。
3.离子化合物(1)定义:由离子键构成的化合物叫做离子化合物。(2)构成微粒:阴离子、阳离子。(3)主要物理性质:熔、沸点较高,硬度较大。(4)导电性:固态时不导电,溶于水或受热熔化后导电。(5)溶解性:大多数离子化合物易溶于水,难溶于汽油、苯、四氯化碳等有机溶剂。(6)对应物质:大多数盐、强碱、活泼金属氧化物、过氧化物等。
(7)常见离子化合物的分类:①由活泼金属元素(ⅠA、ⅡA)和活泼非金属元素(ⅥA、ⅦA)之间形成的化合物。例如:NaCl、MgCl2、Na2O、Na2O2、CaO等。②由活泼金属离子与酸根(或酸式根)之间形成的化合物。例如:Na2SO4、K2CO3、NaHSO4、KHCO3等。③由铵根离子和活泼非金属离子之间形成的化合物。例如:NH4Cl。④由铵根离子和酸根(或酸式根)之间形成的化合物。例如:(NH4)2SO4、NH4HSO4等。
温馨提示:①只要含有离子键的化合物一定是离子化合物。例如:NaOH。②含有金属元素的化合物不一定是离子化合物。例如:AlCl3。③不含金属元素的化合物不一定不是离子化合物。例如:NH4Cl、(NH4)2SO4。
(2015·经典习题选萃)(双选)下列有关离子键的说法中正确的是( )A.离子键是由阴、阳离子通过静电作用达到平衡时形成的B.只有金属和非金属化合时才能形成离子键C.凡是含有离子键的化合物一定含有金属元素D.含有离子键的化合物一定是离子化合物
【解析】 离子键是指阴、阳离子通过静电作用形成的化学键,静电作用指的是静电吸引和静电排斥的平衡,选项A正确;NH4Cl中NH与Cl-间也存在离子键,选项B和C均不正确;离子化合物是指含有离子键的化合物,选项D正确。【答案】 AD
(2015·经典习题选萃)下列有关离子化合物的说法正确的是( )A.离子化合物一定易溶于水B.离子化合物由非金属元素和金属元素共同组成C.熔融状态下能够导电的物质,一定是离子化合物D.离子化合物在晶体状态下有离子存在,但不导电
【解析】 离子化合物不一定易溶于水,如AgCl、BaSO4等;离子化合物不一定由非金属元素和金属元素共同组成,如NH4Cl等铵盐全部由非金属元素组成;熔融状态能导电的物质,不一定是离子化合物,如金属单质;离子化合物由阴、阳离子构成,在晶体状态下,离子不能自由移动,故不能导电。【答案】 D
下列能形成离子键的是( )A.任意两种元素之间的化合B.两种非金属元素之间的化合C.任何金属元素与非金属元素之间的化合D.特别活泼金属元素与特别活泼非金属元素之间的化合【解析】 活泼金属元素与活泼非金属元素之间的化合能形成离子键,D正确。【答案】 D
下列说法正确的是( )A.离子键就是阴、阳离子间的静电引力B.所有金属元素与所有非金属元素间都能形成离子键C.NH4Cl属于离子化合物D.在离子化合物CaCl2中,两个氯离子间也存在离子键
●教材点拨1.定义:在元素符号周围用“·”或“×”表示原子的最外层电子的式子。2.电子式的书写方法及注意事项
温馨提示:用电子式表示离子化合物的形成过程,易出现下列错误:(1)离子漏标电荷数。(2)离子所带电荷数与元素化合价表示法分辨不清。(3)阴离子漏加括号。(4)把相同离子连在一起。(5)把“→”写成“===”等。
下列电子式中,书写正确的是( )
【解析】 【答案】 D【点拨】 电子式书写的几种常见错误:①漏写孤对电子;②原子(离子)结合顺序写错;③错误使用方括号;④误将电荷数标成化合价;⑤复杂阳离子与单核阳离子混淆不清等。
下列用电子式表示的化合物的形成过程正确的是( )【解析】 A中漏标离子电荷数,B中阴阳离子排法不对,Mg与F原子个数标错。D中用“===”代替―→。【答案】 C
下列电子式中正确的是( )【答案】 C
用电子式表示NaCl、CaCl2、Na2S的形成过程。NaCl___________________;CaCl2___________________;Na2S___________________。【答案】
1.(2015·经典习题选萃)下列关于离子键和离子化合物的说法正确的是( )A.阴、阳离子通过静电引力形成离子键B.阴、阳离子间通过离子键一定能形成离子化合物C.离子化合物一定能导电D.只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
【解析】 正确理解离子键和离子化合物的内涵和外延才能解答本题。A项,离子键是指阴、阳离子间的静电作用,包括引力和斥力二者的平衡;B项,离子键形成的只能是离子化合物;C项,离子化合物在熔融状态或水溶液里才能导电,D项NH与活泼非金属元素之间也可形成离子键。【答案】 B
2.下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )A.6和8 B.19和16C.12和17D.10和8【解析】 6号元素和8号元素形成的化合物是CO或CO2,不属于离子化合物,A项错误;19号元素和16号元素形成的离子化合物为K2S,不属于AB2型,B项错误;12号和17号元素形成的化合物是MgCl2,属于AB2型的离子化合物,C项正确;10号和8号元素不能形成化合物,D项错误。【答案】 C
3.下列化合物的电子式书写正确的是( )
解题时关键要弄清阳离子的电子式和离子符号相同(原子团除外),阴离子的电子式是在元素符号周围有8个电子(H-除外),用方括号把电子括住,右上角标明所带的负电荷数。阴、阳离子构成电子式时,正电荷总数等于负电荷总数。【答案】 D
4.(2015·安徽省郎溪县郎溪中学高一下学期月考)氯化钠是日常生活中人们常用的调味品。在下列事实中,可以证明NaCl中一定存在离子键的是( )A.水溶液能导电 B.易溶于水C.熔化时能导电D.有较高的熔点【解析】 证明物质存在离子键的方法是熔化时能导电,所以选C。【答案】 C
5.(2015·经典习题选萃)已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )A.A、B、D不可能在同周期B.D一定在第二周期C.A、D可能在同一主族D.C和D的单质可能化合为离子化合物【解析】 根据题目已知条件,可知B与E、D一定不在同一周期,故有A、B、D不可能在同一周期,A、D可能在同一主族,C和D的单质可能为离子化合物,D可能在第三周期。【答案】 B
化学键被破坏的几种情况(1)离子化合物①离子化合物的溶解过程:离子化合物溶解于水时,在水分子的作用下电离成为自由移动的阴、阳离子,离子键被破坏。②离子化合物的熔化过程:离子化合物在加热熔化时会发生电离,生成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程①有些共价化合物溶于水后,能与水发生反应,其分子内的共价键被破坏。如CO2、SO2、SO3等。②有些共价化合物属于电解质,溶于水后在水分子的作用下发生电离,形成阴、阳离子,其分子内的共价键被破坏。如HCl、H2SO4、CH3COOH等。③有些共价化合物溶于水后,既不与水反应,也不发生电离。其分子内的化学键不能被破坏。如酒精(C2H5OH)、蔗糖(C12H22O11)等。
人教版 (新课标)必修2第四章 化学与自然资源的开发利用第一节 开发利用金属矿物和海水资源教案配套课件ppt: 这是一份人教版 (新课标)必修2第四章 化学与自然资源的开发利用第一节 开发利用金属矿物和海水资源教案配套课件ppt,共60页。PPT课件主要包含了第四章,海水的淡化,盐分离,蒸馏法,离子交换法,电渗析法,无机物,有机物,工业原料,潮汐能等内容,欢迎下载使用。
化学第四章 化学与自然资源的开发利用第一节 开发利用金属矿物和海水资源图片ppt课件: 这是一份化学第四章 化学与自然资源的开发利用第一节 开发利用金属矿物和海水资源图片ppt课件,共60页。PPT课件主要包含了第四章,化合物,金属化合物,金属的冶炼,不活泼,非常活泼,利用率,使用量,回收和再利用,其他材料等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第一节 最简单的有机化合物--甲烷背景图ppt课件: 这是一份高中化学人教版 (新课标)必修2第一节 最简单的有机化合物--甲烷背景图ppt课件,共60页。PPT课件主要包含了有机化合物,第三章,淡蓝色,或原子团,无明显变化,油状液滴,少量白雾,麻醉剂,●典例透析,甲烷的结构和性质等内容,欢迎下载使用。













