




化学人教版 (新课标)第三节 化学键示范课课件ppt
展开1.了解离子键的概念。2.掌握离子键的形成过程和形成条件。3.能熟练地用电子式表示离子化合物的形成过程。
本课首先从元素周期表中出发,让学生回忆目前的元素种类,并指明目前的化合物种类,引导学生分析元素形成化合物时需要一种作用,进而引入“化学键”的概念;然后从Na与Cl2的实验入手,分析Na元素与Cl元素的形成过程,最终确定活泼金属与活泼非金属之间形成的化学键——“离子键”,并归纳形成“离子键”的微粒、条件及其存在。 在讲“电子式”时,注意从原子的“电子式”入手,结合稳定结构分析原子的得失电子情况,从而过渡到阴、阳离子的“电子式”,再根据“离子化合物”的构成微粒,确定“离子化合物”的“电子式”,注重对相同离子的处理。最后用“电子式”表示出“离子化合物”的形成过程。
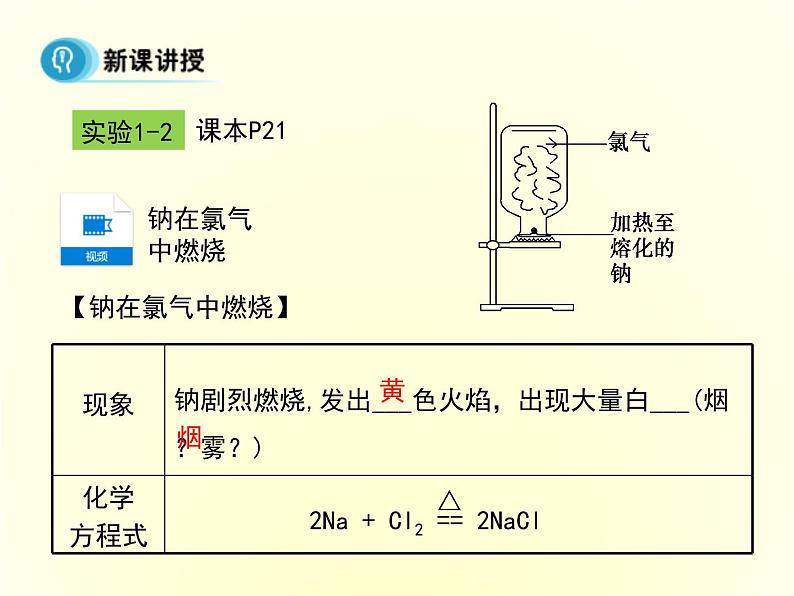
钠剧烈燃烧,发出___色火焰,出现大量白___(烟?雾?)
更稳定 能量低
静电引力(异性相吸如正负电荷相吸)
静电斥力(同性相斥如电子与电子,原子核与原子核)
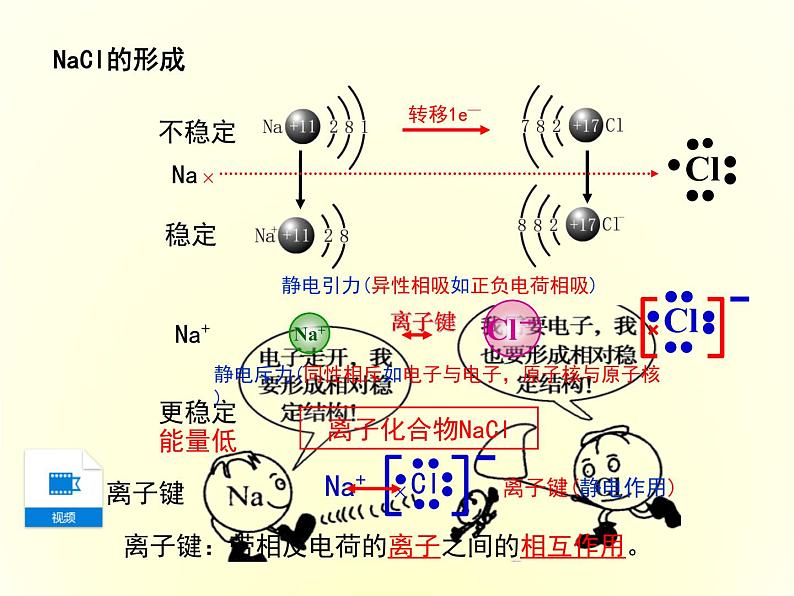
离子键:带相反电荷的离子之间的相互作用。
在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?
1.Na+离子和Cl-离子间的静电相互吸引作用。
3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。
带相反电荷的(阴阳)离子之间的相互作用称为离子键
活泼金属 + 活泼非金属
包括:正价原子团如:NH4+
包括:负价原子团如:OH-
注意:并非所有金属元素和非金属元素组成的都是离子键,如AlCl3等。
由离子键构成的化合物叫做离子化合物。
下列哪些物质中存在离子键?Na2O MgCl2 SO2 HClNa2O2 NaOH KNO3 NH4Cl
1.概念:在元素符号周围用·或×表示原子的____________的式子。
3.阳离子的电子式
(1)简单阳离子电子式就是离子符号
H+ Na+
(尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)
H Na Mg Al C N O F
5.离子化合物的电子式
把阴、阳离子的电子式写出并遵偱阴、阳离子交替的原则排布。
举例:NaCl MgCl2
练习:CaS Na2O
4.简单阴离子的电子式
在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。
举例:Cl- O2-
6.用电子式表示离子化合物形成过程
二、用电子式表示下列物质形成过程
一、写出下列物质的电子式1.NaBr 2.CaF2 3. CaO
1.下列说法正确的是( )A.离子键就是阴阳离子间的静电引力 B.所有金属元素与所有非金属元素间都能形成离子键 C.钠原子与氯原子结合成氯化钠后体系能量降低 D.离子化合物CaCl2中,两个氯离子间也存在离子键
3.下列性质中,可以证明某化合物内一定存在离子键的是( )A.溶于水B.熔点较高 C.水溶液能导电 D.熔融状态能导电
2.下列不是离子化合物的是( ) A.H2OB.Na2S C.KOHD.NH4NO3
4.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )A.10与19B.6与16 C.11与17 D.14与8
5.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( ) A.Na2O的电 子式: B.质量数为37的氯原子: C.Br-的电子式: D.Ar的结构示意图:
第一章 物质结构 元素周期律
第3节 化学键(课时2)
1. 知道共价键的概念和共价化合物的概念。2. 掌握共价键的形成条件条件。3. 能熟练地用电子式表示简单共价化合物的形成过程。
本课首先从复习离子键的形成出发,让学生回忆活泼金属与活泼非金属之间形成的化学键,然后提出问题:非金属元素与非金属元素之间能否形成“离子键”,然后用图示表示H原子与Cl原子形成化学键的过程,最后归纳总结“共价键”的微粒、条件、分类及其存在。 在讲共价化合物的表示形式时,要注意“电子式”和“结构式”的对应,引导学生分析原子的最外层电子数,进而结合8电子稳定结构判断所形成的共价键的数目,从而可快速写出“结构式”,再写出“电子式”的方法。在表示“共价键”的形成过程时,要注意与“离子键”的区别。然后通过分析,掌握“离子键”与“共价键”在物质中的存在情况。最后归纳总结“化学键”的概念、分类等知识。
⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
箭头左方相同的原子可以合并,箭头右方相同的微粒不可以合并。
H· 和 原子形成HCl过程中,能否形成离子键?为什么?
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
我只有一个电子,太少了
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
共价键:原子间通过共用电子对所形成的相互作用。
活泼金属 + 活泼非金属
1.共价键概念:原子间通过共用电子对所形成的相互作用。
非金属元素 + 非金属元素【不活泼金属元素】
判断下列物质中哪些仅含有共价键?
一定有离子键,可能有共价键
只有共价键的化合物,原子通过共用电子对形成分子的化合物
活金属元素 + 活非金属元素(除氯化铝)
非金属元素 + 非金属元素
(共价化合物只含共价键,熔融时不发生电离,故液态时不导电)
从元素种类角度判断,下列物质:属于离子化合物有___________;共价化合物有_________。①He ②H2③CaO ④CO2 ⑤CaF2 ⑥MgS⑦AlCl3 ⑧Na2SO4 ⑨HNO3 ⑩Mg(OH)2
有不同种非金属元素形成
(吸电子能力强的显负电性,吸电子能力弱的显正电性)
4. 用电子式表示共价化合物形成过程
5. 结构式 在化学上,常用一根短线表示一对共用电子对。
四、化学键 1. 概念:使_____相结合或______相结合的作用力。
注意:稀有气体是单原子分子,
所以稀有气体中不存在化学键。
3. 从化学键角度理解化学反应:
①若只有化学键的断裂或只有化学键的形成一定是化学反应吗?
②所以必须__________________________才是化学反应。
既有旧键断裂,又有新键形成
反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。
1.下列叙述正确的是( )A.离子化合物可能含有共价键B.常温下的气体分子中一定含有共价键C.共价化合物中可能含有离子键 D.单质分子中不存在化学键
2.下列分子的电子式书写正确的是( )A.氨 B.四氯化碳 C.氮 气 D.二氧化碳
3.下表物质所含化学键类型、所属化合物类型完全正确的一组是( )
2020-2021学年第二节 资源综合利用,环境保护备课ppt课件: 这是一份2020-2021学年第二节 资源综合利用,环境保护备课ppt课件,共60页。PPT课件主要包含了第四章,有机物,无机物,碳元素,氧氮硫,2煤的综合利用,煤的焦化,焦炉气,煤焦油,可燃性气体等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt: 这是一份高中化学人教版 (新课标)必修2第三章 有机化合物综合与测试复习课件ppt,共56页。PPT课件主要包含了有机化合物,第三章,章末复习提升,●典例透析,答案A,有机物的空间构型,除杂和检验方法等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第三章 有机化合物第四节 基本营养物质教学演示ppt课件: 这是一份高中化学人教版 (新课标)必修2第三章 有机化合物第四节 基本营养物质教学演示ppt课件,共60页。PPT课件主要包含了有机化合物,第三章,第四节基本营养物质,油脂蛋白质,无机盐和水,葡萄糖,C6H12O6,麦芽糖,C12H22O11,纤维素等内容,欢迎下载使用。













