





化学单元综合与测试课文配套ppt课件
展开一、选择题(每小题3分,共42分)1.(独家原创试题)下表列出了一些常见食物在常温下的 pH 范围,其中酸性 最强的是 ( )
A.鸡蛋清 B.牛奶 C.葡萄汁 D.苹果汁
答案 D pH小于7时,液体呈酸性,且pH越小,酸性越强,所以四种食物中 酸性最强的是苹果汁。
2.(2019江苏常州中考)下列物质长期放置在空气中,溶液质量因发生化学 变化而减小的是 ( )A.NaCl溶液 B.NaOH溶液C.浓盐酸 D.石灰水
答案 D 氯化钠溶液长期放置在空气中质量基本不变;NaOH溶液长期 放置在空气中能与二氧化碳发生反应生成碳酸钠和水,变质且质量增加;浓 盐酸易挥发,长期放置在空气中溶液质量减小,但未发生化学变化;石灰水 会与空气中的二氧化碳发生反应生成碳酸钙沉淀,使溶液质量减小。
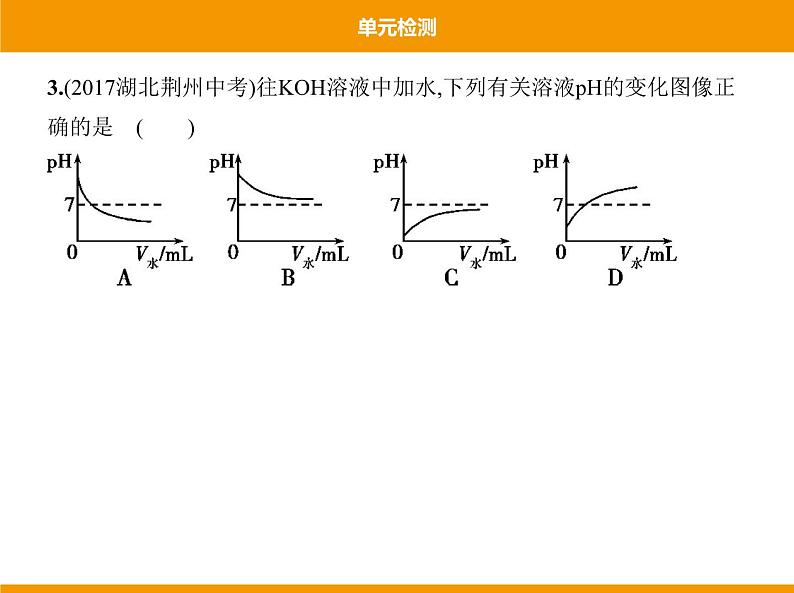
3.(2017湖北荆州中考)往KOH溶液中加水,下列有关溶液pH的变化图像正 确的是 ( )
答案 B 加水稀释氢氧化钾溶液,溶液的碱性减弱,因此pH减小,但是不 会小于或等于7,故选B。
4.(独家原创试题)通过简单的实验装置和操作,探究物质的某些性质是化 学学习的常用方法。用如图10-5-1所示装置进行实验,将装置倾斜,使管 ①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符 合该实验现象的是 ( ) 图10-5-1A.硝酸铵和水 B.大理石和稀盐酸C.二氧化锰和过氧化氢溶液 D.浓硫酸和水
答案 D 硝酸铵溶于水吸热,装置内气体温度降低,气球会变瘪;大理石和 稀盐酸反应生成二氧化碳气体,会观察到气球鼓起,但一段时间后,气球不 会恢复原状;过氧化氢在二氧化锰的催化作用下生成水和氧气,会观察到气 球鼓起,但一段时间后,气球不会恢复原状;浓硫酸溶于水放出大量的热,装 置内空气受热膨胀,会观察到气球鼓起,一段时间后,装置内温度恢复至常 温,气球又恢复原状。
5.下列氧化物中,通常情况下既不与酸反应,又不与碱反应的是 ( )A.CO2 B.CO C.CaO D.CuO
答案 B CO2可以与碱反应,CaO和CuO可以与酸反应。
6.(2019福建龙岩模拟)古罗马贵族阶层发现一种金属器皿,用其盛葡萄酒 可除掉酒中的酸而使酒味纯正。已知,除酸过程中酸与金属间发生了置换 反应。下列有关推断肯定错误的是 ( )A.葡萄酒的pH<7B.葡萄酒属于混合物C.除酸过程的反应产物之一为H2D.该金属比铜更不活泼
答案 D 葡萄酒中含有酸性物质,故葡萄酒的pH<7,A说法正确;葡萄酒中 含有酒精、水、酸等,属于混合物,B说法正确;除酸过程中酸与金属间发生 了置换反应,反应会生成H2,C说法正确;除酸过程中酸与金属间发生了置换 反应,说明该金属在金属活动性顺序中排在氢的前面,则该金属比铜活泼,D 说法错误。
7.(2017广西贵港中考)一些食物pH的近似值范围如下:橘子汁3.0~4.0;泡菜 3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0。下列说法中,不正确的是 ( )A.鸡蛋清显碱性B.胃酸过多的人应少吃泡菜C.橘子汁能使紫色石蕊溶液变红D.牛奶比橘子汁的酸性强
答案 D 鸡蛋清的pH为7.6~8.0,呈弱碱性,故A正确;泡菜的pH为3.2~3.6, 呈酸性,胃酸过多的人不宜多吃,故B正确;橘子汁呈酸性,石蕊溶液在酸性 溶液中变红,故C正确;牛奶和橘子汁的pH都小于7,均显酸性,牛奶的pH比 橘子汁的pH大,酸性比橘子汁弱,故D错误。
8.(2017山东临沂中考)类推是化学学习中常用的思维方法。下列类推正确 的是 ( )A.活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单 质D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶 液
答案 D 碳酸盐与酸反应也会生成气体,故A错误;生成盐和水的反应不 一定是中和反应,如二氧化碳和氢氧化钙反应生成碳酸钙和水,故B错误;由 同种元素组成的物质可能是单质,也可能是混合物,故C错误;碱性溶液能使 酚酞溶液变红,能使酚酞溶液变红的溶液一定显碱性,故D正确。
9.(2019山东临沂中考)人体内一些液体的正常pH范围如下:
下列说法中不正确的是 ( )A.胆汁和胰液显碱性B.胃液比唾液酸性弱C.胰液比胆汁碱性强D.服用含氢氧化铝[Al(OH)3]的药物可以治疗胃酸过多症
答案 B 胆汁和胰液的pH均大于7,显碱性;pH<7时,pH越小,酸性越强,所 以胃液酸性比唾液强;pH>7时,pH越大,碱性越强,所以胰液碱性比胆汁强; 氢氧化铝可以和胃液中的酸发生反应,减弱酸性。
10.(2018云南曲靖二模)下列实验现象的描述正确的是( )A.向氢氧化钠溶液中滴入紫色石蕊溶液,溶液由无色变为红色B.少量铁锈在足量稀盐酸里浸泡一段时间后,铁锈消失,溶液由无色变为浅 绿色C.硫在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体D.把铜片放入稀硫酸中,铜片表面有气泡产生,溶液由无色变为蓝色
答案 C 氢氧化钠溶液显碱性,向氢氧化钠溶液中滴入紫色石蕊溶液,溶 液由无色变为蓝色;少量铁锈在足量稀盐酸里浸泡一段时间后,铁锈消失, 溶液由无色变为黄色;硫在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺 激性气味的气体;铜不能和稀硫酸反应,把铜片放入稀硫酸中,无明显现 象。
11.如图10-5-2是稀盐酸和氢氧化钠溶液反应的pH变化曲线,据图分析能得 出的正确结论是 ( ) 图10-5-2A.该反应是将氢氧化钠溶液滴入稀盐酸中B.a g是指加入氢氧化钠溶液的质量C.A点时,溶液的溶质为氢氧化钠、氯化钠D.B点时氢氧化钠溶液和加入的稀盐酸质量一定相同
答案 C pH开始时大于7,逐渐减小到小于7,可知原溶液显碱性,说明是 把稀盐酸滴加到氢氧化钠溶液中;a g是指加入稀盐酸的质量;A点时溶液的 pH大于7,显碱性,氢氧化钠有剩余,溶液的溶质为氢氧化钠、氯化钠;B点时 溶液的pH等于7,显中性,由于氢氧化钠溶液与稀盐酸的溶质质量分数不确 定,则氢氧化钠溶液和加入的稀盐酸的质量也无法确定。
12.(2017浙江宁波中考)有A、B两种酸碱指示剂,它们显示的颜色与溶液 pH的关系如图10-5-3所示,它们在甲溶液和乙溶液中显示的颜色如下表。 下列判断错误的是( ) 图10-5-3
A.甲溶液呈酸性B.乙溶液的pH可能为11C.只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体D.在滴有A指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色
答案 D A项,由表格中信息可知,甲溶液能使A指示剂变为黄色,故甲溶 液呈酸性,正确;B项,乙溶液能使B指示剂变为粉红色,说明乙的pH在10~14 之间,正确;C项,甲溶液呈酸性,乙溶液呈碱性,蒸馏水呈中性,它们能使A指 示剂显示不同的颜色,故能用A指示剂鉴别,正确;D项,在滴有A指示剂的甲 溶液中不断地加入乙溶液,当乙溶液过量时,溶液可能呈蓝色,错误。
13.探究小组利用如图10-5-4所示装置进行四组实验,胶头滴管中盛装的是 液体,烧瓶中盛装的是气体、固体或液体,挤压胶头滴管滴加几滴液体,能 观察到气球变大的实验组合是 ( )
答案 C 要使气球变大,必须使烧瓶内压强减小。NaOH能与二氧化碳气 体反应,从而使烧瓶内压强减小。
14.(2019安徽滁州凤阳一模)化学兴趣小组同学进行氢氧化钠与盐酸的反 应,并利用温度传感器和pH传感器得出如图10-5-5所示图像,下列对于图像 分析正确的是( )图10-5-5A.该实验是将氢氧化钠溶液滴入盐酸中B.约70秒时恰好完全反应C.温度的变化能够直接证明二者发生了化学变化
D.中和反应放热,所以放热的反应一定是中和反应
答案 B 由图像可知,pH开始时大于7,逐渐减小到小于7,可知原溶液显 碱性,然后不断地加入酸性溶液,使pH减小,说明是把盐酸滴加到氢氧化钠 溶液中,A说法错误。恰好完全反应时pH等于7,pH等于7时对应的时间约 是70 s,B说法正确。只凭温度的变化不能直接证明二者发生化学变化,C说 法错误。中和反应放热,但放热的反应不一定是中和反应,如氧化钙与水的 反应,D说法错误。
15.(2017吉林长春一模)(8分)将稀盐酸滴入如图10-5-6所示的盛有不同物 质的试管中: 图10-5-6(1)不发生反应的是 (填序号)。(2)冒气泡的是 (填序号),写出其中发生置换反应的化学方程式: 。(3)D中现象是 。(4)红色消失的是 (填序号),写出反应的化学方程式:
二、填空题(共36分)
。
答案 (1)A(2)BC Fe+2HCl FeCl2+H2↑(3)黑色固体消失,溶液变为蓝色(4)E NaOH+HCl NaCl+H2O
解析 (1)铜与稀盐酸不反应,铁、碳酸钙、氧化铜以及氢氧化钠都能与稀 盐酸反应。(2)铁和稀盐酸反应生成氯化亚铁和氢气,碳酸钙与稀盐酸反应 生成二氧化碳气体,均能观察到有气泡冒出,其中铁与稀盐酸的反应属于置 换反应。(3)稀盐酸和氧化铜反应生成氯化铜和水,溶液变为蓝色。(4)稀 盐酸和氢氧化钠反应生成氯化钠和水。
16.(2019河南中考)(4分)图10-5-7是氢氧化钠与盐酸反应示意图。 图10-5-7(1)反应前后没有发生变化的离子有哪些?(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写 出氢氧化钠与盐酸反应的离子方程式。
答案 (1)钠离子和氯离子 (2)H++OH- H2O
解析 (1)由氢氧化钠与盐酸反应的示意图可知,反应前后没有发生变化的 离子是钠离子和氯离子。(2)氢氧化钠与盐酸反应生成氯化钠和水,实际参 加反应的离子是氢氧根离子和氢离子,两者反应生成水分子,反应的离子方 程式为H++OH- H2O。
17.(6分)小明同学对研究物质的酸碱性产生了浓厚的兴趣,他使用pH试纸 测得家中某些物质的近似pH如下表:
小明将自制的紫菜汁液滴入上述7种物质中,发现紫菜汁液与紫色石蕊溶 液的变化相似,将紫菜汁液滴入肥皂液中,液体变成绿色。(1)若将紫菜汁液滴入护发素中,你认为液体 (填“不变色”“变成 红色”或“变成绿色”)。(2)通过研究,小明同学懂得了洗发时先用洗发水再用护发素的科学道理。 查阅资料:人体胃液pH在0.5~1.5之间,小明同学懂得了胃酸过多的病人不 能空腹食用上述物质中的 。
(3)要洗去学校餐厅地面上的油垢,小明同学准备从家中选择带下列两种物 质中的 (填“a”或“b”)。a.洁厕灵 b.厨房清洁剂
答案 (1)变成红色 (2)苹果汁 (3)b
解析 (2)胃酸过多的病人不能空腹食用酸性较强的食物,故不能食用苹果 汁。(3)厨房清洁剂呈碱性,能除去油污,故要洗去学校餐厅地面上的油垢, 应选择厨房清洁剂。
18.(2019江苏常州中考)(8分)中和反应是一类重要的化学反应。某同学利 用图10-5-8装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH计和温度 传感器测量反应过程中相关物理量的变化情况,得到图10-5-9和图10-5-1 0。
(1)烧杯中发生反应的化学方程式为 ;(2)仪器A中溶液的溶质是 (填化学式);(3)图10-5-10中V的数值最接近 (填“6”“12”或“16”);(4)下列说法错误的是 。A.图10-5-9中b点所示溶液中的溶质是NaCl和NaOHB.取图10-5-9中d点所示溶液加热蒸干所得固体为纯净物C.图10-5-9中c→d所示溶液中NaCl的质量不断增加D.图10-5-10中e→f变化趋势可说明该反应是放热反应
答案 (1)NaOH+HCl NaCl+H2O (2)HCl (3)12 (4)C
解析 (1)氢氧化钠和盐酸反应生成氯化钠和水。(2)仪器A中是盐酸,溶质 是HCl。(3)根据pH和温度的变化曲线可知,该反应是放热反应,当二者恰 好完全反应时,溶液的温度最高,所以V的数值最接近12。(4)在pH的变化曲 线图中,b点所示溶液pH>7,溶液呈碱性,溶液中的溶质是NaCl和NaOH,故A 正确;d点所示溶液pH<7,溶液呈酸性,溶质是NaCl和HCl,氯化氢在蒸发过 程中挥发了,所得固体中只有NaCl,为纯净物,故B正确;c点时盐酸和氢氧化 钠恰好完全反应,c→d所示溶液中,氯化钠的质量不会增加,故C错误;温度 的变化曲线图中,e→f变化趋势可说明该反应是放热反应,故D正确。
19.(10分)A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质, E为非金属单质,图10-5-11是它们之间的相互转化关系。请回答:(已知:CuO+H2SO4 CuSO4+H2O) 图10-5-11(1)反应①的基本反应类型是 ,其反应的化学方程式为 。
(2)C的化学式为 。(3)写出物质E和B在加热条件下反应的化学方程式: 。(4)图10-5-11所示转化中产生无色气体E的原因是 。
答案 (1)化合反应 2Cu+O2 2CuO (2)Fe(3)H2+CuO Cu+H2O(4)X溶液中含有硫酸,其与铁发生反应生成了氢气
解析 (1)经分析,反应①为铜与氧气在加热条件下生成氧化铜的反应,故 为化合反应。(2)由于X溶液中有硫酸铜和硫酸,而生成物中D为浅绿色溶 液,说明D中含Fe2+,因此C为金属铁。(3)经判断,E应为铁与X溶液中的硫酸 反应生成的氢气,而B为CuO,因此物质E和B反应的化学方程式为H2+CuO Cu+H2O。(4)通过上面的分析可知,产生无色气体E的原因是X溶液中含有的硫酸与铁发生反应生成了氢气。
20.(2019湖南湘西中考)(12分)某化学兴趣小组在进行酸碱中和反应的实 验探究时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记添加酸 碱指示剂。某同学从烧杯中取少量反应后的溶液于一支试管中,并向试管 中滴加了几滴无色酚酞溶液,振荡,观察到试管中溶液不变色。于是针对此 溶液的成分,同学们进行了科学探究。(1)猜想与假设:猜想一:反应后氢氧化钠过量,溶液呈碱性;猜想二:氢氧化钠与盐酸恰好完全中和,溶液呈中性;猜想三: 。同学们经过讨论后觉得猜想一不正确,其理由是: 。
三、实验探究题(共12分)
①化学兴趣小组的同学为了验证自己的猜想,设计了实验方案一:
②请你设计另一个实验方案(与实验方案一不同),验证猜想三成立,并填写 下表:
(2)设计并进行实验:
答案 (1)反应后稀盐酸过量,溶液呈酸性 若有氢氧化钠,溶液为碱性,滴 入酚酞,溶液会变红 (2)<
解析 (1)氢氧化钠和稀盐酸反应生成氯化钠与水,反应后的溶液中一定有 氯化钠,可能还有氢氧化钠或者氯化氢中的一种。若氢氧化钠过量,则溶液 为碱性,滴加酚酞,溶液会变为红色,所以猜想一不正确。(2)①若猜想三正 确,则溶液的pH<7。②为了证明盐酸过量,只需要证明溶液为酸性即可,因 此可以加入活泼金属看是否生成气体、加入石蕊看颜色的改变或加入氧 化铁等金属氧化物看反应现象等。
21.(2019湖南怀化中考)(10分)取NaOH和NaCl的混合物3.63 g放入烧杯中, 加水溶解配制成70 g溶液。向该溶液滴加溶质质量分数为7.3%的稀盐酸, 测得溶液pH与滴入稀盐酸的质量关系如图10-5-12所示。 图10-5-12(1)当滴入稀盐酸的质量为11.2 g时,溶液的pH 7(填“>”“<”或 “=”);此时溶液中的溶质是 (填化学式)。
四、计算题(共10分)
(2)当pH=7时,计算该溶液中溶质的质量分数。(写出计算过程)
答案 (1)< NaCl、HCl(2)10 g 7.3%的稀盐酸中溶质的质量为10 g×7.3%=0.73 g,设当pH=7时,反应 生成的NaCl质量为x,参加反应的氢氧化钠质量为yNaOH+HCl H2O+NaCl40 36.5 58.5y 0.73 g x = x=1.17 g = y=0.8 g所得溶液中溶质的质量分数为 ×100%=5%答:所得溶液中溶质的质量分数为5%。
2021学年课题1 常见的酸和碱课堂教学ppt课件: 这是一份2021学年课题1 常见的酸和碱课堂教学ppt课件
初中化学人教版九年级下册第十单元 酸和碱综合与测试教课内容课件ppt: 这是一份初中化学人教版九年级下册第十单元 酸和碱综合与测试教课内容课件ppt,共25页。PPT课件主要包含了HCl,H2SO4,H2CO3,CH3COOH,NaOH,CaOH2,KOH,NH3H2O,浓硫酸,玻璃棒等内容,欢迎下载使用。
人教版九年级下册课题2 酸和碱的中和反应图文课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应图文课件ppt,共27页。PPT课件主要包含了提出问题,设计实验,收集证据,无明显现象,得出结论,没有结论,溶液变红色,NaOH溶液显碱性,溶液由红色变成无色,溶液碱性逐渐消失等内容,欢迎下载使用。














