



人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量第一节 化学反应与能量变化多媒体教学ppt课件
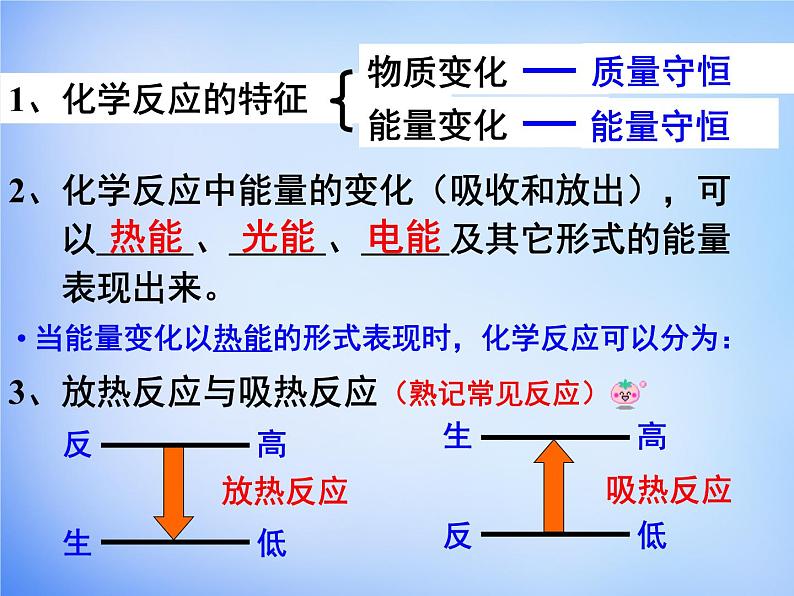
展开2、化学反应中能量的变化(吸收和放出),可 以 、 、 及其它形式的能量 表现出来。
当能量变化以热能的形式表现时,化学反应可以分为:
3、放热反应与吸热反应
反 高
生 低
生 高
反 低
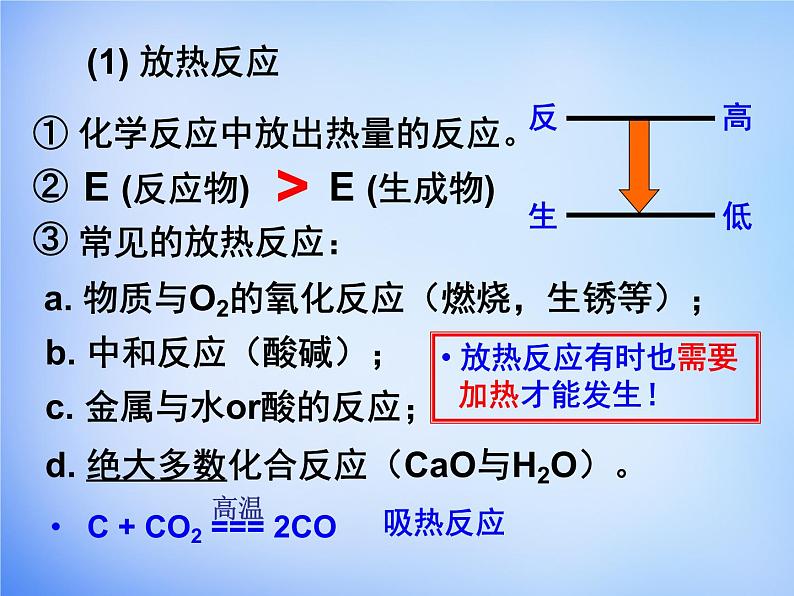
① 化学反应中放出热量的反应。②③
E (反应物) E (生成物)
a. 物质与O2的氧化反应(燃烧,生锈等);
b. 中和反应(酸碱);
c. 金属与水r酸的反应;
d. 绝大多数化合反应(CaO与H2O)。
C + CO2 === 2CO
放热反应有时也需要 加热才能发生!
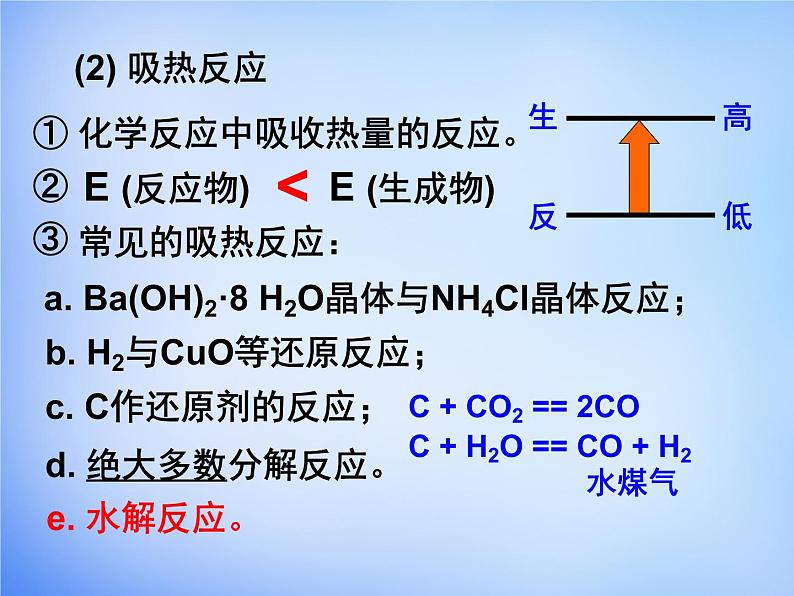
① 化学反应中吸收热量的反应。②③
a. Ba(OH)2·8 H2O晶体与NH4Cl晶体反应;
b. H2与CuO等还原反应;
c. C作还原剂的反应;
d. 绝大多数分解反应。
C + CO2 == 2CO
C + H2O == CO + H2
化学反应中所吸收或放出的热量。
恒温恒压下,反应热称“焓变”。
kJ/ml 或 kJ • ml–1
注:单位中的每ml是与整个反应对应的,即反应热表示每ml反应放出或吸收的热量。
放热反应 (体系能量降低):
吸热反应 (体系能量升高):
所谓体系是指被研究的物质系统;而体系以外的其他部分就称为环境
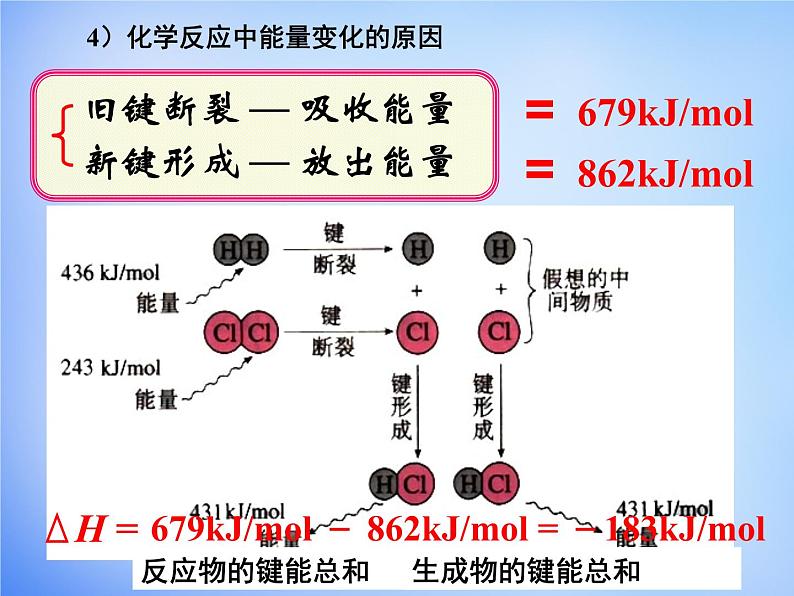
4)化学反应中能量变化的原因
旧键断裂 — 吸收能量
新键形成 — 放出能量
679kJ/ml - 862kJ/ml = -183kJ/ml
5)焓变与键能的关系(微观)
例 1:1ml C与 1ml H2O(g) 反应生成 lml CO(g) 和1ml H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/ml。
例 2:拆开 1ml H-H键、1ml N-H键、1ml N≡N键分别需要的能量是436kJ、391kJ、946kJ,则1ml N2生成NH3的反应热为 ,则1ml H2生成NH3的反应热为 。
-30.67 kJ/ml
相当于 1/3 ml N2
6)焓变与物质能量的关系(宏观)
任何一个化学反应都包括物质的变化和能量的变化。那么,有什么表达式能把这两种变化都表示出来?
【例1】 在200℃、101kPa时,1 ml H2与碘蒸气作用生成HI的反应,科学文献上表示为:
能表示参加反应物质的量和反应热的 关系的化学方程式。
表示1ml气态H2与1ml气态碘完全反应,生成2ml气态HI时,放出14.9kJ的热量。
③ 2H2 (g) + O2(g) = 2H2O(l); △H= – 571.6 kJ/ml
④ 2H2O(l) = 2H2 (g) + O2(g) ; △H= + 571.6 kJ/ml
⑴ 一般应注明反应的温度、压强;
△H与实验的条件、物质的状态有关!
(250C ,101kPa时不注明)
⑵ 一定标明各物质的状态(s、l、g、aq) ;
△H= + 44 kJ/ml
⑶ ΔH只放右边,以空格与标有物质状态的化学方程式隔开(数值及单位) 放热: ΔH < 0; 吸热: ΔH > 0;
⑷ 系数仅仅表示物质的量,不表示分子或原子个数; 故系数可以是整数、分数、小数;
⑸ΔH的值与系数相匹配。
系数加倍,ΔH值也加倍。
正逆反应的ΔH绝对值相等,符号相反。
⑹ 反应物完全变成生成物,所释放或吸收的热量。
⑺ 热化学方程式一般不要写反应条件。
例1:当1ml气态H2与1ml气态Cl2反应生成2ml气态HCl,放出184.6kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) = 2HCl(g) ∆H =-184.6 kJ/ml
2H2(g) + 2Cl2(g) = 4HCl(g) ∆H =-369.2 kJ/ml
例2:1ml N2(g) 与适量O2(g) 反应生成NO2 (g), 需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g) ∆H = + 68 kJ/ml
例3、沼气的主要成分是甲烷。0.5 ml CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l ) ΔH = + 890 kJ/ml
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/ml
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = – 890 kJ/ml
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = – 890 kJ/ml
ΔH = – 445 kJ/ml
小结:化学方程式与热化学方程式的比较
三、中和反应反应热的测定
测定强酸与强碱反应的反应热,体验化学反应的热效应。
大烧杯(500ml)、小烧杯(100ml)、温度计、量筒(50ml) 两个﹑ 泡沫塑料或纸条﹑泡沫塑料板或硬纸板(中心有两个小孔)﹑ 环形玻璃搅拌棒
中和热:在稀溶液中,酸与碱发生中和反应生成1ml水所产生的反应热
1.保温。在大烧杯底部垫泡沫塑料,使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如图所示。
答案:两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
思考1:大、小烧杯放置时,为何要使两杯口相平?填碎泡沫塑料(或碎纸条)的作用是什么?对此装置,你有何更好的建议?
思考2:为什么不用环形铁搅拌棒?
铁与盐酸之间会发生反应,另外铁的导热性好,这样都会造成热量的损失。
2.用一个量筒最取50 mL 0.50 ml/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
思考3:温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
答:因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使溶液的总质量增加,而导致实验结果误差。
3.用另一个量筒量取50 mL 0.55 ml/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
思考4:实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?
答:为了保证0.50 ml/L的盐酸完全被NaOH中和,采用0.55 ml/L NaOH溶液,使碱稍稍过量。
思考5:酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
答:因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
5.重复实验两到三次,取测量所得数据的平均值作为计算依据。
1、取三次测量所得数据的平均值作为计算依据
如果某一次实验的数据与另外两次实验的数据差异明显,怎么办?
2.计算反应热50mL0.50 ml/L的盐酸的质量m1=50g50mL0.55 ml/L的氢氧化钠溶液的质量m2=50g中和后生成的溶液的比热容c=4.18J/(g·℃)
Q=(m1+ m2 )c (t2-t1) =0.418(t2-t1)kJ
生成1mlH2O时放出的热量为:
参考值:-57.3kJ/ml
人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt,共36页。PPT课件主要包含了能量变化,问题探究一,放热反应,吸热反应,∆H=,问题探究二,化学键的断裂和形成,我们可以发现,练习与巩固,中和热的测定等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量第一节 化学反应与能量变化课文配套课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量第一节 化学反应与能量变化课文配套课件ppt,共15页。PPT课件主要包含了热化学方程式,℃101kPa,物质变化,能量变化,Q1﹥Q2,△H1<△H2等内容,欢迎下载使用。
化学选修4 化学反应原理第一节 化学反应与能量变化评课课件ppt: 这是一份化学选修4 化学反应原理第一节 化学反应与能量变化评课课件ppt,共37页。PPT课件主要包含了反应热,键能恒取正值,反应热焓变,从反应热角度看,从键能角度看,∆H=,热化学方程式,什么是热化学方程式,思考交流,每mol反应的焓变等内容,欢迎下载使用。













