




化学选修4 化学反应原理第一节 化学反应与能量变化示范课ppt课件
展开化学反应有新物质生成,伴有能量变化,常表现为热量变化(还有光能、电能等)。
1.常见的放热反应和吸热反应
讨论:决定一个化学反应是放热反应还是吸热反应是由条件(如加热)决定吗?请举例说明。
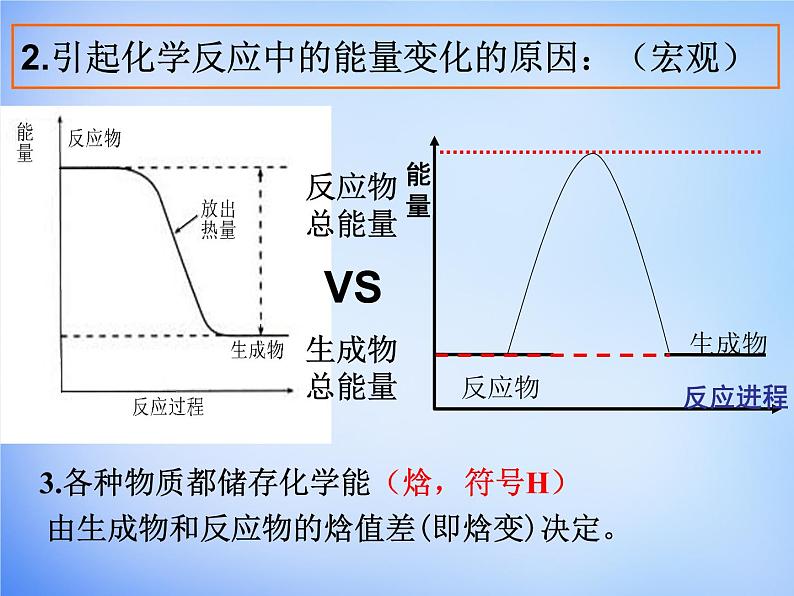
反应物的总能量与生成物的总能量的相对大小
2.引起化学反应中的能量变化的原因:(宏观)
由生成物和反应物的焓值差(即焓变)决定。
3.各种物质都储存化学能(焓,符号H)
(1)化学反应过程中所释放或吸收的热量,叫做反应热。恒压条件下,反应热等于焓变。
(2)符号:△H 单位:kJ/ml
注:单位中的每ml是与整个反应对应的,即反应热表示每ml反应放出或吸收的热量。
练习:已知在101kPa时石墨比金刚石稳定。1ml石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断1ml的石墨与1ml的金刚石所具有的总能量的大小关系如何?
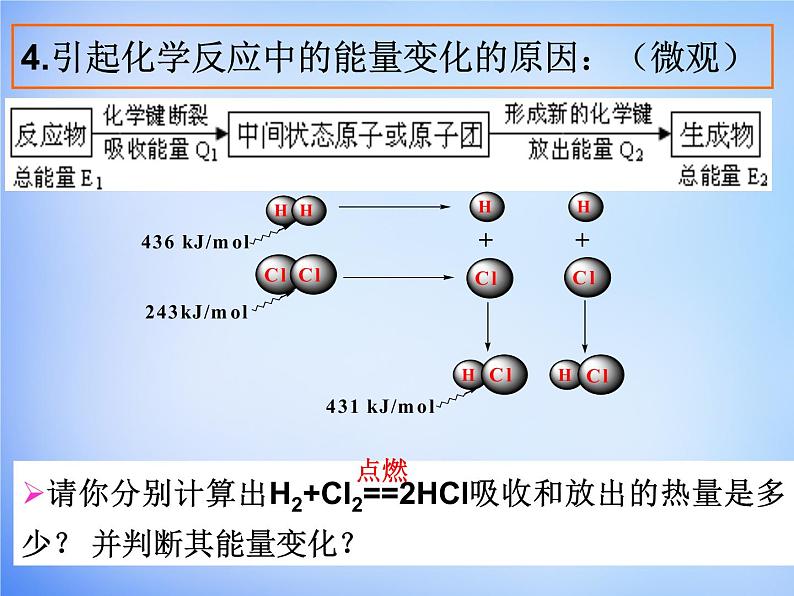
4.引起化学反应中的能量变化的原因:(微观)
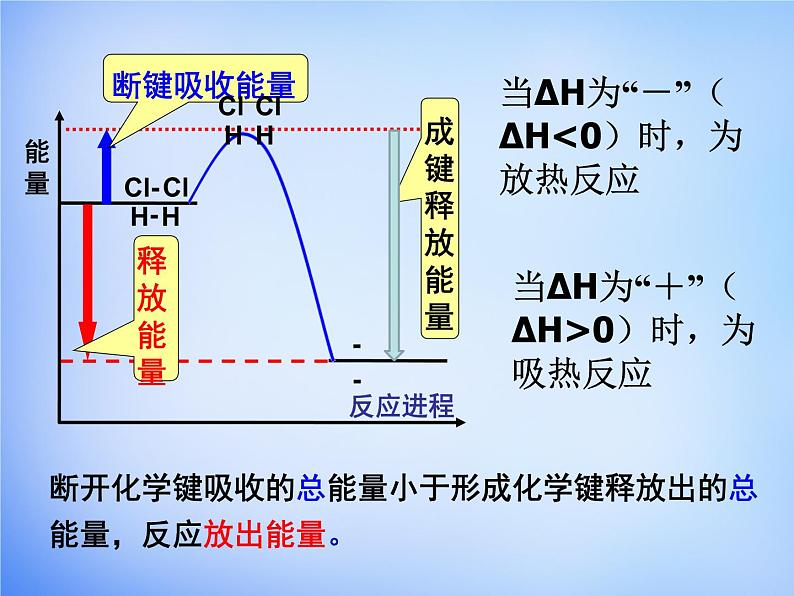
断开化学键吸收的总能量小于形成化学键释放出的总能量,反应放出能量。
当∆H为“-”( ∆H<0)时,为放热反应
当∆H为“+”( ∆H>0)时,为吸热反应
思考一:1mlH2 与 1mlCl2 反应生成2mlHCl 释放出 184.6kJ 的热量,则该反应的△H1= ;
思考二:已知拆开1ml H2中的化学键要吸收436 kJ的 能量,拆开1ml O2中的化学键要吸收496 kJ的能量,形成水分子中的1ml H—O键要放出463 kJ的能量,试说明2H2O === 2H2 + O2 中的能量变化。
1.已知反应A+B=C+D为放热反应,对该反应 的下列说法中正确的是( ) A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定能发生
影响焓因素:物质本身性质和状态
⑴ 1gH2O(l)变成水蒸气需要升温还是降温? ⑵液态水变成水蒸气需要吸热还是放热? ⑶1g 液态H2O 和1g 气态H2O 所具有的能量是否相同? 哪个大?
已知 (1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/ml(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/ml(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/ml(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/ml则a、b、c、d的关系正确的是 。A、a
4.氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1mlH-H键消耗的能量为Q1kJ, 破坏1mlO = O键消耗的能量为Q2kJ, 形成1mlH-O键释放的能量为Q3kJ。 下列关系式中正确的是( ) A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3 C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3
引起化学反应中的能量变化的原因:
(1)宏观:在化学反应中,反应物的总能量与生成物的总能量的相对大小。(2)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
《国际热疗学报》、《微创治疗》杂志首次报道了中科院理化技术研究所科研人员利用碱金属实现肿瘤高温消融治疗的新方法。
※ 需要一种能体现碱金属的用量与放 出热量关系的表达式
与化学方程式相比,新化学方程式有哪些不同?
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/ml
◆ 方程式包含物质变化和能量变化两个部分。
◆ 注明反应的温度和压强。
◆ 物质后标注物质状态。
◆ 化学计量数可为整数或分数。
热化学方程式中的物质变化和反应热之间的关系
热化学方程式需注明反应时的温度和压强。 对于 25℃、101kPa时进行的反应可不注明。
△H=-44.0kJ/ml
热化学方程式需注明物质状态 固态-------------s 液态-------------l 气态------------g 稀溶液---------aq
热化学方程式中各物质化学式前面的化学计量数仅表示物质的量,并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。
∆H单位中ml 的含义
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/ml
当参加反应的物质的化学计量数增大一倍时,反应热也增大一倍
表示参加反应物质的量和反应热的关系的化学方程式————热化学方程式。
※只要写出反应原理的热化学方程式就可以 控制反应物的量;
热化学方程式书写注意事项
1、化学方程的右边必须写上△H,并用“空格” 隔开, △H:吸热用“+”,放热用:“-”, 单位是kJ/ml或J/ml
2、需注明反应的温度和压强,如不注明条件, 即指: 25℃ 1.01×105Pa;
3、物质后需标状态(s、l、g、aq)
4、化学计量数可以是整数也可以是分数,与 △H成比例
1、当1ml气态H2与1ml气态Cl2反应生成2ml气态HCl,放出184.6KJ的热量, 请写出该反应的热化学方程式。
H2(g)+Cl2(g)=2HCl(g) ∆H =-184.6KJ/ml
人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt: 这是一份人教版 (2019)选择性必修1第一节 反应热课堂教学课件ppt,共36页。PPT课件主要包含了能量变化,问题探究一,放热反应,吸热反应,∆H=,问题探究二,化学键的断裂和形成,我们可以发现,练习与巩固,中和热的测定等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量第一节 化学反应与能量变化课文配套课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量第一节 化学反应与能量变化课文配套课件ppt,共15页。PPT课件主要包含了热化学方程式,℃101kPa,物质变化,能量变化,Q1﹥Q2,△H1<△H2等内容,欢迎下载使用。
化学选修4 化学反应原理第一节 化学反应与能量变化评课课件ppt: 这是一份化学选修4 化学反应原理第一节 化学反应与能量变化评课课件ppt,共37页。PPT课件主要包含了反应热,键能恒取正值,反应热焓变,从反应热角度看,从键能角度看,∆H=,热化学方程式,什么是热化学方程式,思考交流,每mol反应的焓变等内容,欢迎下载使用。













