




化学第三章 水溶液中的离子平衡第四节 难溶电解质的溶解平衡图片ppt课件
展开1.理解难溶电解质的溶解平衡。2.能说出溶度积的意义。3.明确沉淀生成、沉淀溶解、沉淀转化的本质是沉淀溶解平衡的移动。
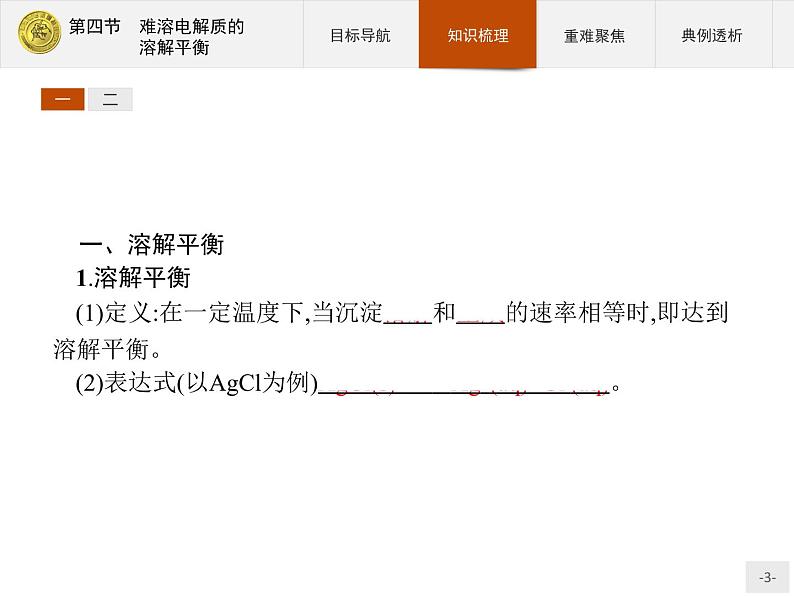
一、溶解平衡1.溶解平衡(1)定义:在一定温度下,当沉淀溶解和生成的速率相等时,即达到溶解平衡。(2)表达式(以AgCl为例)AgCl(s) Ag+(aq)+Cl-(aq)。
2.生成难溶电解质的离子反应的限度(1)25 ℃时,溶解性与溶解度的关系。
(2)反应完全的标志。对于常量的化学反应来说,化学上通常认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,反应就达完全。
2.沉淀的溶解(1)原理:根据平衡移动原理,对于在水中难溶的电解质,只要不断减少溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解。(2)溶解沉淀的试剂类型。①主要类型是:用强酸溶解:例如,溶解CaCO3、FeS、Al(OH)3、Cu(OH)2等难溶电解质。②用某些盐溶液溶解:例如Mg(OH)2沉淀可溶于NH4Cl溶液,化学方程式为Mg(OH)2+2NH4Cl MgCl2+2NH3·H2O。
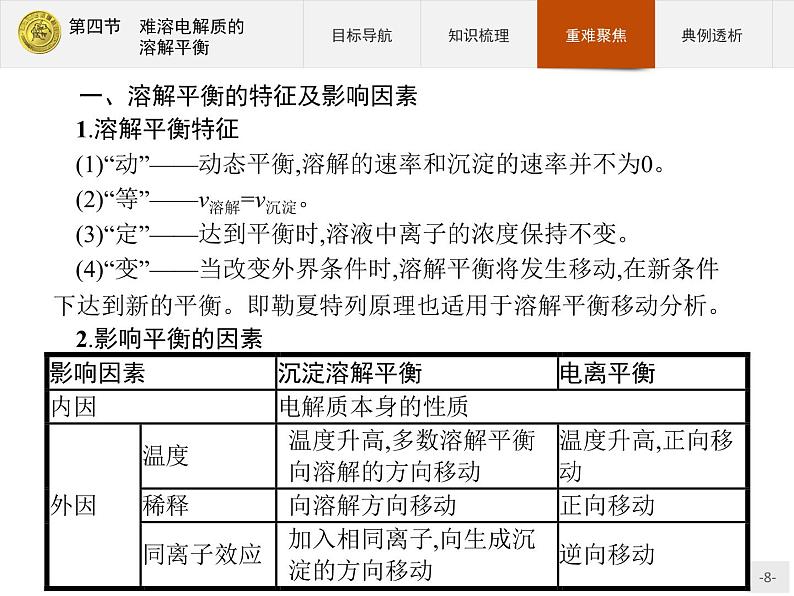
一、溶解平衡的特征及影响因素1.溶解平衡特征(1)“动”——动态平衡,溶解的速率和沉淀的速率并不为0。(2)“等”——v溶解=v沉淀。(3)“定”——达到平衡时,溶液中离子的浓度保持不变。(4)“变”——当改变外界条件时,溶解平衡将发生移动,在新条件下达到新的平衡。即勒夏特列原理也适用于溶解平衡移动分析。2.影响平衡的因素
特别提醒沉淀溶解平衡是化学平衡的一种,平衡移动原理仍适用于该平衡体系。
二、溶度积1.表达式对于AmBn(s) mAn+(aq)+nBm-(aq)Ksp=cm(An+)·cn(Bm-)2.溶度积与离子积的关系通过比较溶度积Ksp与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。(1)Qc>Ksp,溶液过饱和,有沉淀析出,直到溶液饱和,达到新的平衡。(2)Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态。(3)Qc
点拨解答沉淀溶解平衡题的两个关键点(1)在平衡“固体溶质 溶液中的溶质”中:v(溶解)>v(沉淀)时固体溶解;v(溶解)=v(沉淀)时达到溶解平衡;v(溶解)
解析:AgCl(s) Ag+(aq)+Cl-(aq),由于c(Ag+)·c(Cl-)=Ksp,溶液中c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解程度就越小。AgCl的溶解程度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液的体积无关。①c(Cl-)=0.01 ml·L-1;②c(Cl-)=0.04 ml·L-1;③c(Cl-)=0.03 ml·L-1;④c(Cl-)=0 ml·L-1;⑤c(Ag+)=0.05 ml·L-1。Ag+或Cl-浓度由小到大的排列顺序为④<①<③<②<⑤,故AgCl的溶解程度由大到小的排列顺序为④>①>③>②>⑤。答案:B
点拨增大沉淀溶解程度的因素(1)加水稀释,能增大沉淀的溶解,但此时各离子的浓度是减小的。(2)对大多数物质而言,加热可促进其溶解。但也有些物质的溶解度随温度升高而降低,升高温度,这类物质溶解程度降低。(3)加入能消耗沉淀溶解得到的离子的物质,此时因溶解时产生的离子浓度减小而使平衡向溶解的方向移动。(4)利用沉淀的转化,加入适当的物质生成与沉淀具有相同离子的溶解度更小的物质。
溶度积及应用【例题3】 下列说法不正确的是( )A.Ksp只与难溶电解质的性质和温度有关B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀C.其他条件不变,离子浓度改变时,Ksp不变D.两种难溶电解质作比较时,Ksp小的,溶解度一定小解析:Ksp只与难溶电解质自身的性质和温度有关,与沉淀的量和离子的浓度无关,A、C正确;相同类型的难溶电解质,沉淀向着溶解度减小的方向转化,B项正确;只有相同类型的难溶电解质,Ksp小的,溶解度才一定小,D错误。答案:D
化学第四节 难溶电解质的溶解平衡示范课ppt课件: 这是一份化学第四节 难溶电解质的溶解平衡示范课ppt课件,共30页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡课前预习ppt课件,共20页。PPT课件主要包含了课堂练习,②溶度积规则,pH32,pH91等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四节 难溶电解质的溶解平衡多媒体教学ppt课件,共19页。PPT课件主要包含了课堂练习,②溶度积规则,pH32,pH91等内容,欢迎下载使用。













