



高中化学人教版 (新课标)选修3 物质结构与性质第一节 原子结构教课课件ppt
展开1.了解原子核外电子的运动状态。2.能说出原子核外电子排布遵循的原理和规则,能记住原子的基态、激发态与光谱之间的关系。3.了解电子云轮廓图、电子云形状和原子轨道的含义,能用电子排布图表示基态原子的核外电子排布。
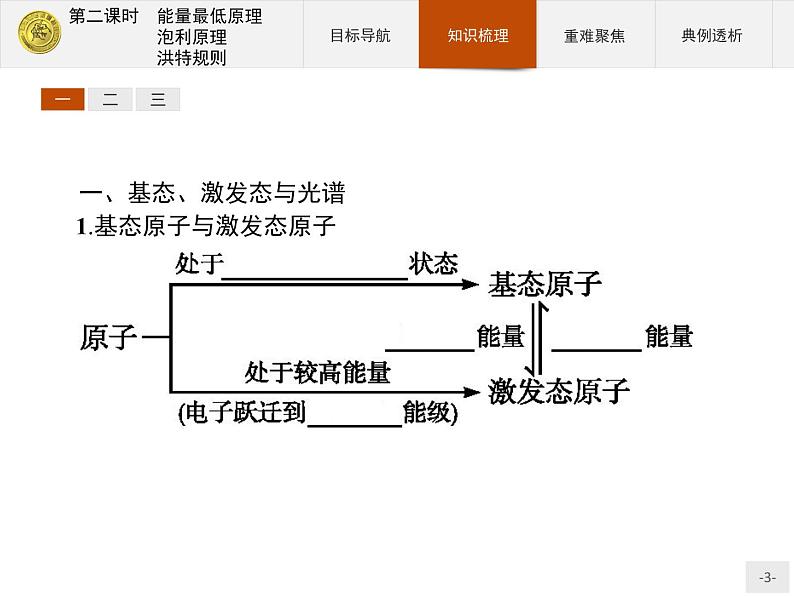
一、基态、激发态与光谱1.基态原子与激发态原子
2.光谱与光谱分析(1)光谱形成原因。不同元素的原子发生电子跃迁时会吸收或释放不同的光。(2)光谱分类。 (3)光谱分析。在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法。
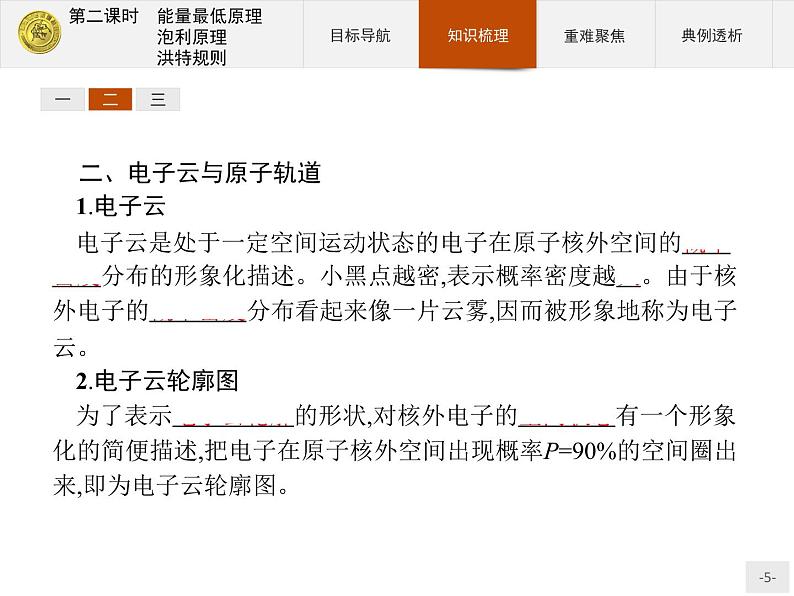
二、电子云与原子轨道1.电子云电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。小黑点越密,表示概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。2.电子云轮廓图为了表示电子云轮廓的形状,对核外电子的空间状态有一个形象化的简便描述,把电子在原子核外空间出现概率P=90%的空间圈出来,即为电子云轮廓图。
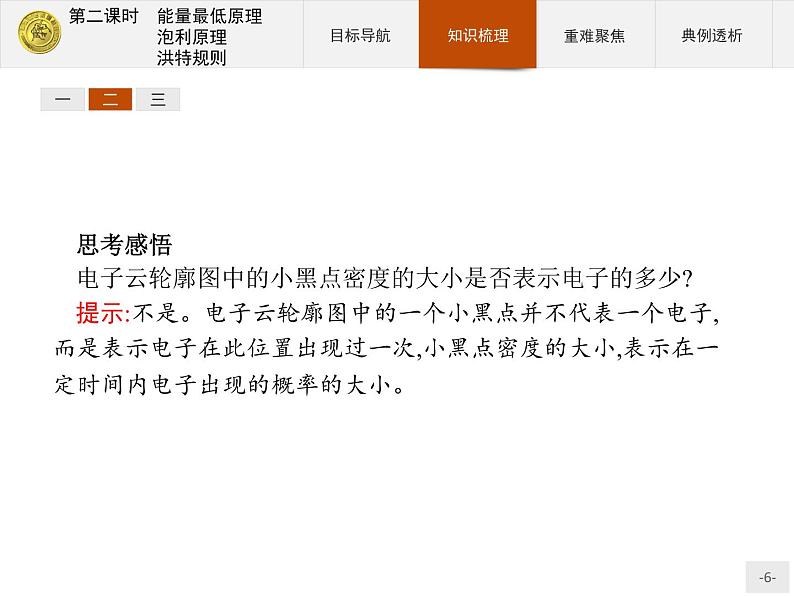
思考感悟电子云轮廓图中的小黑点密度的大小是否表示电子的多少?提示:不是。电子云轮廓图中的一个小黑点并不代表一个电子,而是表示电子在此位置出现过一次,小黑点密度的大小,表示在一定时间内电子出现的概率的大小。
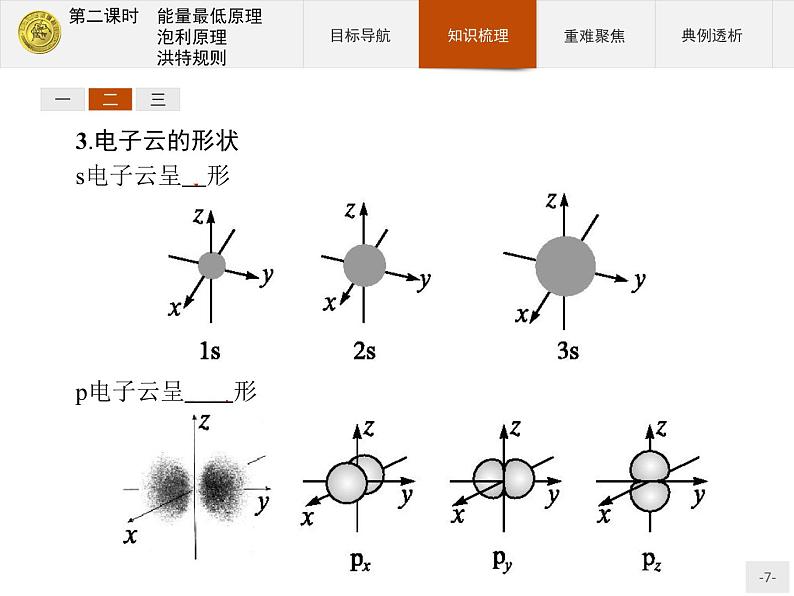
3.电子云的形状s电子云呈球形
4.原子轨道(1)定义:电子在原子核外的一个空间运动状态称为一个原子轨道。(2)各能级所含原子轨道数目
三、基态原子的核外电子排布规则1.能量最低原理原子核外电子的排布遵循构造原理,按轨道能量由低到高依次排列,使整个原子的能量处于最低状态。2.泡利原理在一个原子轨道里最多只能容纳2个电子,而且自旋状态相反,用“↑↓”表示。3.洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
一、基态原子的核外电子排布1.能量最低原理原子核外电子总是优先占有能量低的轨道,然后依次进入能量高的轨道,这样使整个原子处于能量最低的状态。2.泡利原理
(2)洪特规则特例:能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。
温馨提示核外电子在原子轨道上排布要遵循三个原则:能量最低原理、泡利不相容原理和洪特规则。这三个原则并不是孤立的,而是相互联系、相互制约的。也就是说核外电子在原子轨道上排布要同时遵循这三个原则。
二、原子核外电子排布的表示方法1.电子排布式(1)用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式。例如,K:1s22s22p63s23p64s1。(2)为了避免电子排布式书写过于烦琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示。例如,K:[Ar]4s1。前两周期各原子的电子排布式。第一周期 H:1s1;He:1s2。第二周期 Li:1s22s1;Be:1s22s2;B:1s22s22p1; C:1s22s22p2;N:1s22s22p3;O:1s22s22p4;F:1s22s22p5; Ne:1s22s22p6。
2.电子排布图每个方框代表一个原子轨道,每个箭头代表一个电子。如第二周期元素基态原子的电子排布图如下所示。
3.原子结构示意图如:K的原子结构示意图为 。4.电子式在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。如钠原子的电子式为·Na(或×Na)。
原子光谱【例题1】 对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )A.电子由激发态向基态跃迁时以光的形式释放能量B.电子由基态向激发态跃迁时吸收除红光以外的光线C.氖原子获得电子后转变成发出红光的物质D.在电流的作用下,氖原子与构成灯管的物质发生反应答案:A解析:解答该题的关键是明确基态原子与激发态原子的相互转化及其转化过程中的能量变化和现象。在电流作用下,基态氖原子的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红色光,故A项正确。
点拨光是电子释放能量的重要形式之一,日常生活中的许多光,如霓虹灯光、激光、焰火等都与原子核外电子发生跃迁释放能量有关。
核外电子排布的表示方法【例题2】 下列有关核外电子排布的式子不正确的是( )A.24Cr的电子排布式:1s22s22p63s23p63d54s1B.钾原子的简化电子排布式:[Ar]4s1
答案:D解析:D项中硫原子的电子排布图违反了洪特规则,正确的应是
高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt,共16页。PPT课件主要包含了目标一泡利原理,电子自旋,s22s22p4,不要标记电子数,练习1,目标二洪特规则,思考与交流1,s22s22p2,s22s22p3,s22s22p5等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件,共31页。PPT课件主要包含了s22s22p3,或Ar3d6,①⑤⑥,s23p3,洪特规则,d104s1等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件: 这是一份人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共44页。PPT课件主要包含了第一节原子结构等内容,欢迎下载使用。













