





化学选修4 化学反应原理第一节 化学反应与能量变化授课ppt课件
展开第1课时 焓变 反应热
1.能记住化学反应中能量转化的原因,能说出常见的能量转化形式。2.能举例说明化学能与热能的相互转化,了解反应热和焓变的含义。
一、化学反应过程中能量变化的表现形式1.表现形式化学反应过程中,不仅有物质的变化,还有能量的变化。这种能量的变化常以热能、电能、光能等形式表现出来。2.类型化学反应中的能量变化,通常表现为热量的变化。对化学反应,以反应过程中放热或吸热为标准划分,分为放热反应和吸热反应两种类型。有热量放出的反应叫做放热反应,需要吸收热量的反应叫做吸热反应。思考感悟是不是所有的化学反应都有能量的变化?为什么?提示:是的。原因是能量的变化与化学键的断裂与形成有关,反应物中化学键断裂消耗的能量之和与生成物中化学键形成所放出的能量之和是不相等的。
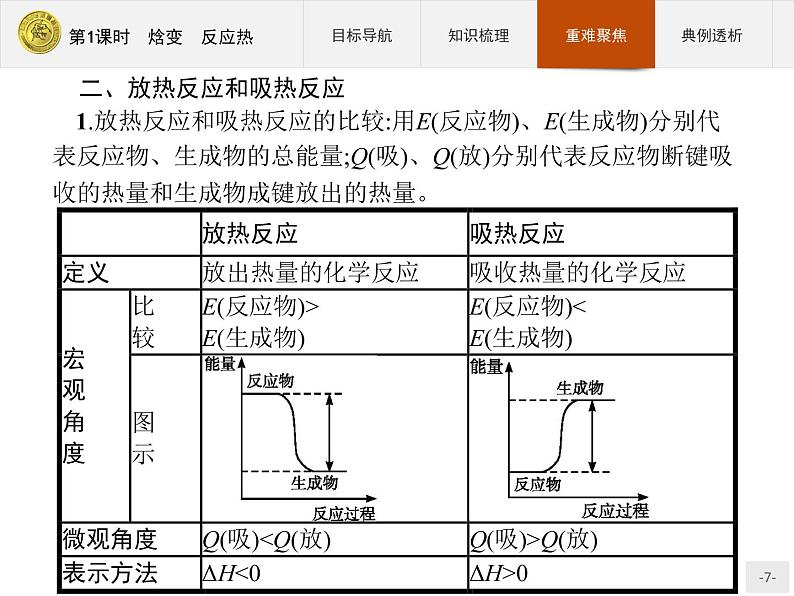
二、焓变 反应热1.反应热化学反应过程中所释放或吸收的能量,叫反应热,恒压下的反应热又称为焓变,符号用ΔH表示,其单位常采用kJ·ml-1。2.实质任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子中的化学键断裂时,需要克服原子间的相互作用,这需要 吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。3.焓变与吸热、放热反应的关系当ΔH为“+”或ΔH>0时,为吸热反应;当ΔH为“-”或ΔH<0时,为放热反应。
一、化学键与化学反应中能量变化的关系化学反应过程是原子重新组合的过程,反应物分子内化学键的断裂需要吸收能量,生成新物质时形成新的化学键要放出能量。二者的能量差,就决定了能量的变化。 当E1>E2时,反应吸收能量;当E1
焓变、反应热概念的理解【例题1】 下列说法中正确的是( )A.焓变单位是kJ·ml-1,是指1 ml物质参加反应时的能量变化B.反应吸热时ΔH<0C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”D.一个化学反应中,当生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”解析:焓变单位中的kJ·ml-1,是指每摩尔具体的反应,不一定指参加反应的物质,A错误;在反应中物质所具有的总能量减少,反应就放热,反之就吸热,C正确;化学反应的实质是旧化学键的断裂和新化学键的形成,断键时吸收能量,成键时释放能量,所以D错误。答案:C
放热反应和吸热反应的判断【例题2】 下列说法正确的是( )①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是吸热还是放热可以看反应物和生成物所具有的总能量的大小 ④某些吸热反应在一定条件下也能发生A.①②B.②③C.①④D.③④解析:反应是吸热还是放热主要取决于反应物和生成物所具有的总能量的相对大小。放热反应和吸热反应在一定条件下都能发生。反应开始需加热的反应可能是吸热反应,也可能是放热反应。例如C+O2 CO2的反应为放热反应,但反应开始也需要加热,即需要向反应体系先提供一定的能量。答案:D
点拨反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。放热反应和某些吸热反应在一定的条件下都能发生。反应开始时需要加热的反应可能是吸热反应,也可能是放热反应。吸热反应不但反应开始时需要加热,反应发生过程中仍需不断加热才能使反应继续进行下去;有的放热反应在反应开始时也需加热,反应发生后会放出一定的热量,如果此热量可使反应维持下去,则反应过程中不需要再加热,如煤的燃烧,一旦加热使煤燃烧起来后就不需要再加热,煤可继续燃烧下去。
化学反应中的能量变化【例题3】 下列变化一定是放热的化学反应是( )A.H2O(g) H2O(l) ΔH=-44.0 kJ·ml-1B.2HI(g) H2(g)+I2(g)C.形成化学键时共放出能量862 kJ的化学反应D.能量变化如图所示的化学反应
解析:A项,气态水变成液态水放出热量,但属于物理变化;B项,该反应为分解反应,是吸热反应;C项,未告诉断裂化学键吸收的能量,无法判断该反应是吸热反应还是放热反应;D项,反应物的总能量大于生成物的总能量,故该反应为放热反应。答案:D
高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热精品ppt课件,共28页。PPT课件主要包含了Qcm△t,随堂小练等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热完美版课件ppt,共51页。PPT课件主要包含了第一节反应热,知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业一,课后作业等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 物质的分类及转化获奖课件ppt: 这是一份人教版 (2019)必修 第一册第一节 物质的分类及转化获奖课件ppt,共18页。PPT课件主要包含了能量变化,物质变化基础,反应热,定性认识,体系与环境,实验原理,应该测量的数据,微观角度,化学反应的本质及特点,学习评价等内容,欢迎下载使用。













