





高中人教版 (新课标)第一章 原子结构与性质第一节 原子结构图文课件ppt
展开【教学目标】1.了解核外电子的运动状态即原子轨道2.了解泡利原理和洪特规则3.理解满足基态原子的条件4.学会用电子排布图表示核外电子排布规律
江西省鹰潭市第一中学 桂耀荣
可以准确地测出它们在某一时刻所处的位置及运行的速度; 可以描画它们的运动轨迹。
⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速)。
⑵无确定的轨道,无法描述其运动轨迹。
⑶无法计算电子在某一刻所在的位置,只能指出 其在核外空间某处出现的机会的多少(概率)。
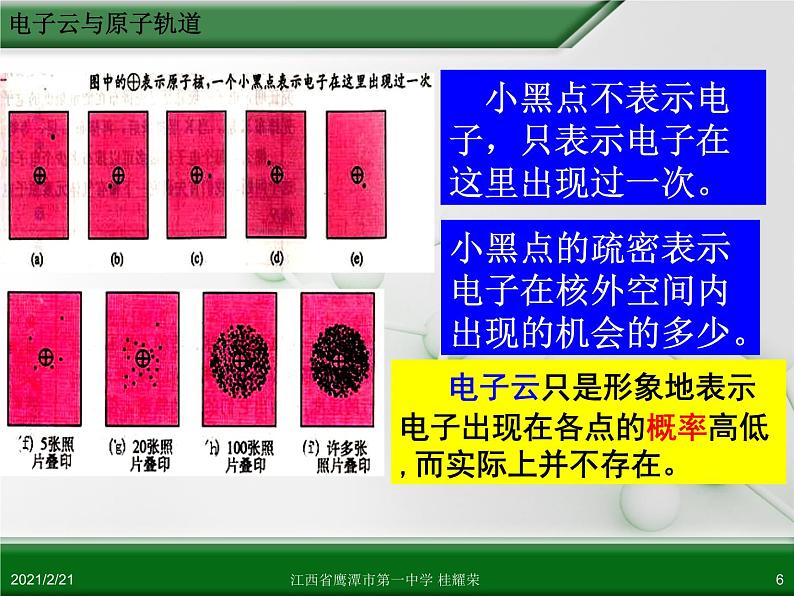
电子云:电子在原子核外出现的概率分布图。
1s电子在原子核外出现的概率分布图
核外电子运动状态的描述
电子云只是形象地表示 电子出现在各点的概率高低,而实际上并不存在。
小黑点不表示电子,只表示电子在这里出现过一次。
小黑点的疏密表示电子在核外空间内出现的机会的多少。
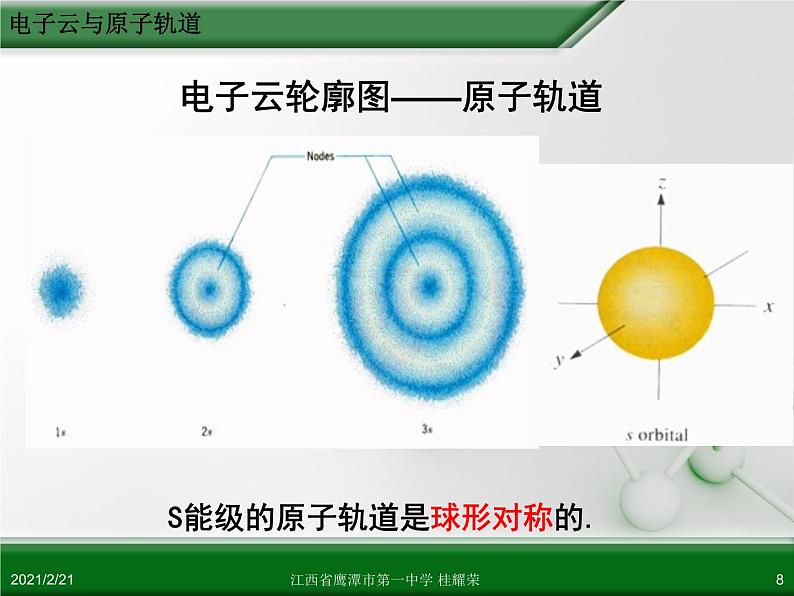
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。 P10 最后一段
电子云轮廓图——原子轨道
S能级的原子轨道是球形对称的.
电子云形状①s电子云呈球形,在半径相同的球面上,电子出现的机会相同;②p电子云呈哑铃形 (或纺锤形);③d电子云是花瓣形;④f电子云更为复杂。
* S能级的原子轨道是球形对称的
* 能层序数n越大,原子轨道半径越大
* P能级的原子轨道是哑铃形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示。
思考:回忆 s p d f 能级分别最多容纳电子个数?
P5 第二段最后一句话
观察下图,这些图称为原子的电子排布图。
1.每个原子轨道最多只能容纳几个电子?
1个原子轨道里最多只能容纳2个电子,且自旋方向相反(顺时针、逆时针)。 ---泡利原理
泡利(Pauli),奥地利科学家,对于量子力学的形成以及原子结构理论的发展有重大的贡献,获得1945年诺贝尔物理奖。他对科学理论有着很深刻的洞察力,语锋犀利,被称为“理论物理学的心脏” 。
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋方向必须相反,此时体系最稳定,原子的总能量最低。
用一个○表示一个原子轨道,在○中用“↑”或“↓”表示该轨道上排入的电子。
Li: 1s22s1
2.当电子排在同一个能级内时,有什么规律?
当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。---洪特规则
对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。
C :1s2 2s22p2
1.每个原子轨道上最多能容纳____个电子,且自旋方向_______
2.当电子排在同一能级时有什么规律?
当电子排布在同一能级的不同轨道时,总是___________________,而且自旋方向______
练习:写出 24Cr 29Cu 电子排布式
29Cu 1s22s22p63s23p63d104s1
24Cr 1s22s22p63s23p63d54s1
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
洪特规则特例:全空、半充满、全充满时相对稳定
能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。
小结:核外电子排布规则
其中最能准确表示基态锰原子核外电子运动状态的是( )
当碳原子的核外电子排布由
时,下列说法正确的是 ( )
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态C.碳原子要从外界环境中吸收能量D.碳原子要向外界环境释放能量
1、下列有关原子轨道的叙述中不正确的( ) A.氢原子的3s轨道能量较3p能级低 B.锂原子的2s与5s 轨道皆为球形分布 C.p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多 D.能层n=4的原子轨道最多可容纳16个电子
2、基态碳原子的最外能层的各能级中,电子排布的方式正确的是( ) A B C D
3、以下是表示铁原子的3种不同化学用语。
请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
结构示意图:能直观地反映核内的质子数和核外的电子层数 及各能层上的电子数。电子排布式:能直观地反映核外电子的能层、能级和各能级 上的电子数。电子排布图:能反映各轨道的能量的高低及各轨道上的电子 分布情况,自旋方向。
4.某元素原子序数为24,试问:
(1)该元素电子排布式:
1s2 2s22p6 3s23p63d5 4s1
(2)它有 个能层; 个能级;占有
(3)此元素有 个未成对电子;它的价电子数是 。
1s22s22p63s23p63d24s2
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s24p2
一、原子核外电子排布遵循的原理和规则
二、原子核外电子排布的表示式
人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件,共30页。PPT课件主要包含了宇宙大爆炸,道尔顿原子模型,汤姆生原子模型,卢瑟福原子模型,α粒子散射实验,玻尔原子模型,能层与能级,1能层,核外电子分层排布,2能级等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt,共24页。PPT课件主要包含了共价键等内容,欢迎下载使用。
高中人教版 (新课标)第一节 共价键示范课ppt课件: 这是一份高中人教版 (新课标)第一节 共价键示范课ppt课件,共26页。PPT课件主要包含了表2-1,表2-2,思考与交流,H2O105°,NH3107°,CO2180°,物理性质,等电子原理,SO2,NO2-等内容,欢迎下载使用。













