






人教版 (新课标)必修2第二节 元素周期律课文内容ppt课件
展开元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。那么研究元素周期表和元素周期律有何意义呢?
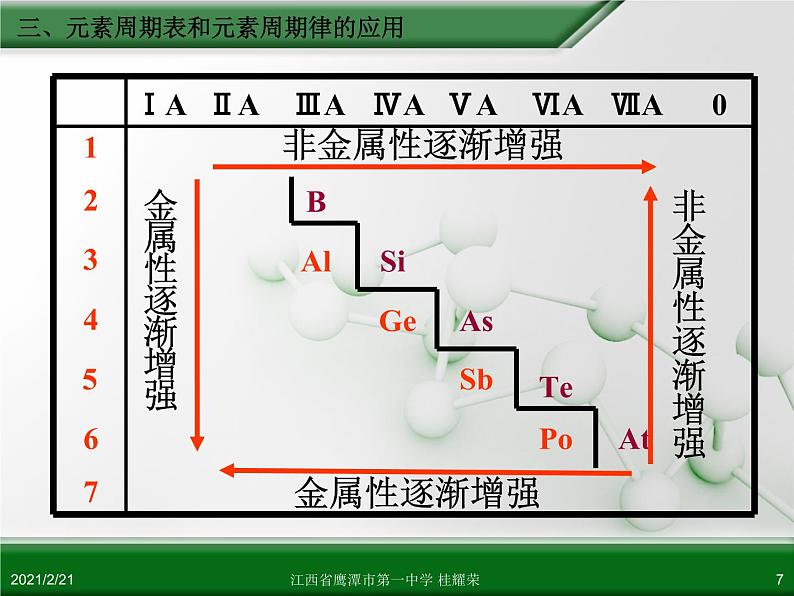
三、元素周期表和元素周期律的应用
江西省鹰潭市第一中学 桂耀荣
同一周期元素金属性和非金属变化
非金属性逐渐增强,金属性逐渐减弱
非金属性逐渐减弱,金属性逐渐增强
试用结构观点解释为什么有这样的变化规律:
同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。
同一主族元素金属性和非金属变化
金 属 性 逐 渐 增 强
金属性逐渐增强,非金属性逐渐减弱
金属性逐渐减弱,非金属性逐渐增强
同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
金属性逐渐增强
非金属性逐渐增强
学与问 什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置
元素的金属性和非金属性递变小结
主族元素的最高正化合价与最外层电子数有何关系?
最高正价==最外层电子数
最低负化合价数 = 8 – 最外层电子数
你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?
主族序数=最外层电子数
相似性 递变性(从上至下,金属性增强,非金属性减弱)
递变性(从左到右,金属性减弱,非金属性增强)
(主族)最外层电子数 = 最高正价数
8 -最外层电子数= 最低负价数
原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。
1、F 没有正价,O 通常不显示正价;2、金属元素只有正化合价而无负价。
已知元素在周期表中的位置推断原子结构和元素性质
根据元素的原子结构或性质推测它在周期表中的位置
元素在周期表中的位置、性质和原子结构的关系
元素位、构、性三者关系
1、金属性最强的元素(不包括放射性元素)是 ;2、最活泼的非金属元素是 ;3、最高价氧化物对应水化物的酸性最强的元素是 ;4、最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。
1、处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。2、处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。
在周期表中一定的区域内寻找特定性质的物质
根据周期表预言新元素的存在
氟里昂的发现与元素周期表
寻找用于制取农药的元素
寻找催化剂、耐高温、耐腐蚀的合金材料
根据元素周期表预言新元素的存在
类铝(镓)的发现: 1875年,法国化学家布瓦博德朗在分析比里牛斯山的闪锌矿时发现一种新元素,命名为镓,测得镓的比重为4.7,不久收到门捷列夫的来信指出镓的比重不应是4.7,而是5.9~6.0,布瓦博德朗是唯一手里掌握金属镓的人,门捷列夫是怎样知道镓的比重的呢?经重新测定镓的比重确实是5.94,这结果使他大为惊奇,认真阅读门捷列夫的周期论文后,感慨地说“我没有什么可说的了,事实证明了门捷列夫理论的巨大意义”。
类硅(锗)的发现 1886年由德国的温克勒在分析硫银锗矿中发现的,把它命名为Germanium以纪念他的祖国——德国(German)。元素符号为Ge。元素锗就是在1870年门捷列夫预言的基础上发现的。
1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟里昂,简称F12)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。
在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。
米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。 80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。
1、相邻三个周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?
2、用A表示质子数,B 中子数,C 核外电子数, D 最外层电子数,E 电子层数 。填写下列各空:
⑴ 原子(核素)种类由_____决定
⑵ 元素种类由_____决定
⑶ 元素同位素由 _____决定
⑷ 元素在周期表中的位置由______决定
⑸ 元素的原子半径由_______决定
⑹ 元素主要化合价由______决定
⑺ 元素的化学性质主要由______决定
⑻ 价电子通常是指_______
3、下列各组元素性质递变情况错误的是( ) A.Li、B、Be原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高 C.B、C、N、O、F 原子半径依次增大 D.Li、Na、K、Rb 的金属性依次增强
4、元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( ) A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
7、实质:元素性质周期性变化是由于______ ___________________________周期性 变化的必然结果。
6、内容:元素性质的周期性变化主要体现在 _________________________、_____ ________________、______________ ___________等方面。
5、定义:____________随着原子________ ___________________________的规律叫做元素周期律。
原子核外电子排布的周期性变化
的递增而呈现周期性的变化
的原子核外电子排布的周期性变化
高中化学第二节 化学能与电能背景图ppt课件: 这是一份高中化学第二节 化学能与电能背景图ppt课件,共20页。PPT课件主要包含了化学电池,一次性电池如干电池,总反应,充电电池,优点可反复使用,燃料电池,改变燃料,其他电池,废电池对环境的危害等内容,欢迎下载使用。
人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件,共30页。PPT课件主要包含了宇宙大爆炸,道尔顿原子模型,汤姆生原子模型,卢瑟福原子模型,α粒子散射实验,玻尔原子模型,能层与能级,1能层,核外电子分层排布,2能级等内容,欢迎下载使用。
高中人教版 (新课标)第一章 原子结构与性质第二节 原子结构与元素的性质备课课件ppt: 这是一份高中人教版 (新课标)第一章 原子结构与性质第二节 原子结构与元素的性质备课课件ppt,共33页。PPT课件主要包含了元素周期律,核电荷数,学与问,三电负性等内容,欢迎下载使用。













