




2021年春鲁教版化学中考第一轮复习课件 第8单元 盐及其性质
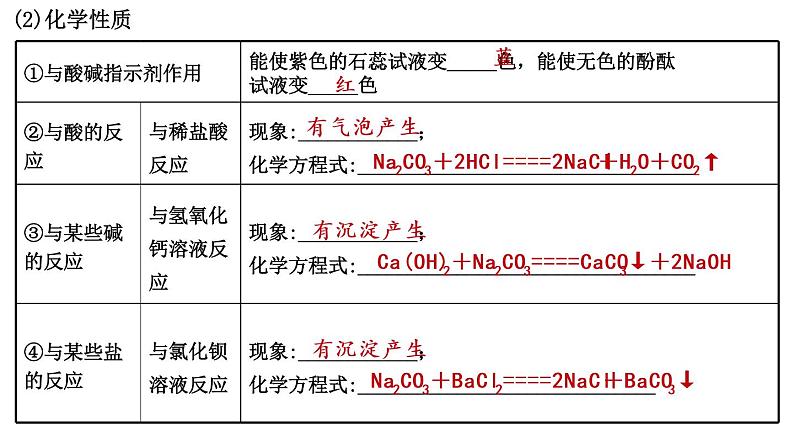
展开Na2CO3+2HCl====2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
Na2CO3+BaCl2====2NaCl+BaCO3↓
2 碳酸氢钠的性质与用途(1)碳酸氢钠的性质:碳酸氢钠是小苏打的主要成分,又称酸式碳酸钠,通常是白色粉末状晶体,能溶于水,水溶液呈碱性,能使紫色石蕊试液变蓝,使无色酚酞试液变红,受热易分解成碳酸钠、水和二氧化碳。(2)碳酸氢钠的用途:可作灭火器中二氧化碳发生剂;是发酵粉的主要成分;是制造饮料的常用原料;也是治疗胃酸过多的药剂之一。
【典例1】多角度看物质,有助于加深对物质的认识。Na2CO3是一种常见的盐,请回答:(1)Na2CO3溶液显碱性,其pH_____(填“<”“>”或“=”)7。(2)Na2CO3可看成是碱和氧化物反应的产物,写出反应的化学方程式: __________________________。(3)Na2CO3作为反应物之一,请写出一个符合A+B→C+D的化学方程式: ____________________________________________________________________________________。
2NaOH+CO2====Na2CO3+H2O
Na2CO3+Ca(OH)2====2NaOH+CaCO3↓(或Na2CO3+BaCl2====2NaCl+
BaCO3↓,其他合理答案也可)
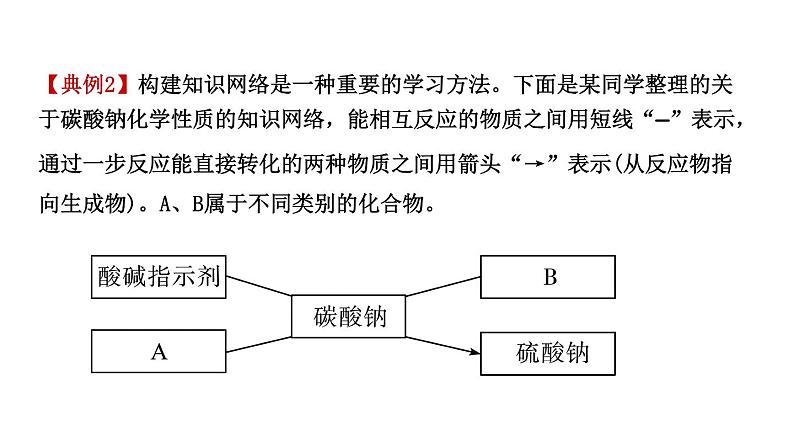
【典例2】构建知识网络是一种重要的学习方法。下面是某同学整理的关于碳酸钠化学性质的知识网络,能相互反应的物质之间用短线“—”表示,通过一步反应能直接转化的两种物质之间用箭头“→”表示(从反应物指向生成物)。A、B属于不同类别的化合物。
请填下列空格:(1)该同学将A物质的溶液滴加到碳酸钠溶液中,观察到有无色气泡冒出,则A物质可能是__________________(写一种物质的化学式)。(2)该同学归纳出,能够与碳酸钠溶液反应生成白色沉淀的物质B有多种。请选取其中一种,写出其与碳酸钠溶液反应的化学方程式:__________ _____________________________________________________________________,除你选取的物质所属类别外,物质B还可能属于_________________________(写物质类别)。
Na2CO3====CaCO3↓+2NaOH(或CaCl2+Na2CO3====CaCO3↓+2NaCl,合理即
(3)知识网络总是在不断地补充完善。该同学发现,有一种物质既能与碳酸钠相互转化,又能与硫酸钠相互转化,这种物质是_________(写化学式)。
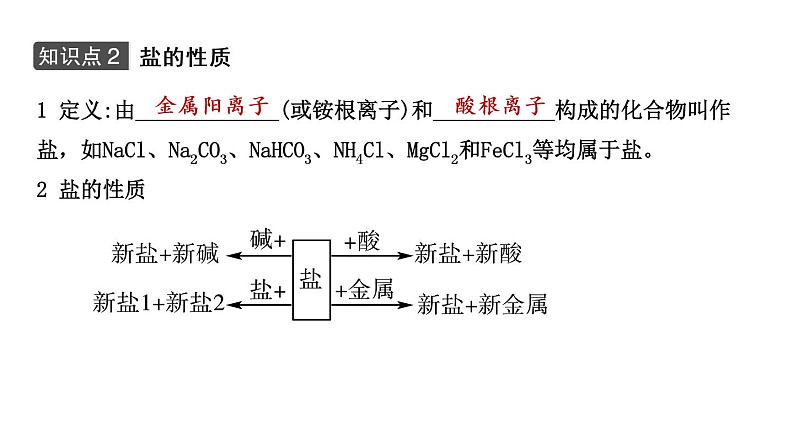
1 定义:由_____________(或铵根离子)和___________构成的化合物叫作盐,如NaCl、Na2CO3、NaHCO3、NH4Cl、MgCl2和FeCl3等均属于盐。2 盐的性质
3 常见盐溶液的颜色与盐的溶解性(1)常见的有特殊颜色的盐溶液蓝色溶液:含Cu2+,如CuCl2、CuSO4、Cu(NO3)2等。浅绿色溶液:含Fe2+,如FeSO4、FeCl2等。黄色溶液:含Fe3+,如Fe2(SO4)3、FeCl3等。(2)常见的难溶性盐不溶于水的盐:CaCO3、BaCO3、AgCl、BaSO4。不溶于酸的盐:AgCl、BaSO4(都为白色固体)。
【典例3】学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为_________________________。(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有_______(填序号)。(3)若盐是硝酸铜,由⑦来实现的化学方程式为______________________________________________。(4)图中⑤处应补充的文字是_______________ (写一种,不能与图中已有信息重复)。
2KOH+H2SO4====K2SO4
CuSO4+Ba(NO3)2====BaSO4↓
+Cu(NO3)2 (合理即可)
1 定义:两种_________相互交换成分,生成另外两种_________的反应,叫作复分解反应。2 实质:酸、碱、盐之间发生的复分解反应,其实质是离子之间相互结合,生成_______、_______或_____。可以把酸碱盐之间的反应实质总结如下:(1)生成水的反应只有1个:H++OH-====H2O
(2)生成气体的反应有3个:CO32-+2H+====H2O+CO2↑、NH4++OH-====NH3↑+H2O、H++HCO3-==== H2O+CO2↑。(3)生成沉淀的反应有多个,例如:CO32-+Ca2+====CaCO3↓、Ag++Cl-====AgCl↓、Cu2++OH-====Cu(OH)2↓等。
3 表达式:AB+CD====AD+CB4 特点:双交换、价不变。5 常见的复分解反应(1)酸+碱―→_____+_____(中和反应)(2)酸+盐―→_______+_______(3)酸+金属氧化物―→_____+_____(4)碱+盐―→_______+_______(5)盐1+盐2―→________+________
6 酸碱盐的溶解性规律(1)酸:初中范围内所学的酸均溶于水。(2)碱:除NaOH、KOH、Ba(OH)2、NH3·H2O易溶,Ca(OH)2微溶于水外,其他均不溶于水。(3)钾盐、钠盐、铵盐及硝酸盐均易溶于水。(4)盐酸盐:除AgCl不溶于水外,其他均溶于水。(5)硫酸盐:除BaSO4不溶于水,CaSO4、Ag2SO4微溶于水外,其他均易溶于水。(6)碳酸盐:除Na2CO3、K2CO3、(NH4)2CO3易溶于水,MgCO3微溶于水外,其他均不溶于水。
复分解反应的应用——溶液中物质的共存
2.能力突破(1)溶液中物质共存①物质均可溶。②在溶液中,物质之间不发生化学反应,即没有气体、沉淀或水生成。 (2)溶液中离子共存①离子共存的条件a.形成的物质均可溶。b.在同一溶液中,离子之间不发生反应,即没有沉淀、气体或水生成。②常见的不能共存的离子对(不能共存即能反应生成______或______或____)SO42-+______=====________(不溶于酸)Cl-+_____=====_______(不溶于酸)
(3)物质共存题中的隐含条件①溶液呈电中性(不显电性):即在同组物质的离子中,既含阳离子又含阴离子。②“酸碱性或pH”条件型:酸性或pH<7,说明溶液中存在____;碱性或pH>7,说明溶液中存在_____。③“无色”条件型:溶液中不存在有颜色的离子,如_____(蓝色)、_____(浅绿色)、_____(黄色)。(4)溶液成分的鉴别,选择试剂使被鉴别物质产生沉淀或气体;通过产生沉淀或气体的现象推断溶液成分。
2021年春鲁教版化学中考第一轮复习课件 第10单元 化学与健康: 这是一份2021年春鲁教版化学中考第一轮复习课件 第10单元 化学与健康,共21页。PPT课件主要包含了蛋白质,维生素,化学元素与人体健康,人体中的化学元素,佝偻病,甲状腺肿大,远离有毒物质等内容,欢迎下载使用。
2021年春鲁教版化学中考第一轮复习课件 第9单元(2) 金属: 这是一份2021年春鲁教版化学中考第一轮复习课件 第9单元(2) 金属,共21页。PPT课件主要包含了3常见的合金,03%~2%,%~43%,混合物,熔点高,含碳量不同,导热性,金属的冶炼,常见的金属矿物,Fe2O3等内容,欢迎下载使用。
2021年春鲁教版化学中考第一轮复习课件 第9单元(1) 金属: 这是一份2021年春鲁教版化学中考第一轮复习课件 第9单元(1) 金属,共21页。PPT课件主要包含了量的热生成白色固体,红色固体变黑色,FeHCu,AgNO3,CuNO32,金属与酸反应图像分析,命题规律,FeNO32,金属活动性顺序的探究,实验设计等内容,欢迎下载使用。












