




高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用背景图课件ppt
展开1.同周期同主族元素性质的递变规律。(1)同周期元素从左到右,金属性逐渐_____,非金属性逐渐_____。(2)同主族元素从上到下,金属性逐渐_____,非金属性逐渐_____。
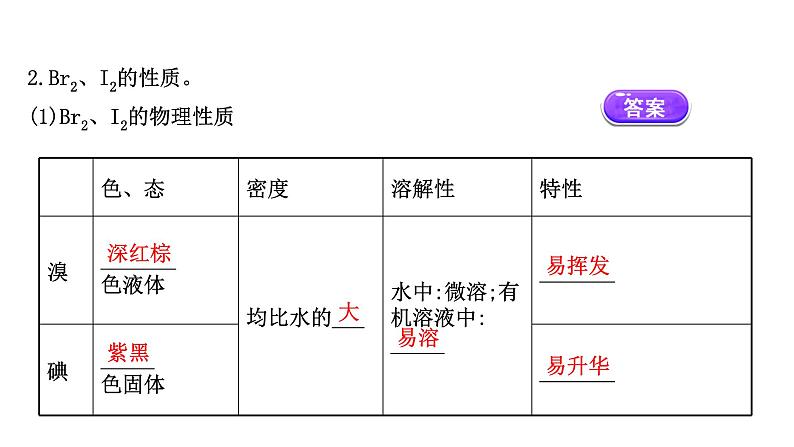
2.Br2、I2的性质。(1)Br2、I2的物理性质
(2)溴、碘及其化合物的性质①溴单质具有氧化性,能将碘化钾溶液中的碘置换出来,反应的化学方程式为____________________②在水溶液中,溴离子能与银离子反应,生成难溶于水和稀硝酸的浅黄色溴化银沉淀。反应的离子方程式为_________________,实验室常用硝酸银溶液和稀硝酸来检验Br-。③在水溶液中,碘离子能与银离子反应,生成难溶于水和稀硝酸的黄色碘化银沉淀。反应的离子方程式为______________________,实验室常用硝酸银溶液和稀硝酸来检验I-。④淀粉遇I2变_____,该性质可用于检验I2。
Br2+2KI====2KBr+I2。
Br-+Ag+====AgBr↓
I-+AgNO3====AgI↓+N
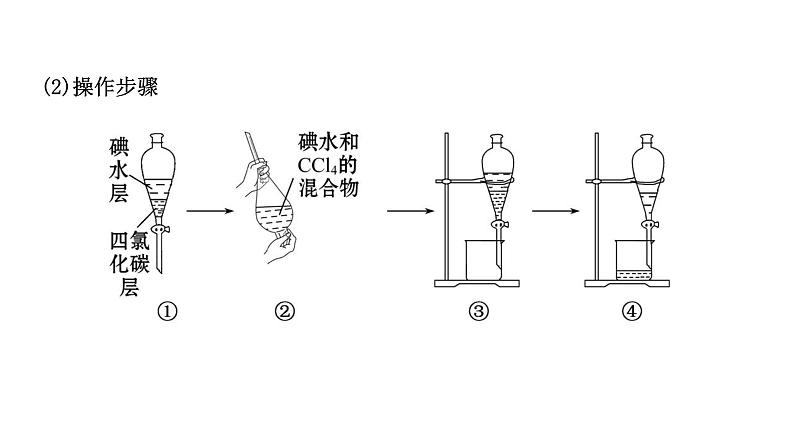
3.物质分离的一种方法:萃取和分液。(1)萃取①利用某种溶质在两种_________的溶剂里溶解能力的不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的方法叫萃取。②萃取后,可以用分液漏斗把_________的两种液体分开,从而达到分离的目的。
(3)注意事项①萃取剂必须具备的三个条件:萃取剂和原溶剂互不相溶、不反应;萃取剂和溶质互不发生反应;溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。②萃取和分液的主要仪器是分液漏斗。
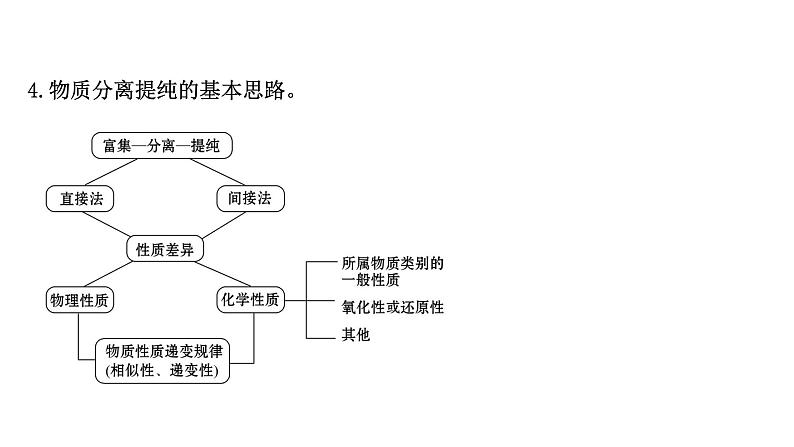
4.物质分离提纯的基本思路。
【自主探索】 (情境思考)很多家庭都有如图这样的瓶子,这是把人参、枸杞、灵芝、鹿茸等中药材放在酒中进行泡制,一段时间以后倒出饮用,有舒筋活血之功效,你知道药材放在酒中泡制的原理吗?
提示:泡制药酒从化学上解释实际上属于固液萃取,中药材中的有效成分在泡制过程中转移到酒精中,通过饮用药酒达到一定药效。
项目活动1:海带提碘 碘单质在日常生产和生活中有非常重要的应用,其中碘酒、碘伏等均是应用广泛的消毒剂。碘酒的主要成分是碘、乙醇、碘化钾,是一种外用的药,可以对皮肤进行消毒处理。碘伏的主要成分是单质碘与聚乙烯吡咯酮(Pvidne)的不定型结合物,能够杀灭芽孢、原虫、病毒、真菌、细菌,挫伤、擦伤、切割伤、冻伤、烧伤等各种外伤都可以利用碘伏进行处理。
既然碘的用途这么广泛,那么碘是从哪种物质中提取的呢?如何提取碘?
【活动探究】1.实验用品海带,H2O2溶液,氯水,淀粉2.实验步骤及现象
【思考讨论】1.第1步灼烧海带用到哪些仪器?提示:坩埚、坩埚钳、泥三角、三脚架、酒精灯、玻璃棒。
2.第1步中如何检验溶液中含有I-?提示:取少量溶液加入AgNO3溶液和稀HNO3或加入氯水和淀粉溶液或加入氯水和CCl4溶液。
3.书写第3步反应的离子方程式,并分析还可选取哪些物质作为此反应的氧化剂,其依据是什么?提示:Cl2+2I-====I2+2Cl-或H2O2+2I-+2H+ I2+2H2O;由元素周期表中元素性质的递变规律知:氧化性Cl2>Br2>I2,因此氯水、溴水均可作提取碘的氧化剂;从氧化性强弱角度分析:FeCl3、H2O2也可用作提取碘的氧化剂。
4.选择萃取剂的条件是什么?本实验的萃取剂可选用什么物质?提示:萃取剂的条件是萃取剂和原溶剂互不相溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度。本实验可选用苯、四氯化碳、汽油作萃取剂,不用酒精作萃取剂。
【探究总结】1.萃取和分液的原理和操作注意事项(1)原理利用溶质在两种互不相溶的溶剂里溶解性不同,用一种溶剂把溶质从另一种溶剂里提取出来。(2)分液操作的注意问题。①分液漏斗使用前要检验是否漏水。②倒转分液漏斗时,应关闭玻璃塞和活塞,防止液体流出,并且要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险。
③分液时要将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,保证漏斗内与外界大气相通,同时漏斗下端管口要紧贴烧杯内壁,从而使液体顺利流下。④下层液体要从下口放出,上层液体要从漏斗上口倒出。
2.海带提碘的流程如下
3.反萃取法:将富集在有机溶剂中的单质利用化学方法重新富集在水中的方法。
【迁移应用】1.(2020·南京高一检测)选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )A.不溶于水,且必须易与碘发生化学反应B.不溶于水,且比水更容易使碘溶解C.不溶于水,且必须比水密度大D.不溶于水,且必须比水密度小【解析】选B。萃取剂与原溶剂不互溶,且更易溶解溶质。
2.(2020·邢台高一检测)海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
下列有关叙述正确的是( )A.碘元素在海水中也有游离态B.在提取的过程中用的氧化剂可以是H2O2C.操作A是结晶或重结晶D.B是提纯操作,常用蒸馏或分馏【解析】选B。碘元素在海水中只有化合态,没有游离态,A错误;双氧水是绿色氧化剂,可以将碘离子氧化为碘单质,在提取的过程中用的氧化剂可以是H2O2,B正确;操作A是萃取,操作B是分液,然后才是利用蒸馏等操作来得到碘单质,C、D错误。
3.(原创题)下列关于从海带中提取碘单质的说法中正确的是( )A.海带中提碘包括浸取、过滤、氧化三个步骤B.海带提碘选取的氧化剂可以是溴单质C.反萃取法就是将有机溶剂中的碘单质溶于水的过程D.反萃取法中碘单质与浓氢氧化钠反应的化学方程式为I2+2NaOH====NaI+NaIO+H2O
【解析】选B。A中缺少萃取的步骤;由于溴单质的氧化性强于碘单质,所以海带提碘选取的氧化剂可以是溴单质,B正确;C中反萃取法就是将有机溶剂中的碘单质溶于NaOH等发生化学反应变成含碘化合物溶解在水中的过程;D中碘单质与浓氢氧化钠反应的化学方程式为3I2+6NaOH====5NaI+NaIO3+3H2O。
【加固训练】 1.(2020·临汾高一检测)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:(1)步骤⑤所用的主要仪器是____________。 (2)步骤③的实验操作名称是____________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是____________。 (3)步骤④反应的离子方程式是____________________________________。 (4)步骤⑤中,某学生选择用苯来提取碘的理由是 ______________________________________________________________________________________。
【解析】(1)分液的主要仪器为分液漏斗。(2)物质的分离方法是固液分离用过滤,液液不互溶用分液,液液互溶且沸点相差较大用蒸馏。(3)利用MnO2的强氧化性把I-氧化。答案:(1)分液漏斗 (2)过滤 蒸馏(3)2I-+MnO2+4H+====Mn2++I2+2H2O(4)苯与水互不相溶,碘在苯中溶解度比水中的大
2.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题:(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有哪些?(请从以下仪器中选择)A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架E.泥三角 F.酒精灯 G.烧杯提示:根据灼烧时需要的仪器可以分析,使用的仪器主要有BCDEF。
(2)第2步:I-溶液的获取,操作是什么?提示:将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,过滤。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(从浓H2SO4、新制氯水、KMnO4 、H2O2四种试剂中选择)。理由是什么? 提示:选择H2O2。原因是过氧化氢是绿色氧化剂,在氧化过程中不引入杂质,不产生污染(不会进一步氧化单质碘)。
(4)第4步:碘单质的检验。请说出检验碘单质的具体操作。提示:取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中有碘。
项目活动2:海水提溴 溴及其化合物可被用来作为阻燃剂、净水剂、杀虫剂、染料等。常用消毒药剂的红药水中含有溴和汞。在照相技术中,溴和碘与银的化合物担任感光剂的角色。
溴又被称之为“海洋元素”,海水中含有大量的溴,请根据元素周期律的相关知识设计实验探究从海水中提取溴的主要流程。
【活动探究】【实验用品】溴化钠溶液、氯水、四氯化碳【实验步骤】
(1)在一支试管中加入2~3 mL NaBr溶液,滴加少量新制氯水。现象及结论:溶液由无色变成橙色。反应的化学方程式为Cl2+2NaBr====2NaCl+Br2。(2)向上述试管中再滴加少量CCl4,振荡,静置。现象及结论:液体分成两层,上层为无色溶液,下层为橙红色液体。(3)海水中提取溴的原理分析。根据以上实验和同主族元素性质递变可知,由于氯气的氧化性强于溴单质的氧化性,所以可以用氯气氧化得到溴单质然后再用有机溶剂萃取的方式从海水中提取溴单质。
【思考讨论】1.海水中的溴元素主要以Br-的形式存在,苦卤是从海水中提取溴的主要原料。可用何种氧化剂将溴离子氧化?提示:溴单质的氧化性介于氯单质和碘单质之间,因此海水提溴可以选取氯气作氧化剂。
2.为什么选晒盐后的苦卤而不是海水作为提取溴单质的原料?提示:苦卤中Br-的浓度比海水中大得多。
3.从海水中提取溴的过程中,为什么往溴水中鼓入热空气或水蒸气即可获得粗溴?在实验室中怎样从溴水中提取溴?提示:溴具有很强的挥发性,往溴水中鼓入热空气或水蒸气,溴即可挥发出来。在实验室中可以采用萃取的方法提取溴。
4.如何由粗溴制备高纯度溴?提示:吹出的溴蒸气和吸收剂SO2、H2O发生反应,转化为HBr,然后再用氯气将其氧化得到溴单质。
【探究总结】1.从海水中提取溴(1)步骤:浓缩、氧化、富集、提取。(2)反应原理:离子方程式为Cl2+2Br-====2Cl-+Br2。(3)提取方法:利用Br2的挥发性,鼓入热空气或水蒸气,就可将Br2分离出来。
【迁移应用】1.(2020·德州高一检测)目前海水提溴的主要方法是空气吹出法工艺,其流程图如下。以下推断不合理的是( )
A.热空气能吹出溴是利用溴易挥发的性质B.SO2吸收溴的化学方程式为SO2+2H2O+Br2====H2SO4+2HBrC.流程中只涉及溴元素被氧化的过程D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
【解析】选C。用热空气从含Br2的海水中将Br2吹出得到含Br2的空气,用二氧化硫吸收,得到吸收液,发生反应的化学方程式为SO2+2H2O+Br2====H2SO4+2HBr,然后将吸收液氯化,发生反应的化学方程式为2HBr+Cl2 ==== Br2+2HCl,得到溴水混合物,然后采用蒸馏的方法得到液溴。溴易挥发,所以热空气能吹出溴是利用溴易挥发的性质,故A正确;二氧化硫具有还原性,溴具有强氧化性,二者能发生氧化还原反应,反应的化学方程式为SO2+2H2O+Br2 ==== H2SO4+2HBr,故B正确;流程中SO2吸收溴的过程是溴元素被还原的过程,故C错误;海水中溴的含量很低,如果直接采用蒸馏法从含溴海水中得到溴单质会消耗更多能量,将海水中的溴还原的目的是富集溴,故D正确。
2.(2020·济南高一检测)从海水中提取溴的流程如图所示,下列有关说法错误的是( )
A.X为SO2气体,也可将SO2换成Na2SO3B.设备Y为蒸馏塔C.在提取溴的过程中一定有Br-被氧化D.工业上每获得1 ml Br2,需要消耗Cl2的体积最多为22.4 L(标准状况下)【解析】选D。亚硫酸钠与二氧化硫都具有还原性,A正确;设备Y就是用来蒸馏溴的,B正确;要想得到溴单质,一定要将溴离子氧化为溴单质,C正确;因为溴离子要经过二次氧化,因此工业上每获得1 ml Br2,需要消耗Cl2的体积最少为44.8 L(标准状况下),D错误。
【加固训练】 1.从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )A.氧化→吸收→吹出B.氧化→吹出→吸收C.吹出→氧化→吸收D.吹出→吸收→氧化【解析】选B。从海水中提取溴,先用氧化剂将溴离子氧化为溴单质,再用空气和水蒸气吹出后用溶有二氧化硫的溶液吸收。所以主要步骤是氧化→吹出→吸收,B项正确。
2.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤②发生反应的离子方程式为_________________________________。 (2)步骤④利用了SO2的还原性,反应的离子方程式: ___________________________________________________________________________________。 (3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2====NaBrO3+5NaBr+3CO2;吸收1 ml Br2时,转移的电子数为________ml。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
【解析】 (1)步骤②发生的反应是氯气把溴置换出来,反应的离子方程式为Cl2+2Br-====2Cl-+Br2。(2)步骤④利用了SO2的还原性,反应的离子方程式是Br2+2H2O+SO2====S +4H++2Br-。(3)根据反应方程式可知每吸收3 ml的Br2,转移电子5 ml,所以吸收1 ml Br2时,转移的电子数为 ml。答案:(1)Cl2+2Br-====2Cl-+Br2 (2)Br2+2H2O+SO2====S +4H++2Br- (3)
3.(2020·永州高一检测)下列说法不正确的是( )
A.图Ⅰ振荡后静置,上层溶液颜色变浅或消失B.图Ⅱ所示装置为用酒精提取溴水中的溴C.可用CCl4提取溴水中的Br2D.检验Br-的存在时,在溶液中先加入氯水再加入CCl4,振荡、静置,观察下层溶液是否显橙红色
【解析】选B。A正确,Br2能与NaOH反应:Br2+2NaOH====NaBr+NaBrO+H2O,上层溶液颜色变浅或消失;B不正确,酒精易溶于水,不能用酒精萃取溴水中的溴;C正确,可以用CCl4萃取溴水中的溴;D正确,2Br-+Cl2====Br2+2Cl-,CCl4密度比水大,Br2溶于CCl4,所以下层显橙红色。
4.(2020·大连高一检测)地球上大多数的溴元素以离子的形式存在于海水中,故溴常被称为“海洋元素”。(1)用氯气作氧化剂,以浓缩后的海水为原料可制取溴单质,发生反应的离子方程式为______________________,制得的溴单质仍然溶解在苦卤中,利用溴的________性,向苦卤中鼓入热空气,就可将溴分离出来。 (2)某同学向溶有溴单质的苦卤中加入某液体,若该液体萃取溴后,处于水层之下,则这种液体可能是________(填“苯”“汽油”或“CCl4”),选用萃取剂的原则是__ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ ____ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ __ 。
【解析】(1)Cl2与Br-发生置换反应制得Br2,利用溴的挥发性,向苦卤中鼓入热空气,使溴随热空气挥发出来。(2)萃取剂处于水层之下说明萃取剂的密度大于水,故该萃取剂可能是CCl4。答案:(1)2Br-+Cl2====2Cl-+Br2 挥发 (2)CCl4 溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;萃取剂必须和原溶剂互不相溶,且萃取剂、原溶剂、溶质之间不反应
1.(2020·济宁高一检测)目前从海水中提取溴常用的方法之一是用氧化剂把溴离子氧化成单质,再通入热空气将溴蒸气吹出,这一反应中常用的氧化剂是( )A.氯气 B.单质溴 C.水 D.双氧水【解析】选A。常用方法是通入氯气把浓缩溶液中的溴化物氧化,然后用热空气把生成的溴吹出。
2.(2020·延边高一检测)海带中含碘元素,从海带中提取碘有如下步骤:①加入足量双氧水(含稀硫酸);②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )A.①②③④⑤B.①③⑤②④C.②⑤①③④D.②①③⑤④【解析】选C。海带中提取碘:先将海带焙烧成灰,向海带灰中加水搅拌,再过滤,向滤液中加入足量氧化剂(如H2O2等),然后加入CCl4振荡,最后用分液漏斗分液。即合理的操作顺序为②⑤①③④。
3.为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是( )A.①中反应的离子方程式:2I-+ H2O2====I2+ 2OH-B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出C.③操作使用的是反萃取法,得到的上层溶液中含有I-D.操作Z的名称是加热【解析】选C。A项中加入稀硫酸,环境为酸性,不能生成OH-,故A错误;四氯化碳的密度比水大,②中分液时含I2的CCl4溶液从分液漏斗下口放出,故B错误;碘化钠水溶液的密度比四氯化碳小,③操作是反萃取法,得到的上层溶液中含有I-,故C正确;从含有碘的悬浊液中得到碘,应该采用过滤的方法,故D错误。
4.(2020·雅安高一检测)从海水中提取部分物质的过程如图所示:
下列有关说法正确的是( )A.过程①中除去粗盐中的S 、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸B.由“母液→Mg”一系列变化中未涉及氧化还原反应C.工业上一般用金属钠与无水MgCl2反应制取Mg单质D.反应③和⑤均可由下列反应实现:2Br-+Cl2====Br2+2Cl-,该反应属于置换反应
【解析】选D。A不正确, Na2CO3溶液应在BaCl2溶液的后面加入,因为加入过量的BaCl2溶液后,过量的Ba2+需用C 除去;B不正确,由无水MgCl2制取镁的反应是氧化还原反应;C不正确,工业上用电解熔融MgCl2的方法制取镁;D正确,采用Cl2作氧化剂氧化Br-提取Br2。
5.(双选)(2020·武邑高一检测)下列实验操作规范且能达到目的是( )
【解析】选B、D。氢化物水溶液的酸性大小与非金属性强弱无关,故A错误;碘易溶于酒精,可用酒精清洗,再用水洗去酒精,故B正确;硝酸的还原产物为NO或NO2,会对环境造成污染,故C错误;碘单质能与氢氧化钠溶液反应,可以用浓的氢氧化钠溶液反萃取四氯化碳中的碘单质,分液后水相酸化得到碘单质,故D正确。
【加固训练】 1.下列叙述不正确的是( )A.仅用试管、胶头滴管、溴水、KI-淀粉溶液比较Br2与I2的氧化性的强弱B.利用烧杯、玻璃棒、胶头滴管、分液漏斗及溴水和CCl4能除去NaBr溶液中的少量NaIC.在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应D.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
【解析】选C。A正确,Br2+2KI====2KBr+I2,使淀粉溶液呈蓝色,证明氧化性Br2强于I2;B正确,Br2+2NaI====2NaBr+I2,CCl4将多余的Br2及置换出的I2萃取后,分液得到NaBr溶液;C不正确,2KI+Cl2====2KCl+I2,I2与淀粉发生显色反应,即变蓝色;D正确,少量Cl2与I-反应生成I2,溶于CCl4而显紫色。
2.(2020·亳州高一检测)某同学取海带灰加蒸馏水煮沸2~3 min,冷却、过滤后获得含I-的溶液,并设计以下实验方案,从溶液中提取I2。
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是________________。 (2)试剂b应选择________(填字母)。 A.CCl4 B.苯 C.酒精 D.醋酸(3)操作1的名称是____________。实验室里进行操作1需要的玻璃仪器除烧杯外,还需要________________。 (4)反应2的化学方程式为3I2+6NaOH 5NaI+NaIO3+3H2O,此反应中的氧化剂是________________,氧化产物是________________。 (5)反应3的离子方程式是________________________________________。
【解析】(1)反应1中硫酸的作用是提供酸性环境,试剂a用来氧化碘离子,则其作用是将I-氧化成I2(或作氧化剂)。(2)结合后续实验操作可知向含I2的有机溶液中加入氢氧化钠溶液发生反应生成碘化钠、碘酸钠。分液后碘单质最终在上层溶液中生成,则b为萃取剂且密度大于水,所以试剂b应选择四氯化碳。(3)操作1是萃取分液得到含碘单质的有机溶液,操作的名称是萃取、分液,实验室里进行操作1需要的玻璃仪器除烧杯外,还需要分液漏斗。(4)反应2的化学方程式为3I2+6NaOH====5NaI+NaIO3+3H2O,此反应的氧化剂是I2,氧化产物是NaIO3。(5)反应3是碘离子与碘酸根离子在酸性溶液中发生归中反应生成碘单质,该反应的离子方程式为5I-+I +6H+====3I2+3H2O。
答案:(1)将I-氧化成I2(或作氧化剂)(2)A(3)萃取、分液 分液漏斗(4)I2 NaIO3(5)5I-+I +6H+====3I2+3H2O
素养新思维 6.(2020·宁波高一检测)空气吹出法是目前海水提溴的主要方法之一。海水提溴的流程如图所示:
(1)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:________________。(2)步骤⑧中蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。所用主要仪器的名称是____________。(3)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,而是经过步骤③④⑤后再蒸馏,这样操作的原因是_______________。
【解析】(1)步骤⑥的蒸馏过程中,温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;温度过低,溴不能完全蒸出。(2)根据信息,步骤⑧得到液溴和溴水的混合物,且它们的相对密度相差很大,因此采用分液的方法进行分离,所用的主要仪器是分液漏斗。(3)步骤③④⑤的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,富集后再蒸馏含溴的溶液效率更高,消耗能量更少,成本降低。
鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件: 这是一份鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件,共39页。PPT课件主要包含了内容索引,素养目标,课前篇素养初探,课堂篇素养提升等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt,共40页。PPT课件主要包含了深红棕,易挥发,易升华,互不相溶等内容,欢迎下载使用。
鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用备课课件ppt: 这是一份鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用备课课件ppt,共43页。PPT课件主要包含了知识铺垫,新知预习,任务一,任务二,随堂检测等内容,欢迎下载使用。













