






高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用示范课ppt课件
展开项目活动1 海带提碘【教材情境】 碘是人和动物生命的必需微量元素,有“智力元素”之称。碘进入人体后,主要被甲状腺摄取参与甲状腺激素的形成。甲状腺激素调节机体的代谢水平,影响机体热能的产生、血糖与酮体水平以及智力与性功能,一旦缺乏就会造成危害,如引起地方性甲状腺肿、地方性克汀病等。那么,大量的碘是从哪里来的呢?
【问题探究】1.为了将海带、紫菜中I-转化为I2,可以选用什么化学药品?选择化学药品的依据是什么?如何检验碘单质的存在?提示:海带中碘元素以I-形式存在,可以通过加入氧化剂将I-氧化为碘单质。因为I-具有较强的还原性,氧化剂可以将其氧化成I2。I2使淀粉变蓝,可以用淀粉检验碘的存在。
2.常用的氧化剂,利于本实验操作的,可以选择哪些?从绿色化学角度来看,哪一种氧化剂最好?请解释原因。提示:氯水、溴水、双氧水都可以。从绿色化学角度来看,双氧水最好。因为双氧水的产物为水,对环境无污染。
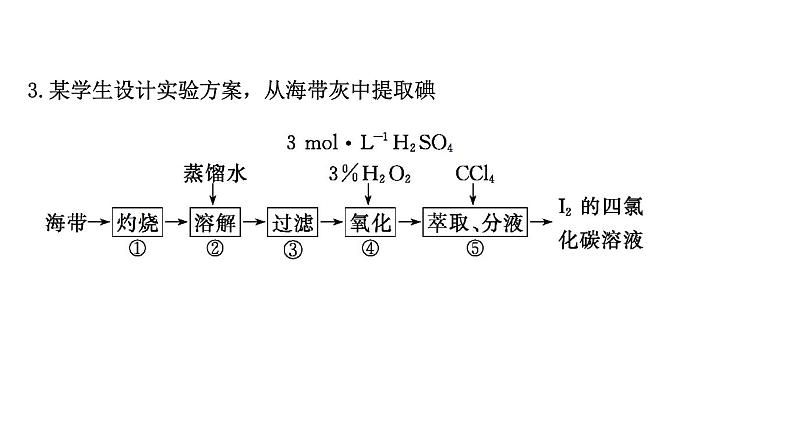
3.某学生设计实验方案,从海带灰中提取碘
(1)在过滤后的滤液中滴加稀硫酸和双氧水后,发生反应的离子方程式是什么?可以发现溶液颜色有什么变化?如果向反应后的溶液中滴加淀粉溶液,会有什么现象?提示:反应的离子方程式是2H++2I-+H2O2====I2+2H2O。碘的水溶液往往呈现棕黄色,故溶液颜色由无色逐渐变为棕黄色。如果向反应后的溶液中滴加淀粉溶液,溶液变为蓝色。
(2)加四氯化碳后振荡并静置,可以看到什么现象?提示:加四氯化碳后振荡并静置,可以看到溶液分层。由于碘单质溶于四氯化碳呈紫红色,四氯化碳密度大于水,因而下层呈紫红色,上层溶液几乎无色。(3)除了四氯化碳以外,是否可以选择苯作为萃取剂呢?可以用酒精作萃取剂吗?请说明理由。提示:可以选择苯作为萃取剂,只不过苯的密度比水小,溶液分层后,有了碘的苯溶液会在上层,上层呈现紫红色,下层几乎为无色。不能选择酒精作萃取剂,因为酒精和水互溶,不分层。
4.萃取是一种什么样的实验操作?选用萃取剂需遵循哪些原则?常用的萃取剂有哪些?提示:萃取是利用溶质在互不相溶的溶剂中的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的实验方法。萃取剂需具备的条件:①溶质在萃取剂中的溶解度比在原溶剂中大; ②萃取剂与原溶剂互不相溶、不反应;③萃取剂不与被提取的溶质发生反应。常用的有机萃取剂有四氯化碳、苯、汽油、酒精、丙酮等。
5.萃取分液所用的主要仪器有哪些?萃取操作有哪些细节要求?提示:萃取分液所用的主要仪器是分液漏斗,同时还需要夹持固定仪器铁架台和铁圈,最后接收分液液体时还需要烧杯。萃取操作要求是①萃取过程中需要充分振荡,要不时地旋开活塞放气,以防止分液漏斗内压强过大造成危险;②当两种液体交界液面降至活塞位置时,适时关闭分液漏斗的活塞。尤其注意的是萃取后分液时,分液漏斗下端要紧靠烧杯内壁,以防液滴飞溅;旋开活塞,用烧杯接收下层液体时,要注意待下层液体恰好流尽时及时关闭分液漏斗的活塞,注意不能让上层液体流出,上层液体应从上口倒出,不允许颠倒出口顺序。
【探究总结】1.海带提碘的工艺流程
2.海带提碘涉及的基本实验操作
【迁移应用】海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器有哪些?(2)过程中步骤③的操作名称是什么?(3)请书写步骤④反应的离子方程式。(4)步骤⑤中,某学生选择用苯来提取碘的理由是什么?(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法。
提示:(1)灼烧海带应在坩埚中进行操作,需要的仪器还有泥三角、坩埚和酒精灯。(2)步骤③是由海带灰的悬浊液得到含碘离子的溶液,为过滤操作。(3)步骤④是酸性条件下,MnO2氧化I-的反应,离子方程式为2I-+MnO2+4H+==== Mn2++I2+2H2O。(4)将碘水中的碘萃取出来,萃取剂应具备的性质是不溶于水,且比水更容易使碘溶解。(5)检验是否还有单质碘,可以通过加入淀粉,观察溶液是否变蓝。
项目活动2 海水提溴【生产情境】浩瀚的海洋里蕴藏着丰富的化学资源,海洋中含有元素80多种,其中氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟称为常量元素,占海水溶解物质总量的99.9% 。其中溴被人们称为“海洋元素”,因为地球上99%的溴都蕴藏在大海中,从海水中提取的溴占世界溴年产量的 左右。工业上,溴大量用于制造燃料的抗爆剂,见光容易分解的溴化银用作感光材料。农业上,制含溴的杀虫剂。医药上NaBr、KBr常被用作镇静剂;红药水的成分是含溴和汞的有机化合物。那么海水中的溴如何提取呢?
【问题探究】1.为了将海水中大量存在的Br-转化为Br2,可以选用什么化学药品?提示:结合卤族元素性质递变规律,可知溴单质的氧化性介于氯和碘之间,因此海水提溴可以选取氯气作氧化剂。
2.海水提溴需要经过哪些步骤?各步骤的作用是什么?提示:一般要经历浓缩、氧化和提取三步。步骤:浓缩——海水中的Br-的浓度很小,大约为0.067 g·L-1,海水晒盐剩下的苦卤中的Br-浓度较大,可作提取溴的原料。氧化——向苦卤中通入氯气。Cl2+2Br- 2Cl-+Br2。提取——向溶有溴的苦卤中鼓入空气和水蒸气,使溴挥发而分离出来。
3.利用空气吹出的溴中含有大量的空气,怎样制得纯溴?涉及的化学方程式有哪些?提示:吹出的气体用浓碱液吸收,然后再加入酸后即可得到纯溴,反应的化学方程式为3Br2+6NaOH====5NaBr+NaBrO3+3H2O,5NaBr+NaBrO3+3H2SO4====3Br2+3Na2SO4+3H2O。
4.利用空气吹出法进行海水提溴的工艺流程过程是怎样的?提示:空气吹出法是用于工业规模海水提溴的常用方法,其实验方法如下:①用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2==== Br2+2NaCl。③向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O====2HBr+H2SO4。④向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2====2HCl+Br2。
⑤用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
【探究总结】1.溴和碘单质性质
【迁移应用】工业上从海水中提取溴可采用如下方法:(1)向海水中通入Cl2,氯气的作用是什么?用离子方程式表示其反应原理。(2)向上述混合液中吹入空气和水蒸气,将生成的溴吹出用什么溶液吸收?其涉及的反应原理是什么?(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用什么试剂提取溴?选择该种试剂的理由是什么?用化学方程式表示该过程产生的副产物。(4)这样得到的溴中还混有少量Cl2,怎样除去?
提示:(1)向海水中通入Cl2,发生的是Cl2氧化Br-的反应,产物为Cl-和Br2。离子方程式为2Br-+Cl2====2Cl-+Br2。(2)向混合液中吹入空气,用纯碱吸收,发生的反应是3Br2+3Na2CO3====5NaBr+NaBrO3+3CO2↑。(3)要提纯单质溴需要加入有机溶剂, 根据溴在有机溶剂中的溶解度大于在水中的溶解度,NaBr、NaBrO3在硫酸溶液中发生归中反应,产物为Br2和Na2SO4,发生的反应是 5NaBr+NaBrO3+3H2SO4====3Na2SO4+3Br2+3H2O 。(4)除去溴中混有的少量Cl2,可以利用卤族单质间的置换反应,通过加入溴化物将氯气还原为Cl-。
1.向盛有少量溴化钾溶液的试管中加入适量的氯水,再加少量四氯化碳,振荡静置后会发现( )A.上层为紫色B.下层呈橙红色C.下层呈紫红色D.上层溶液呈橙色【解析】选B。氯水能把溴化钾氧化为溴单质,溴单质溶于四氯化碳呈橙红色。四氯化碳密度大于水,因而下层呈橙红色,上层溶液几乎无色。
2.海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:某学生在实验室中模拟海水提取溴的步骤为取25 L除去悬浮杂质后的海水,浓缩至2 L,向其中通入足量氯气。
(1)氧化步骤中生成Br2的离子方程式为___________________。 (2)将吹出的Br2(g)用纯碱溶液全部吸收,发生反应:3Br2+3Na2CO3====5NaBr+NaBrO3+3CO2↑ ,产生的CO2通入足量澄清石灰水中,得到1 g白色沉淀。计算海水中溴的浓度为_______ g·L-1。 (3)实验室中若用CCl4提取少量的溴:向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫_______;用到的主要仪器为___________。
【解析】(1)氯气可氧化溴离子:Cl2 + 2Br-====2Cl-+ Br2;(2)根据各步反应,可确定如下关系:Br2~CO2~CaCO3,根据CaCO3的质量可求出原25 L海水中Br2的质量为160 g·ml-1×1 g/100 g·ml-1=1.6 g,则海水中溴的浓度为1.6 g/25 L=0.064 g·L-1;(3)溴易溶于四氯化碳,溶液分层,为萃取、分液操作,可用分液漏斗进行分离。答案:(1)Cl2+2Br-====2Cl-+Br2 (2)0.064 (3)萃取 分液漏斗(烧杯)
3.海藻中提取碘的流程如图:
(1)指出提取碘的过程中有关实验操作名称:①__________,③__________;写出过程②中有关反应的离子方程式__________________。 (2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是________________________。 A.苯、酒精B.四氯化碳、苯C.汽油、醋酸D.汽油、氨水
(3)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是_______。(注:图片中深色区为紫红色溶液) (4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、漏斗、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器,尚缺少的玻璃仪器是___________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图实验装置中的错误之处。
①____________________________________; ②____________________________________; ③____________________________________。
【解析】(1)分离固体和液体用过滤,把碘从水中转移到有机溶剂中用萃取,氯气能氧化碘离子,反应的离子方程式为Cl2+2I-====2Cl-+I2;(2)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶;②对溶质的溶解度要远大于原溶剂,酒精和水互溶,醋酸和水互溶,氨水和水互溶;(3)碘单质从水层进入四氯化碳层,溶液分层,上层颜色接近无色,下层呈紫红色;(4)萃取需要的仪器有分液漏斗(铁架台、烧杯)。(5)烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平,冷凝水应是下进上出。
答案:(1)过滤 萃取 Cl2+2I-====2Cl-+I2(2)B (3)D(4)分液漏斗 (5)①缺石棉网 ②温度计插到了液体中③冷凝管进出水的方向颠倒
4.在已经提取出氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
(1)碘位于元素周期表的第_______族,第_______周期。 (2)步骤①加Fe的目的是_______。 (3)写出步骤②的化学方程式_______。 (4)上述生产流程中,可以利用的副产物是_______,考虑原料循环利用,若将该副产物制成生产所需的试剂,先后还需加入_______来进行处理。 (5)甲物质见光易变黑,其原因是(用化学方程式表示):_______。 (6)分离I2和丁的方法是__________________。
【解析】(1)I的原子序数为53,原子核外有5层电子,最外层电子数为7,位于元素周期表第五周期ⅦA族。(2)富碘卤水中含有I-,加入硝酸银发生:Ag++I-====AgI↓,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2。(3)FeI2具有还原性,与充足的氯气发生氧化还原反应生成I2和FeCl3,反应的化学方程式为2FeI2+3Cl2====2I2+2FeCl3。(4)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液。(6)丁为FeCl3,分离I2和FeCl3溶液的方法是加入苯、汽油、CCl4等有机溶剂进行萃取。
答案:(1)ⅦA 五 (2)使碘化银转化成碘化亚铁(FeI2)和单质银。(3)2FeI2+3Cl2====2I2+2FeCl3(4)Ag 稀硫酸、稀硝酸(5)2AgI 2Ag+I2 (6)萃取
5.海藻含有大量的碘,每1 000 g海藻中含碘5 g左右。实验室中,从海藻里提取碘的部分流程如图。
(1)③的操作名称是________,⑤的操作名称是________________。 (2)试剂b可以是四氯化碳,还可以是__________________(填名称)。 (3)关于⑤的操作步骤,下列说法正确的是__________________(填字母)。 A.振荡液体时,需要倒转分液漏斗B.充分振荡液体后,将分液漏斗放置在铁架台上,立即分液C.分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯D.分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
【解析】(1)操作③为固液不相溶分离操作,故操作名称为过滤;操作⑤为液液不相溶分离操作,故操作名称为萃取、分液;(2)试剂b为萃取剂,本实验中还可选用苯、汽油;(3)操作⑤为萃取、分液,A.振荡液体时,需要倒转分液漏斗,以保证萃取剂与溶质完全接触,提高萃取率,正确;B.充分振荡液体后,将分液漏斗放置在铁架台上,静置,待溶液完全分层时,再进行分液,错误;C.分液时,上层液体从上口倒出,下层液体从分液漏斗下口流出,避免试剂被污染,错误;D.分液时流出下层液体过程中,需将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通,以保证下层液体能顺利流出,错误。
鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件: 这是一份鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件,共39页。PPT课件主要包含了内容索引,素养目标,课前篇素养初探,课堂篇素养提升等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt,共40页。PPT课件主要包含了深红棕,易挥发,易升华,互不相溶等内容,欢迎下载使用。
高中化学第1章 原子结构与元素性质第1节 原子结构模型图文课件ppt: 这是一份高中化学第1章 原子结构与元素性质第1节 原子结构模型图文课件ppt,共38页。PPT课件主要包含了学习目标导航,项目活动1海带提碘,任务分项突破,深红棕,易挥发,易升华,2实验流程,归纳拓展,项目活动2海水提溴,海洋元素等内容,欢迎下载使用。













