




鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用示范课ppt课件
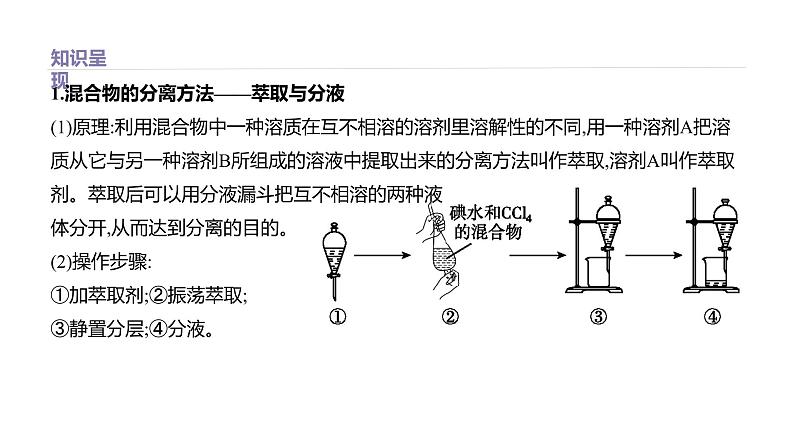
展开1.混合物的分离方法——萃取与分液(1)原理:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂A把溶质从它与另一种溶剂B所组成的溶液中提取出来的分离方法叫作萃取,溶剂A叫作萃取剂。萃取后可以用分液漏斗把互不相溶的两种液体分开,从而达到分离的目的。(2)操作步骤:①加萃取剂;②振荡萃取;③静置分层;④分液。
(3)萃取剂的选择作为萃取剂应具备三个基本条件:①与另一种溶剂互不相溶;②对被萃取的溶质有更大的溶解性;③不与被萃取的溶质发生化学反应。(4)萃取常在分液漏斗中进行操作注意问题:①分液漏斗使用前要检验是否漏水。
②倒转分液漏斗时,应关闭玻璃塞和活塞,防止液体流出;振荡时要不时旋开活塞放气,以防止分液漏斗内压强过大发生危险。③分液时要将分液漏斗上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗颈上的小孔,保证漏斗内与外界大气相通,同时漏斗下端管口要紧贴烧杯内壁,从而使液体顺利流下。④下层液体要从下口放出,上层液体要从漏斗上口倒出。
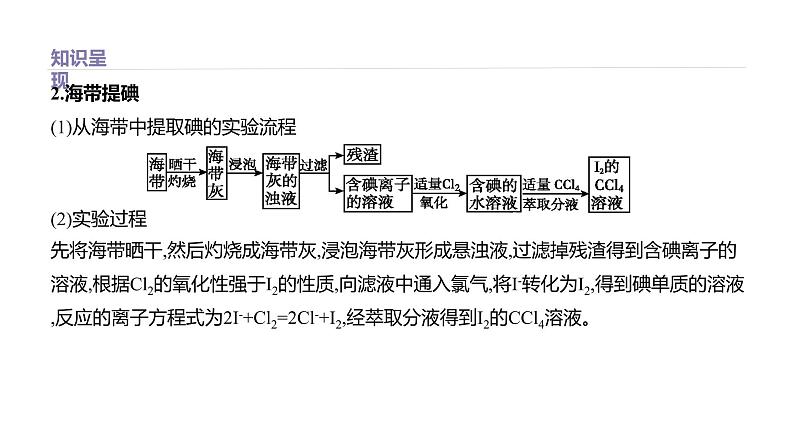
2.海带提碘(1)从海带中提取碘的实验流程(2)实验过程先将海带晒干,然后灼烧成海带灰,浸泡海带灰形成悬浊液,过滤掉残渣得到含碘离子的溶液,根据Cl2的氧化性强于I2的性质,向滤液中通入氯气,将I-转化为I2,得到碘单质的溶液,反应的离子方程式为2I-+Cl2=2Cl-+I2,经萃取分液得到I2的CCl4溶液。
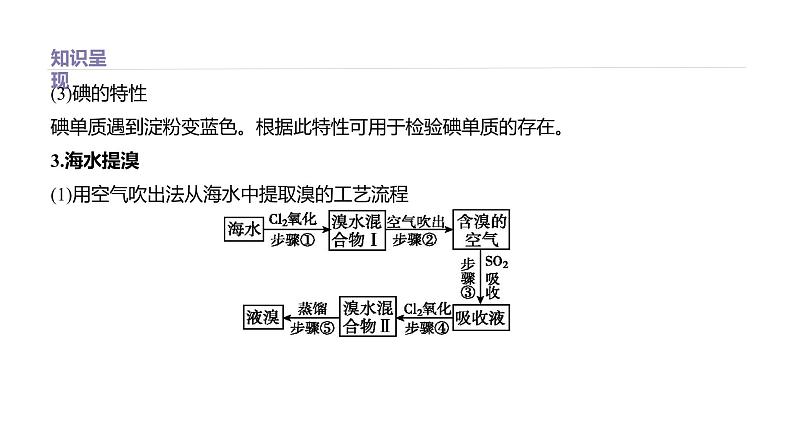
(3)碘的特性碘单质遇到淀粉变蓝色。根据此特性可用于检验碘单质的存在。3.海水提溴(1)用空气吹出法从海水中提取溴的工艺流程
(2)实验过程先将海水酸化浓缩,根据氧化性Cl2>Br2,向浓缩后的海水中通入过量氯气得到粗Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2;溴具有挥发性,向溶液中通入热空气和水蒸气将溴吹出,用二氧化硫吸收,将Br2转化为Br-,反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr;再通入适量的氯气,反应的化学方程式为2HBr+Cl2=2HCl+Br2,最后蒸馏得到精制Br2。
1.若不小心误将水加入你家里的食用花生油里,你将采用下列何种方法分离( )A.过滤 B.分液 C.渗析 D.萃取
[解析] 过滤用于固体和液体分离,A错误;食用花生油和水为互不相溶且密度不同的两种液体,可用分液的方法分离,B正确;渗析用于胶体的精制,C错误;萃取是利用物质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来,食用花生油和水两种物质互不相溶,分层,不用萃取的方法分离,D错误。
2.向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是( )A.NaCl和KIB.NaCl、KCl和I2C.KCl和NaBrD.KCl和NaCl
[解析] 根据氧化还原反应的规律,Cl2先跟还原性强的离子反应,还原性I->Br-,其反应过程为Cl2+2I-=I2+2Cl-,Cl2+2Br-= 2Cl-+Br2,碘单质易升华,溴易挥发,因此通入过量的氯气,将溶液蒸干,灼烧后最后剩余的固体物质是氯化钠和氯化钾。
3.将少量氯气通入KI溶液中,振荡,再加入CCl4,振荡,静置,观察到的现象是( )A.有紫黑色固体析出B.形成均匀的紫红色溶液C.液体分层,下层呈紫红色D.液体分层,上层呈紫红色
[解析] 将少量氯气通入KI溶液中发生的反应为Cl2+2KI=2KCl+I2,碘在水中的溶解度不大,易溶于 CCl4,在反应后的溶液中再加入 CCl4,振荡,静置,观察到的现象为液体分层,下层呈紫红色,故C正确。
4.从海带中提碘要经过灼烧浸取、过滤氧化、萃取、分液、蒸馏等操作,运用下列装置,不能达到相关实验目的的是( ) A B C DA.灼烧碎海带 B.浸取海带灰中的I-C.放出下层的水溶液 D.分离碘,回收苯
[解析] 海带为固体,应该在坩埚内灼烧海带,不能在蒸发皿中灼烧,故A错误;图示装置和操作方法均合理,能够浸取海带灰中的I-,故B正确;
4.从海带中提碘要经过灼烧浸取、过滤氧化、萃取、分液、蒸馏等操作,运用下列装置,不能达到相关实验目的的是( ) A B C DA.灼烧碎海带 B.浸取海带灰中的I-C.放出下层的水溶液 D.分离碘,回收苯
水溶液中碘单质可以用有机溶剂萃取分液的方法分离,图示操作及装置合理,故C正确;碘与苯互溶,利用沸点不同分离,则选择图中蒸馏装置可分离,且温度计的位置、冷水方向均合理,故D正确。
[解析] 固体灼烧应在坩埚中进行,溶液蒸发在蒸发皿中进行,A错误;碘离子被过氧化氢氧化为碘单质,碘元素发生氧化反应, B正确;碘单质遇到淀粉变蓝是碘单质的特性,C正确;
碘单质在水中的溶解度不大,易溶于四氯化碳等有机溶剂,可以用四氯化碳萃取碘水中的碘单质,D正确。
7.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。 A B C DⅠ.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。(1)碳酸钙悬浊液中分离出碳酸钙 。
[解析] 根据装置特点可判断A、B、C、D分别是蒸馏、过滤、分液与蒸发,则碳酸钙悬浊液中分离出碳酸钙需要过滤,答案选B。
(2)氯化钠溶液中分离出氯化钠 。 (3)分离植物油和水 。 (4)分离酒精和水 。 (5)氯化钠溶液中分离出水 。
A B C D
Ⅱ.碘水中提取碘单质的方法为萃取分液(1)下列可作为碘水中提取碘单质萃取剂的有 。A.酒精 B.苯
(2)分液漏斗在使用前必须先 。
(3)查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用(1)中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的 端口放出,有机层应由分液漏斗的 端口倒出。(填“上”或“下”)
8.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示: (1)写出步骤Ⅰ中生成低浓度Br2的离子方程式: 。
Cl2+2Br-=Br2+2Cl-
[解析]步骤Ⅰ中生成低浓度Br2,涉及氯气与溴的置换反应,反应的离子方程式为Cl2+2Br-=Br2+2Cl-。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式: 。
Br2+SO2+2H2O=2HBr+H2SO4
[解析]步骤Ⅰ中已获得Br2,步骤Ⅱ中又用SO2将Br2还原为Br-,二氧化硫吸收溴单质发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr。
(3)在3 mL溴水中加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图中的 。
[解析]四氯化碳的密度比水大,且溴易溶于四氯化碳,由体积关系可知D正确。
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们设计了如图所示的装置简图。请你参与分析讨论:①C中液体产物颜色为 。
[解析] C中得到的液体为溴,颜色为深红棕色。
②整套装置中均不能使用橡皮管和橡胶塞的原因是 。
[解析]溴具有腐蚀性,能腐蚀橡胶,所以不能用橡胶管和橡胶塞。
鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件: 这是一份鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件,共39页。PPT课件主要包含了内容索引,素养目标,课前篇素养初探,课堂篇素养提升等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt,共40页。PPT课件主要包含了深红棕,易挥发,易升华,互不相溶等内容,欢迎下载使用。
高中化学第1章 原子结构与元素性质第1节 原子结构模型图文课件ppt: 这是一份高中化学第1章 原子结构与元素性质第1节 原子结构模型图文课件ppt,共38页。PPT课件主要包含了学习目标导航,项目活动1海带提碘,任务分项突破,深红棕,易挥发,易升华,2实验流程,归纳拓展,项目活动2海水提溴,海洋元素等内容,欢迎下载使用。













