

人教版九年级上册课题 2 如何正确书写化学方程式单元测试巩固练习
展开第五单元《化学方程式》
一、选择题
1.某化合物由两种元素组成,它在空气中完全燃烧时,只生成水和二氧化碳。根据质量守恒定律,该化合物( )
A.由氮元素和氢元素组成 B.由碳元素和氧元素组成
C.由氢元素和氧元素组成 D.由碳元素和氢元素组成
2.下列各组物质反应后溶液的总质量减少的是( )
A.少量二氧化碳通入氢氧化钠溶液
B.少量二氧化碳通入氢氧化钙溶液
C.碳酸钙中加入稀盐酸
D.锌粒中加入硫酸铜溶液
3.下列对化学符号中数字“2”表示的意义,解释正确的是( )
A. SO2:“2”表示二氧化硫中含有两个氧原子
B. 2Ca:“2”表示两个钙原子
C. Mg :“+2”表示每个镁离子带两个单位正电荷
D. O2- :“2–”表示氧元素的化合价为负二价
4.元素R的氧化物化学式为R2O3,若R的化合价不变,下列化学式错误的是( )
A. R2(SO4)3 B. R(NO3)3 C. RCl2 D. R(OH)3
5.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法不正确的是( )
A.W可能是单质 B.Y可能是催化剂
C.该反应是分解反应 D.反应后Z物质的质量为86.4g
6.离子方程式:2Ca2++3HCO3﹣+3OH﹣→2CaCO3↓+CO32﹣+3H2O可以表示( )
A.Ca(HCO3)2与NaOH溶液反应
B.NaHCO3与澄清石灰水反应
C.Ca(HCO3)2与澄清石灰水反应
D.NH4HCO3与澄清石灰水反应
7.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图.下列说法中不正确的是( )
A.该反应为分解反应
B.丙可能为该反应的催化剂
C.参加反应的乙、丁质量比为3:2
D.丁相对分子质量是甲的2倍
8.在化学方程式CO2+3H2R+H2O中,则R的化学式是( )
A.CH4O B.CH4 C.CO D.CH2O2
9.在实验室中,不能用带磨口玻璃塞的玻璃试剂瓶盛装氢氧化钠溶液,因为氢氧化钠会与玻璃成分中的某种物质X发生化学反应,使玻璃塞和玻璃试剂瓶口粘连在一起,其反应的化学方程式为:X+2NaOH═Na2SiO3+H2O,则X的化学式为( )
A.H2SiO3 B.SiO2 C.Si D.SiH4
10.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:( )
下列说法错误的是( )
A.a和b是反应物,d可能是催化剂
B.反应后a物质的质量为4.64g
C.c物质中元素种类,一定等于a、b两种物质中元素的种类
D.若物质a与物质b的相对分子质量比为2:1,则反应中a与b的化学计量数比为2:1
11.在汽车尾气系统中安装催化转化器,可有效降低尾气中污染物的排放,发生反应的化学方程式为2CO+2R2CO2+N2。则R的化学式是( )
A.NO B.NO2 C.N2O3 D.N2O5
12.一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应进行到一定程度后,测得数据见下表.下列说法中正确的是( )
A.该反应是化合反应
B.x=9g
C.在该反应中,丙物质一定做催化剂
D.在该反应中,甲丁的质量比为1:1
13.根据化学方程式:2H2O 2H2↑+O2↑,无法获取的信息是( )
A.反应所需条件 B.生成物的状态 C.生成物的物质的量之比 D.氧气可助燃
14.在反应X + 2Y = R + 2M中,已知R和M的相对原子质量比为22:9,当1.6 gX与Y完全反应后,生成4.4 gR,则在反应中Y与M的质量比为
A.12:9 B.23:9 C.32:9 D.16:9
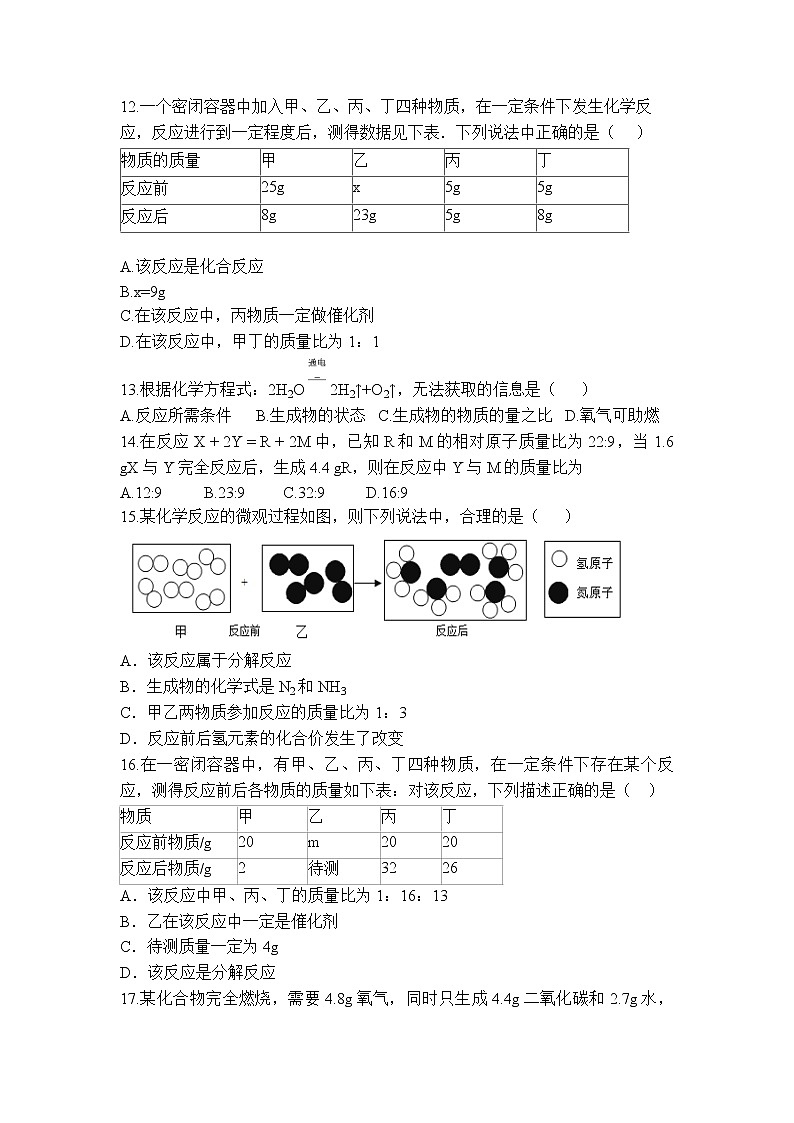
15.某化学反应的微观过程如图,则下列说法中,合理的是( )
A.该反应属于分解反应
B.生成物的化学式是N2和NH3
C.甲乙两物质参加反应的质量比为1:3
D.反应前后氢元素的化合价发生了改变
16.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:对该反应,下列描述正确的是( )
A.该反应中甲、丙、丁的质量比为1:16:13
B.乙在该反应中一定是催化剂
C.待测质量一定为4g
D.该反应是分解反应
17.某化合物完全燃烧,需要4.8g氧气,同时只生成4.4g二氧化碳和2.7g水,则该化合物中( )
A.只含有碳、氢两种元素 B.含有碳、氢、氧三种元素
C.一定含有碳、氢两种元素,可能含有氧元素 D.无法确定
18.能达到目的实验是 ( )
A. A B. B C. C D. D
19.将ag铁和碳的混合物在氧气中充分灼烧,冷却,称量,发现剩余固体的质量仍为ag,该混合物中碳的质量分数为( )
A.30.0% B.22.2% C.27.6% D.10.3%
20.某一个危险品仓库的硝酸铵发生爆炸,造成很大的财物损失.硝酸铵在约200℃时发生如下反应:NH4NO3=X+2H2O,则X的化学式为( )
A.NO B.N2 C.N02 D.N20
二、实验探究题
21.冬季取暖人们常用到暖宝宝(如图),其热量来源于铁的缓慢氧化。化学小组的同学突发奇想,想利用暖宝宝测定空气中氧气的含量。
【查阅资料】
(1)暖宝宝的主要成分铁粉、木炭、食盐。
(2)暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁,反应的化学方程式为_________________。
【设计实验】化学小组的同学设计了图1所示装置。
【实验步骤】①检查装置气密性
②向250mL集气瓶中加入20mL水
③读取温度计示数为18C,撕掉暖宝宝上的贴纸,塞紧橡胶塞。
④观察温度计示数的变化
⑤待温度计示数为18C时,打开止水夹。
请回答下列问题:
(1)检查装置气密性的方法是_________________;
(2)小组同学的设计中,集气瓶内水的作用是______________;
(3)实验结果如图2所示,根据图示数据计算得出氧气的体积分数约为_______________。
【实验反思】你认为小组同学实验产生误差的可能原因有_________________(写出一条即可)。你证明这确实是造成误差原因的方案是_______________。
三、简答题
22.下图是甲、乙两组同学分别设计的质量守恒定律的两个验证实验。请根据图示进行思考回答(假设甲、乙两组药品混合前质量均为m前、混合后质量均为m后):
①甲组药品混合前、后质量关系为:m前>m后,请解释原因___________________,该实验若试剂不变,应如何改进此装置_____________________; ②乙组药品混合前、后质量关系为:m前=m后,乙组同学认为实验成功,甲组同学认为该实验不能验证质量守恒定律,原因是_________________________。
23.把握微观世界,了解物质构成的奥秘,能帮助我们更好的认识物质变化的本质。如图是某化学反应的微观模拟图:
(1)反应物中的单质的化学式为_____,该反应的化学方程式为______________________,属于________反应(填基本反应类型)
(2)通过该图你能获得的信息有_____________________________________。
参考答案
1.D
【解析】已知化合物由两种元素组成,且燃烧后生成水和二氧化碳,根据质量守恒定律,化学反应前后元素的种类不变,故该化合物由碳元素和氢元素组成.
故选D
2.B
【解析】A、少量二氧化碳通入氢氧化钠溶液会生成碳酸钠和水,溶液的质量会增加(增加值为二氧化碳的质量);
B、由于二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,而沉淀的质量大于二氧化碳的质量,所以溶液质量会减小;
C、碳酸钙与盐酸反应会生成氯化钙和二氧化碳,由于溶液中溶解的氯化钙的质量大于排放出的二氧化碳的质量,所以溶液质量会减小;
D、锌的活动性比铜强,而锌的原子量大于铜,所以锌粒能置换出硫酸铜中的铜,反应前为硫酸铜溶液,锌和硫酸铜溶液反应生成硫酸锌和铜,每65份质量的锌反应将生成64份质量的铜,则溶液质量减少;
故选B
A、依据两者之间的反应情况分析解答;
B、依据两者反应会生成碳酸钙沉淀分析解答;
C、依据碳酸钙与盐酸反应会生成氯化钙和二氧化碳分析判断;
D、依据锌粒能置换出硫酸铜中的铜的质量变化分析解答;此题是对溶液反应知识的考查,解题的关键是对溶液质量变化的分析,属于基础性知识的考查题.
3.B
【解析】元素符号的前边加数字表示原子的个数;化学式中元素符号右下角的数字为一个分子中原子的个数。元素符号右上角的数字表示一个离子带电荷的数值,化学式前边的数字表示分子的个数。元素符号正上方的数字为元素的化合价;所以A. SO2:“2”表示一个二氧化硫中含有两个氧原子B. 2Ca:“2”表示两个钙原子C. Mg 2+:“+2”表示每个镁离子带两个单位正电荷D. O2- :“2–”表示一个氧离子带两个单位负电荷, 表示氧元素的化合价为负二价。选B
4.C
【解析】化合物中元素的化合价代数和为零,元素R的氧化物化学式为R2O3,氧元素显-2价,设R的化合价为x,2x+(-2)×3=0,x=+3,硫酸根显-2价,硝酸根显-1价,氯元素显-1价,氢氧根显-1,若R的化合价不变,R和氯形成的化合物为RCl3。选C
5.D
【解析】设待测值为X,根据质量守恒定律,参加反应前各物质的质量总和=反应后生成各物质的质量总和,结合表格中的数值,则10+3+90+0=3.2+3+X+3.2,解得X=93.6克.分析质量的变化:X质量减少,Y质量不变,Z质量增加,W质量增加.质量增加的为生成物,质量减少的为反应物.
A、W可能是单质,说法正确,故A正确;
B、Y质量不变,符合催化剂的“一变二不变”的特点,所以可能是催化剂,说法正确,故B正确;
C、X反应生成Z和W,反应符合“一变多”,所以该反应是分解反应,说法正确,故C正确;
D、根据质量守恒定律,解得反应后Z物质的质量为93.6克,所以说法不正确,故D错误.
故选D.
根据质量守恒定律,参加反应前各物质的质量总和=反应后生成各物质的质量总和,结合表格中的数值,则待测值;从而判断反应物,生成物;再判定反应类型;掌握催化剂的“一变二不变”的特点.
6.A,B
【解析】A、2ml碳酸氢钙与3ml氢氧化钠反应生成碳酸钙、碳酸钠、碳酸氢钠和水,离子方程式为:2Ca2++3HCO3﹣+3OH﹣→2CaCO3↓+CO32﹣+3H2O,故A正确;
B、2ml氢氧化钙和3ml碳酸氢钠反应会生成碳酸钙、碳酸钠、碳酸氢钠和水,离子方程式为:2Ca2++3HCO3﹣+3OH﹣→2CaCO3↓+CO32﹣+3H2O,故B正确;
C、碳酸氢钙和澄清石灰水反应生成碳酸钙沉淀和水、离子方程式为:Ca2++HCO3﹣+OH﹣→CaCO3↓+H2O,故C错误;
D、碳酸氢铵和氢氧化钙反应生成碳酸钙沉淀、水和氨气,离子方程式为:Ca2++HCO3﹣+NH4++2OH﹣→CaCO3↓+NH3↑+2H2O,故D错误.
故选:AB.
A、根据2ml碳酸氢钙与3ml氢氧化钠反应生成碳酸钙、碳酸钠、碳酸氢钠和水进行分析;
B、根据2ml氢氧化钙和3ml碳酸氢钠反应会生成碳酸钙、碳酸钠、碳酸氢钠和水进行分析;
C、根据碳酸氢钙和澄清石灰水反应生成碳酸钙沉淀和水进行分析;
D、根据碳酸氢铵和氢氧化钙反应生成碳酸钙沉淀、水和氨气进行分析.
7.D
【解析】根据质量守恒定律,反应后丙的质量为:4g+10g+3g+4g﹣(6g+4g+8g)=3g,故乙为反应物,甲、丁为生成物,丙可能为催化剂,该反应为分解反应,
A、该反应为分解反应,故正确;
B、丙可能为催化剂,故正确;
C、参加反应的乙、丁质量比为:(10g﹣4g):(8g﹣4g)=3:2,故正确;
D、生成甲、丁的质量比为:(6g﹣4g):(8g﹣4g)=1:2,由于未知反应的化学方程式中的化学计量数,故无法确定甲、丁的相对分子质量比,故错误.
故选D.
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.反应后质量增加的是生成物,减少的是反应物,据此分析.
8.A
【解析】根据反应的化学方程式CO2+3H2R+H2O和质量守恒定律可知,反应物中总共有1个碳原子、2个氧原子和6个氢原子,而生成物中只有2个氢原子和1个氧原子,还少1个碳原子、1个氧原子和4个氢原子,则每个R分子由1个碳原子、1个氧原子和4个氢原子构成,因此R的化学式为CH4O.
故选:A.
由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物R的化学式.
9.B
【解析】根据反应的化学方程式X+2NaOH═Na2SiO3+H2O,反应物中O、Na、H原子个数分别为2、2、2,反应后的生成物中Si、O、Na、H原子个数分别为1、4、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个O原子和1个Si原子构成,则物质X的化学式为SiO2 .
故选B.
由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
10.B
【解析】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.反应后质量增加的是生成物,减少的是反应物,由表格 信息可知反应后c质量增加了3.2克,是生成物;b质量减少了0.64克,是反应物;d质量不变,做催化剂或者是杂质.反应物还少2.56克,所以a是反 应物,所以反应后物质a的质量为3.84g,反应物是a和b,生成物是c,所以是化合反应,c物质中元素的种类,一定等于a、b二种物质中元素的种类;物 质a与物质b的质量比为2.56:0.64=4:1;若物质a与物质b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为2:1,从而可以解 答.
A、由表格信息可知反应后c质量增加了3.2克,是生成物;b质量减少了0.64克,是反应物;d质量不变,可能是做催化剂,也可能是杂质,故A说法正确;
B、根据A分析,反应物还少2.56克,所以a是反应物,所以反应后物质a的质量为6.4g-2.56g=3.84g,故B说法错误;
C、反应物是a和b,生成物是c,所以此反应是化合反应,c物质中元素的种类,一定等于a、b二种物质中元素的种类,故C说法正确;
D、物质a与物质b的质量比为2.56:0.64=4:1,若物质a与物质b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比应为2:1,故D说法正确.
故选B.
11.A
【解析】由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R化学式.
根据反应的化学方程式2CO+2R2CO2+N2 , 反应物中碳、氧原子个数分别为2、2,反应后的生成物中碳、氧、氮原子个数分别为2、4、2,根据反应前后原子种类、数目不变,则2R含有2个氮原子和2个氧原子,则每个R的分子由1个氮原子和1个氧原子构成,则物质R的化学式为NO.
故选A.
12.B
【解析】A、根据甲、乙、丙、丁四种物质反应前后质量的变化可知甲为反应物,乙、丁为生成物,故该反应为:甲→乙+丁,属于分解反应,故A错误.
B、根据质量守恒定律:反应前物质的总质量=反应后物质的总质量可知25+x+5+5=8+23+5+8,x=9g,故B正确;
C、丙物质反应前后质量没有变化,该物质可能没有参加反应或者是该反应的催化剂,故C错误;
D、该题不能确定丙、丁的化学计量数比因为丙物质可能没有参加反应或者是该反应的催化剂,故D错误.
故选B.
首先根据质量守恒定律:反应前物质的总质量=反应后物质的总质量求出X的数值.然后根据甲、乙、丙、丁四种物质反应前后质量的变化确定出反应物和生成物(即反应后质量增加的为生成物,反应后质量减少的为反应物.),进而判断出该反应的类型.丙物质反应前后质量不变,可能是催化剂或者是没有参加反应,故对丙来说更无需谈化学计量数了.
13.D
【解析】A.根据该化学方程式可知,此反应条件是通电,故不合题意; B.由生成物化学式后的气体符号可知,生成物是气体,故不合题意;
C.由化学方程式可知,生成的氢气与氧气的物质的量之比即为化学计量数之比,即2:1,故不合题意;
D.在该反应中,氧气是生成物,所以此方程式不能体现氧气的助燃性,故符合题意.
故选D.
化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等,据此进行分析解答.
14.D
【解析】欲计算Y与M的质量比,必须要计算出Y与M的质量,根据已知条件“R和M的相对分子质量之比为22:9”,则化学方程式中R和M的质量比为:R:2M=22:(2×9)=22:18,
设生成的M的质量为a,
则22:18=4.4g:a,
解之得:a=3.6g;
根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g;
所以此反应中Y和M的质量比是6.4g:3.6g=16:9.
15.D
【解析】A、根据化学反应的微观过程图,该反应由两种物质生成一种物质,属于化合反应,错误,B、根据微观示意图,生成物只有氨气,化学式是:NH3,N2是反应物,过量,错误,C、该反应的方程式为:3H2+N2= 2NH3,故甲乙两物质参加反应的质量比为6:28=3:14,错误,D、根据元素化合价的一般规律:单质中,元素化合价为0,在化合物中,正负化合价的代数和为0,故反应前后氢元素的化合价发生了改变,正确,故选D
16.D
【解析】根据质量守恒定律和表格中的数据,可知:
A、根据各物质反应前后质量的变化可知甲为反应物,丙、丁为生成物.故该反应为:甲、丙、丁的质量比为(20g﹣2g):(32g﹣20g):(26g﹣20g)=18g:12g:6g=3:2:1,所以不正确.
B、该反应参加的甲的质量为20g﹣2g=18g,生成的为丙的质量为32g﹣20g=12g、丁的质量为26g﹣20g=6g,故乙的质量反应前后不变,故可能是催化剂,也可能没有参加,所以不正确.
C、乙的质量反应前后不变,但由于反应前乙的质量未知,故待测质量不一定为4g,所以不正确.
D、由于乙的质量反应前后不变,所以该反应的反应物为甲,生成物为丙和丁,故该反应为分解反应,所以正确. 故选:D.
17.B
【解析】化学反应遵守质量守恒定律,那么一定含C、 H 可能含O;4.4gCO2中含m(C)=1.2g,2.7gH2O中含m(H)= 0.3g。该化合物的质量=4.4g+2.7g-4.8g=2.3g,那么其含m(O)=2.3g—1.2g—0.3g=0.8g,说明含有氧元素。那么该化合物肯定含有碳、氢、氧三种元素。
18.C
【解析】A、对照试验要控制变量,一个放二氧化锰,一个不放二氧化锰,但是过氧化氢溶液浓度不同,不能形成对照,所以不能达到实验目的,故正确;
B、碳酸钙和盐酸反应会生成二氧化碳,验证质量守恒定律应该在密闭容器内进行实验,故错误;
C、电解水是产生氧气和氢气,生成的氢气是由氢元素组成的,氧气是由氧元素组成的,由质量守恒定律,反应前后元素种类不变,则该实验证明水是由氢、氧两种元素组成的,故正确;
D、氯化钠、硝酸钾均易溶于水,不能用过滤的方法除去氯化钠溶液中的硝酸钾,故错误。
19.C
【解析】由题意可知,铁和碳的混合物在氧气中充分灼烧,铁与氧气反应生成了四氧化三铁,固体质量增加了,碳与氧气反应生成了二氧化碳,固体的质量减少了.由剩余固体的质量不变可知,参加反应的氧气的质量等于混合物中碳的质量,该混合物中碳的质量分数即为四氧化三铁中氧元素的质量分数.
四氧化三铁中氧元素的质量分数是: =27.6%
由以上计算可知,A、B、D不符合题意,C符合题意。
故答案为:C。
20.D
【解析】由反应的化学方程式NH4NO3═X+2H2O,反应前NH4NO3中N、H、O原子个数分别为2、4、3,反应后2H2O中仅含H、O原子的个数分别为4、2,根据化学变化前后原子的种类、数目不变,可判断生成物X的分子由2个N原子、1个O原子构成,物质X的化学式为N2O;
故答案为:D.
21. 4Fe+6H2O+3O2=4Fe(OH)3 将导管放入水中,双手捂住集气瓶,观察到有气泡冒出,松开手,导管内有液柱,证明气密性良好 19.1% 铁粉生锈提供水分 暖贴内铁粉的量不够,O2没有完全被消耗 取使用后的样品少量于烧杯中,加入足量的水溶解、过滤,向滤液中滴加硝酸银溶液生成白色沉淀
【解析】【查阅资料】(2)根据描述可知该反应的反应物是铁粉与氧气、水,生成物是氢氧化铁,反应的化学方程式表示为:4Fe+6H2O+3O2=4Fe(OH)3;【实验步骤】(1)检查该装置气密性的方法是:将导管浸水中,双手握住集气瓶,观察到有气泡冒出,松开手,导管内有液柱,证明气密性良好;(2)铁生锈需要水,故集气瓶中水的作用是为铁粉生锈提供水分;(3)该实验的原理是铁生锈消耗氧气导致集气瓶中的压强变小,集气瓶中进入的水的体积即为空气中氧气的体积。由图示数可知,进入集气瓶中水的体积=100ml-55ml=45ml,空气的总体积=250ml-20mL=230ml,氧气的体积分数= =19.6%;【实验反思】空气中,氧气约占空气总体积的21%,先测定的氧气的体积分数偏小,原因可能是暖贴内铁粉的量不够导致O2没有完全被消耗;可取两片暖宝宝重复上述实验,若进入的水的体积更多,说明是铁粉不足导致测得的氧气的体积分数变小。
22. 反应生成的CO2气体从烧杯中逸出,总质量减少 将烧杯改成密闭容器 因为两种药品未参加化学反应,所以不能验证质量守恒定律
【解析】①甲组药品混合前、后质量关系为:m前>m后,原因是反应后生成的CO2气体逸出;该实验若试剂不变,应将烧杯改成密闭容器;②氯化钡和硝酸钠溶液不发生化学反应,所以不能验证质量守恒定律。
23. C C+ NH32N2+3CH4 置换反应 分子可分而原子不可分(或者原子是化学变化中的最小粒子或化学反应前后元素种类不变)
【解析】(1)根据化学反应的微观模拟图可知,反应物中单质的是碳,该反应的化学方程式为: ;反应是一种单质和一种化合物反应生成一种单质和一种化合物,故是置换反应;(2)通过图示可知,在化学反应中,分子可分而原子不可分(或者原子是化学变化中的最小粒子或化学反应前后元素种类不变)。
物质
X
Y
Z
W
反应前质量/g
10
3
90
0
反应后质量/g
3.2
3
待测
3.2
物质
a
b
c
d
反应前质量(g)
6.4
3.2
4.0
0.5
反应后质量(g)
待测
2.56
7.2
0.5
物质的质量
甲
乙
丙
丁
反应前
25g
x
5g
5g
反应后
8g
23g
5g
8g
物质
甲
乙
丙
丁
反应前物质/g
20
m
20
20
反应后物质/g
2
待测
32
26
A. 探究MnO2对反应速率的影响
B. 验证化学反应前后质量守恒
C. 测定水的组成
D. 除去氯化钠溶液中混有的硝酸钾
化学第五单元 化学方程式综合与测试同步练习题: 这是一份化学第五单元 化学方程式综合与测试同步练习题,共8页。试卷主要包含了选择题,综合题等内容,欢迎下载使用。
初中化学人教版九年级上册第五单元 化学方程式综合与测试单元测试同步练习题: 这是一份初中化学人教版九年级上册第五单元 化学方程式综合与测试单元测试同步练习题,共19页。试卷主要包含了单选题,填空题,推断题,实验题,计算题等内容,欢迎下载使用。
化学九年级上册第五单元 化学方程式综合与测试单元测试同步达标检测题: 这是一份化学九年级上册第五单元 化学方程式综合与测试单元测试同步达标检测题,共4页。试卷主要包含了选择题,填空题,写出或配平下列反应的化学方程式,实验题,计算题等内容,欢迎下载使用。














