





初中化学课题3 制取氧气示范课课件ppt
展开4.掌握实验室制取氧气的操作方法及注意事项。
1.掌握实验室制氧气的三种反应原理。
2.理解催化剂及催化作用。
1.实验室制氧气的三种反应原理。
2.实验室制取氧气的操作方法及注意事项。
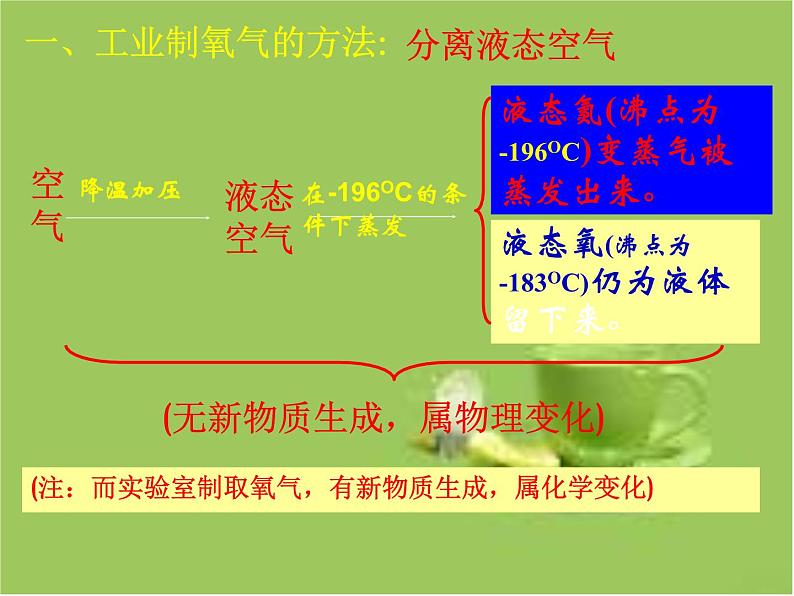
一、工业制氧气的方法:
(无新物质生成,属物理变化)
液态氮(沸点为-196OC)变蒸气被蒸发出来。
液态氧(沸点为-183OC)仍为液体留下来。
(注:而实验室制取氧气,有新物质生成,属化学变化)
1、加热高锰酸钾(KMnO4)2、分解过氧化氢(H2O2 )3、加热氯酸钾(KClO3)
方法一:加热高锰酸钾制取氧气实验2—5
原料:高锰酸钾(暗紫色固体)文字表达式:
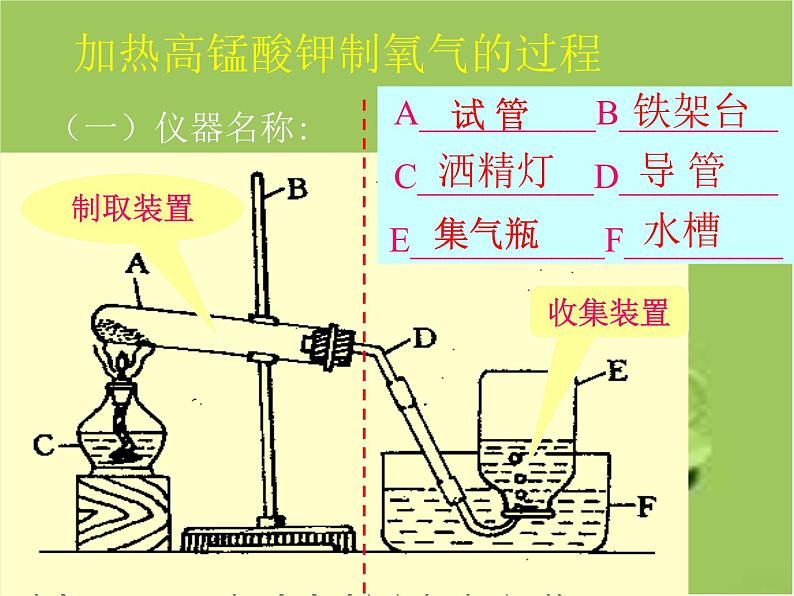
A__________B_________C__________D_________E___________F_________
加热高锰酸钾制氧气的过程
1、检:检查装置的气密性;
2、装:装入药品( 药品应平铺在试管底部)
6、移:将导管移离水面
(氧气的密度比空气大)
3、固:固定试管(试管口应略低于试管底部)
1.易于收集到较纯的气体 2.便于观察气体是否已经收集满
将带火星的木条放在集气瓶口,如果木条复燃,说明已经集满。
4、放置方法 正放在桌子上,并盖上毛玻璃片
1、固定试管时,为什么试管口要略低于试管底部?
防止冷凝水回流到热的试管底部,炸裂试管
2、用排水集气法应什么时候开始收集?
当气泡连续均匀放出时开始收集;
(哪种方法得到的氧气更纯?
3、实验结束时应先将导管移离水面,还是先停止加热,为什么?
先将导管移离水面,后停止加热,否则水将沿导管倒流回热的试管底部,炸裂试管
用排水法收集的气体更纯)
4.用高锰酸钾制氧气时,为什么要在试管口塞一团棉花?
可以防止加热时高锰酸钾粉末进入导管
方法二:分解过氧化氢制取氧气
步骤1:在常温下,把带火星的木条伸入盛有过氧化氢溶液的试管,观察木条实验现象
步骤2:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
在常温下过氧化氢溶液遇到二氧化锰迅速产生氧气。
步骤3:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。
二氧化锰仍然起作用 。
2H2O2 = 2H2O + O2↑
催化剂:能改变其它物质的化学反应速率,而本身的质量和化学性质在化学反应 前后都没有改变的物质。
下列有关催化剂的说法正确的是( ) A、在化学反应中加快其他物质的反应速率,而本身的质量和性质在化学反应前后均不改变的物质称为催化剂B、二氧化锰是催化剂 C、在化学反应中改变其他物质的反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质称为催化剂 D、要使过氧化氢溶液分解出氧气,必须加入二氧化锰,否则就不能发生分解反应
方法三、加热氯酸钾制氧气
原料:氯酸钾(白色固体)
方法:在一定条件下加热
小结:1:实验室制氧气的反应原理
上述三个制取氧气的反应有什么共同的特征?与化合反应有什么不同?
都是由一种物质生成两种或两种以上其他物质。
⑴定义:由一种反应物生成两种或两种以上其它物质的反应。
⑵判断方法:反应物为一种,生成物至少为两种。
例题:下列反应中属于分解反应的是( )
A、氧化汞 → 汞 + 氧气B、碱式碳酸铜 → 氧化铜 + 水 + 二氧化碳C、铁+硫酸铜 → 硫酸亚铁 + 铜D、蜡烛+氧气 → 水 + 二氧化碳
随堂检测1.工业上制取大量氧气的方法是 ( )(A)加热氯酸钾 (B)加热高锰酸钾(C)分离液态空气 (D)加热二氧化锰2.催化剂在化学反应中所起的作用是( )(A)加快化学反应速率 (B)使生成物质量增加(C)改变化学反应速率 (D)减慢化学反应速率
3.实验室制取氧气时,装药品的大试管口应 ( )(A)朝下 (B)朝上 (C)略向下倾斜 (D)略向上倾斜4.实验室采用排水法收集氧气时,需将导气管伸入盛满水的集气瓶,这个操作应在( )(A)加热固体药品前 (B)与加热固体药品同时(C)开始有气泡放出时 (D)气泡连续并均匀放出时
初中化学课题3 制取氧气课堂教学课件ppt: 这是一份初中化学课题3 制取氧气课堂教学课件ppt,共60页。PPT课件主要包含了H2O2,反应原理,仪器名称,想想看,①查②装,检验与验满等内容,欢迎下载使用。
化学九年级上册课题3 制取氧气课文内容课件ppt: 这是一份化学九年级上册课题3 制取氧气课文内容课件ppt,
人教版九年级上册第二单元 我们周围的空气课题3 制取氧气教学演示ppt课件: 这是一份人教版九年级上册第二单元 我们周围的空气课题3 制取氧气教学演示ppt课件,














