

还剩11页未读,
继续阅读
四川省成都七中2021届高三上学期入学考试 化学(含答案)
展开
成都七中 2021 届高三上期入学考试
化学试题
满分 100 分 时间 100 分钟
本试卷分第I 卷(选择题)和第II 卷(非选择题)两部分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Ca—40
第 I 卷 (选择题 共 60 分)
包括 20 小题,每小题 3 分,共 60 分。每小题只有一个选项符合题意。
一、单选题
1.下列物质与危险化学品标志的对应关系不正确的是
A
B
C
D
酒精
氢气
NaOH 溶液
Cu
A.A B.B C.C D.D
2.能正确表示下列反应的离子方程式是
A.向次氯酸钠溶液中通入足量 SO2 气体:ClO-+SO2+H2O=HClO+HSO3-
B.0.1 mol/L NH4Al(SO4)2 溶液与 0.2 mol/L Ba(OH)2 溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4 溶液与H2O2 反应,证明H2O2 具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.Fe2O3 溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
3.设NA 表示阿伏加德罗常数的值。下列叙述正确的是( )
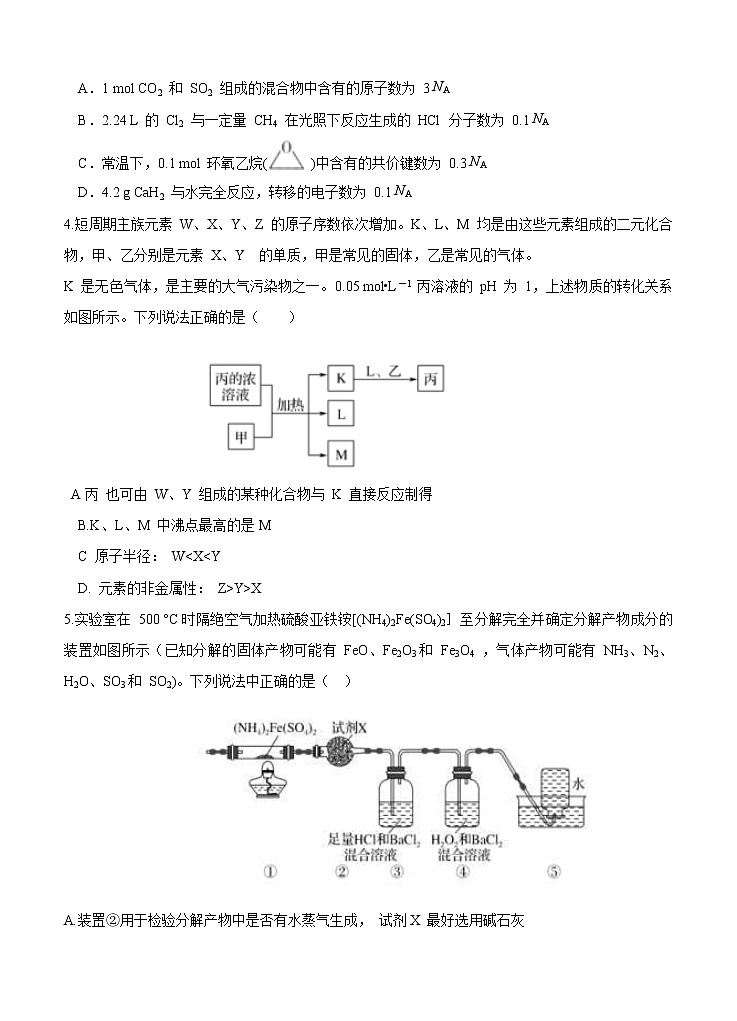
A.1 mol CO2 和 SO2 组成的混合物中含有的原子数为 3 NA
B.2.24 L 的 Cl2 与一定量 CH4 在光照下反应生成的 HCl 分子数为 0.1 NA
C.常温下,0.1 mol 环氧乙烷( )中含有的共价键数为 0.3 NA
D.4.2 g CaH2 与水完全反应,转移的电子数为 0.1 NA
4.短周期主族元素 W、X、Y、Z 的原子序数依次增加。K、L、M 均是由这些元素组成的二元化合物,甲、乙分别是元素 X、Y 的单质,甲是常见的固体,乙是常见的气体。
K 是无色气体,是主要的大气污染物之一。0.05 mol•L-1 丙溶液的 pH 为 1,上述物质的转化关系如图所示。下列说法正确的是( )
A丙 也可由 W、Y 组成的某种化合物与 K 直接反应制得
B.K、L、M 中沸点最高的是M
C 原子半径: W
5.实验室在 500 °C时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有 FeO、Fe2O3和 Fe3O4 ,气体产物可能有 NH3、N2、H2O、SO3和 SO2)。下列说法中正确的是( )
A.装置②用于检验分解产物中是否有水蒸气生成, 试剂X 最好选用碱石灰
B.装置③用于检验分解产物中是否有SO3 气体生成并除去SO3 和 NH3
C.取①中固体残留物与稀硫酸反应并滴加 KSCN 溶液, 溶液变红色, 则残留物一定为
Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成, 装置⑤用于收集生成的 NH3 和N2
6.H2 与 ICl 的反应分①、②两步进行, 其能量曲线如图所示, 下列错误的是()
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢, 与相应正反应的活化能无关
D.反应①、反应②的焓变之和为ΔH= —218 kJ•mol-1
7.下列实验中 , 所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去 KNO3 固体中混杂的NaCl
重结晶
NaCl 在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
8.下列有关有机物的说法正确的是( )
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1 mol 苹果酸[HOOCCH(OH)CH2COOH]可与 3 mol NaHCO3 发生反应
C. 酸性条件下,C2H5CO18OC2H5 的水解产物是C2H5CO18OH 和C2H5OH
D. 乙酸和油脂都能与氢氧化钠溶液反应
9.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如图。下列关于该高分子的说法正确的是( )
A. 完全水解产物的单个分子中,苯环上的一氯代物有两种
B. 完全水解产物的单个分子中,含有官能团—COOH 或—NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:
10. 我国科研人员提出了由 CO2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程。该历程示意图如图。
下列说法不正确的是( )
A.生成 CH3COOH 总反应的原子利用率为 100%
B.CH4→CH3COOH 过程中,有 C—H 键发生断裂
C. ①→②放出能量并形成了 C—C 键
D. 该催化剂可有效提高反应物的平衡转化率
11.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的 H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基)。下列说法错误的是( )
A. 无论是否鼓入空气,负极的电极反应式均为 Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为 H++e-=H•
C. 鼓入空气时,每生成 1 mol•OH 有 2 mol 电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
12.下列说法正确的是( )
A. 反应 CH4(g) + H2O(g) = CO(g) + 3H2(g)在一定条件下能自发进行,该反应一定为放热反应
B.可用牺牲阳极或外加电流的阴极保护法延缓钢铁水闸的腐蚀
C.Na2O2 与水反应产生 1 mol O2,理论上转移的电子数目约为 4×6.02×10 23
D.保持温度不变,向稀氨水中缓慢通入 CO2,溶液中 c(OH—)/c(NH3•H 2O)的值增大
13. 反应 CO(g)+2H2(g)CH3OH(g) ΔH<0 达到平衡后,只改变一个反应条件, 下列所画示意图不正确的是( )
14. 为研究沉淀的生成及其转化,某小组进行如下实验。下列说法不正确的是( )
A. ①浊液中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有 SCN-
C. ③中颜色变化说明有 AgI 生成
D. 该实验可以证明AgI 比AgSCN 更难溶
15. 如图是物质间发生化学反应的颜色变化,其中物质 a、b、c、d 对应的物质正确的是
( )
选项
物质 a
物质 b
物质 c
物质 d
A
Cu2(OH)2CO3
Ba(OH)2
Fe(OH)3
酚酞溶液
B
CuO
NaAlO2
Fe2O3
紫色石蕊溶液
C
CuO
BaCl2
FeO
酚酞溶液
D
Cu(OH)2
Ba(NO3)2
FeO
紫色石蕊溶液
16. 常温下,向两只分别盛有 50 mL0.100 mol/L 盐酸的烧杯中各自匀速滴加 50 mL 蒸馏水、50 mL0.100 mol/L 醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4 溶液 pH 约为 7。
下列说法正确的是( )
A. 实验①滴加过程中溶液所有离子浓度都减小
B. 实验②滴至 pH=2 时,溶液中 c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C. 实验②滴加过程中,溶液中均存在 c(CH3COO-)
17. 高铁酸钾(K2FeO4)作为多功能水处理剂具有广泛的用途,下面是利用次氯酸盐在碱性条件下氧化硝酸铁制备K2FeO4 的生产工艺流程图:
下列判断正确的是( )
A. 反应①中氯气只起氧化剂的作用
B. 溶液Ⅰ的溶质只有 KClO
C. 反应③中氧化剂与还原剂的物质的量之比为 1∶1
D. 溶液Ⅱ的溶质成分中含有K2FeO4
18. N2O5 是一种新型硝化剂,一定温度下发生反应 2N2O5(g)4NO2(g)+O2(g)
ΔH>0,T1 温度下的部分实验数据为:
t/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法不正确的是( )
A.反应进行到 1000 s 时,该反应已经达到了化学平衡状态
B. T1温度下的平衡常数为K1 =125,1 000 s 时 N2O5 的转化率为 50%
C.其他条件不变时,T2 温度下反应到 1 000 s 时测得 N2O5(g)浓度为 2.98 mol•L-1,则有T1 < T2
D. T1 温度下的平衡常数为 K1,T2 温度下的平衡常数为 K2,若 T1> T2,则有 K1> K2
19. 柠檬酸(用 H3R 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中 H3R、H2R-、HR2-、R3-的含量随 pH 的变化曲线如图所示。下列说法中正确的是( )
A.H3R 的第二步电离常数 Ka2(H3R)的数量级为 10-4
B.pH=6 时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C.Na2HR 溶液中 HR2-的水解程度大于电离程度
D.pH=4 时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
20. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中 CO2 和 H2S 的高效去除。示意图如图所示,其中电极分别为 ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe 2+-e-===EDTA-Fe 3+
②2EDTA-Fe 3++H2S===2H++S+2EDTA-Fe 2+
该装置工作时,下列叙述错误的是( )
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比 ZnO@石墨烯上的低
D. 若采用 Fe3+/Fe2+取代 EDTA-Fe 3+/EDTA-Fe 2+,溶液需为酸性
第Ⅱ卷(非选择题 共 40 分)
21.I.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国际新标准。
(1)In 在周期表中的位置是_ 。
(2)In 的最高价氧化物的水化物的碱性_ Ba(OH)2 的碱性(填“>”或“<”)。
(3) In 的中子数与电子数的差值为 。
II. A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a. A+、B2-、F3+核外电子层结构相同
b. C-是由两种元素组成的
c.D 是两种元素组成的四原子分子
d.E 在常温下是无色液体
e.往含 F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式: 。
(5)A+、B2-、F3+离子半径由大到小的顺序为 (用离子符号表示)。
(6)电子式表示 A2B 的形成过程 。
(7)含 F3+的溶液中通入过量D,反应的离子方程式是 。
(8)A 单质与 E 反应的离子方程式为 ,生成的化合物中化学键的类型是___ _ 。
22. TiO2 和 TiCl4 均为重要的工业原料。已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH1=-175.4 kJ•mol - 1
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH2=-220.9 kJ•mol -1
请回答下列问题:
(1) TiCl4(g) 与 CO(g) 反应生成 TiO2(s) 、 C(s) 和 氯气的热化学方程式为
____ 。
(2) 若反应Ⅱ的逆反应活化能表示为 E kJ•mol -1,则 E 220.9(填“>”“<”或“=”)。
(3) t ℃时,向 10 L 恒容密闭容器中充入 1 mol TiCl4 和 2 mol O2,发生反应Ⅰ。5 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~5 min 内,用 Cl2 表示的反应速率 v(Cl2)= 。
②TiCl4 的平衡转化率 α=__ 。
③下列措施,既能加快逆反应速率又能增大 TiCl4 的平衡转化率的是 (填选项字母)。
A.缩小容器容积 B.加入催化剂
C.分离出部分 TiO2 D.增大 O2 浓度
④ t ℃时,向 10 L 恒容密闭容器中充入 3 mol TiCl4 和一定量 O2 的混合气体,发生反应
Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比é 的关系如图所示:
ë
能表示 TiCl4 平衡转化率的曲线为 (填“L1”或“L2”);M 点的坐标为 。
23. 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回 收 V2O5 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1) “酸浸”时 V2O5 转化为VO2+,反应的离子方程式为_ ,
同时 V2O4 转化成VO2+。“废渣 1”的主要成分是_ 。
(2)“氧化”中欲使 3 mol 的VO2+变为 VO2+,则需要氧化剂KClO3至少为_ _ mol。
(3)“中和”作用之一是使钒以 V4O124-形式存在于溶液中。“废渣 2”中含有 。
(4)“流出液”中阳离子最多的是 _ 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式
____ _ 。
24. 某兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点-64.5℃,沸点-5.5 ℃)是一种黄色气体,液态时呈红褐色,易水解,可用于合成洗涤剂和催化剂等,对眼睛、皮肤和黏膜有强烈刺激性,有毒。冰水中加入NaCl 可降低水的凝固点。
【原料制备】 在实验室分别制备原料气NO 和 Cl2。
(1) 用如下装置制备纯净干燥的气体,请补充表中各仪器中的试剂。
原料制备
烧瓶中试剂
分液漏斗中试剂
装置Ⅱ中试剂
制备纯净 Cl2
MnO2
①________
②________
制备纯净 NO
Cu
③________
④________
【合成亚硝酰氯】 利用制得的 NO 和 Cl2 制备 NOCl,装置如图所示。
(2) 装置连接顺序为 a→ (按气流自左向右方向)。
(3) 装置Ⅶ的作用是 _ 。
(4) 用装置Ⅷ吸收尾气时,NOCl 发生反应的化学方程式为 _ 。
(5) 查阅资料,得到配制王水(浓硝酸与浓盐酸按体积比 1∶3 混合而成)时会生成亚硝酰氯和氯气,该反应的化学方程式为 _ 。
参考答案及评分细则
1
2
3
4
5
6
7
8
9
10
D
D
A
A
B
C
D
D
B
D
11
12
13
14
15
16
17
18
19
20
C
B
B
D
D
C
D
C
B
C
21 ( 10 分)
(1) 第五周期IIIA 族 (1 分)
(2)< (1 分)
(3)17 (1 分)
(4) (l 分)
(5)O2->Na+>Al3+ ( 1 分)
(6) (l分)
(7)A l3++3NH3• 3H2O= Al( OH) 3↓ +3NH4+ ( 1 分)
(8) 2Na+2H2O = 2Na++2OH- +H2 ↑(1分) 离子键和极性键 ( 2 分)
22 (10 分)
(l)TiCl4(g)+2CO(g) =TiO2(s)+2Cl2(g)+2C(s) ΔH= +45.5 kJ•mo1 -1( 2 分)
(2)> ( 1 分)
(3) ①0.008 mol•L-1·min-1 ( 1 分)
②20% ( 1 分)
③D ( 1 分)
④L2( 2 分) (1,) ( 2 分 )
23 ( 10 分)
(l )V2O5+2H+ =2VO2++H2O ( 2 分) SiO2 (l 分)
(2)0.5 ( 2 分)
(3)Fe(OH)3、 Al(OH)3 ( 2 分)
(4)K+ (l 分)
(5)2NH4VO3 V2O5+ +H2O↑ + 2NH3 ↑( 2 分)
24 (10 分)
(1) ①浓盐酸 (1 分)
②饱和食盐水 (1 分)
③稀硝酸 (1 分)
④水 (1 分)
(2) e→f→b→c→d(或 f→e→b →c→d) ( 1 分)
(3)防止水蒸气进入装置IX和装置VI (l 分)
(4)NOCl+2NaOH= NaCl+ NaNO2+H2O ( 2 分)
(5)HNO3(浓)+ 3HC1 (浓 )= NOCl↑+Cl2↑+2H2O ( 2 分)
化学试题
满分 100 分 时间 100 分钟
本试卷分第I 卷(选择题)和第II 卷(非选择题)两部分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Ca—40
第 I 卷 (选择题 共 60 分)
包括 20 小题,每小题 3 分,共 60 分。每小题只有一个选项符合题意。
一、单选题
1.下列物质与危险化学品标志的对应关系不正确的是
A
B
C
D
酒精
氢气
NaOH 溶液
Cu
A.A B.B C.C D.D
2.能正确表示下列反应的离子方程式是
A.向次氯酸钠溶液中通入足量 SO2 气体:ClO-+SO2+H2O=HClO+HSO3-
B.0.1 mol/L NH4Al(SO4)2 溶液与 0.2 mol/L Ba(OH)2 溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4 溶液与H2O2 反应,证明H2O2 具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.Fe2O3 溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
3.设NA 表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1 mol CO2 和 SO2 组成的混合物中含有的原子数为 3 NA
B.2.24 L 的 Cl2 与一定量 CH4 在光照下反应生成的 HCl 分子数为 0.1 NA
C.常温下,0.1 mol 环氧乙烷( )中含有的共价键数为 0.3 NA
D.4.2 g CaH2 与水完全反应,转移的电子数为 0.1 NA
4.短周期主族元素 W、X、Y、Z 的原子序数依次增加。K、L、M 均是由这些元素组成的二元化合物,甲、乙分别是元素 X、Y 的单质,甲是常见的固体,乙是常见的气体。
K 是无色气体,是主要的大气污染物之一。0.05 mol•L-1 丙溶液的 pH 为 1,上述物质的转化关系如图所示。下列说法正确的是( )
A丙 也可由 W、Y 组成的某种化合物与 K 直接反应制得
B.K、L、M 中沸点最高的是M
C 原子半径: W
5.实验室在 500 °C时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有 FeO、Fe2O3和 Fe3O4 ,气体产物可能有 NH3、N2、H2O、SO3和 SO2)。下列说法中正确的是( )
A.装置②用于检验分解产物中是否有水蒸气生成, 试剂X 最好选用碱石灰
B.装置③用于检验分解产物中是否有SO3 气体生成并除去SO3 和 NH3
C.取①中固体残留物与稀硫酸反应并滴加 KSCN 溶液, 溶液变红色, 则残留物一定为
Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成, 装置⑤用于收集生成的 NH3 和N2
6.H2 与 ICl 的反应分①、②两步进行, 其能量曲线如图所示, 下列错误的是()
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢, 与相应正反应的活化能无关
D.反应①、反应②的焓变之和为ΔH= —218 kJ•mol-1
7.下列实验中 , 所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去 KNO3 固体中混杂的NaCl
重结晶
NaCl 在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
8.下列有关有机物的说法正确的是( )
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1 mol 苹果酸[HOOCCH(OH)CH2COOH]可与 3 mol NaHCO3 发生反应
C. 酸性条件下,C2H5CO18OC2H5 的水解产物是C2H5CO18OH 和C2H5OH
D. 乙酸和油脂都能与氢氧化钠溶液反应
9.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如图。下列关于该高分子的说法正确的是( )
A. 完全水解产物的单个分子中,苯环上的一氯代物有两种
B. 完全水解产物的单个分子中,含有官能团—COOH 或—NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:
10. 我国科研人员提出了由 CO2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程。该历程示意图如图。
下列说法不正确的是( )
A.生成 CH3COOH 总反应的原子利用率为 100%
B.CH4→CH3COOH 过程中,有 C—H 键发生断裂
C. ①→②放出能量并形成了 C—C 键
D. 该催化剂可有效提高反应物的平衡转化率
11.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的 H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基)。下列说法错误的是( )
A. 无论是否鼓入空气,负极的电极反应式均为 Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为 H++e-=H•
C. 鼓入空气时,每生成 1 mol•OH 有 2 mol 电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
12.下列说法正确的是( )
A. 反应 CH4(g) + H2O(g) = CO(g) + 3H2(g)在一定条件下能自发进行,该反应一定为放热反应
B.可用牺牲阳极或外加电流的阴极保护法延缓钢铁水闸的腐蚀
C.Na2O2 与水反应产生 1 mol O2,理论上转移的电子数目约为 4×6.02×10 23
D.保持温度不变,向稀氨水中缓慢通入 CO2,溶液中 c(OH—)/c(NH3•H 2O)的值增大
13. 反应 CO(g)+2H2(g)CH3OH(g) ΔH<0 达到平衡后,只改变一个反应条件, 下列所画示意图不正确的是( )
14. 为研究沉淀的生成及其转化,某小组进行如下实验。下列说法不正确的是( )
A. ①浊液中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有 SCN-
C. ③中颜色变化说明有 AgI 生成
D. 该实验可以证明AgI 比AgSCN 更难溶
15. 如图是物质间发生化学反应的颜色变化,其中物质 a、b、c、d 对应的物质正确的是
( )
选项
物质 a
物质 b
物质 c
物质 d
A
Cu2(OH)2CO3
Ba(OH)2
Fe(OH)3
酚酞溶液
B
CuO
NaAlO2
Fe2O3
紫色石蕊溶液
C
CuO
BaCl2
FeO
酚酞溶液
D
Cu(OH)2
Ba(NO3)2
FeO
紫色石蕊溶液
16. 常温下,向两只分别盛有 50 mL0.100 mol/L 盐酸的烧杯中各自匀速滴加 50 mL 蒸馏水、50 mL0.100 mol/L 醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4 溶液 pH 约为 7。
下列说法正确的是( )
A. 实验①滴加过程中溶液所有离子浓度都减小
B. 实验②滴至 pH=2 时,溶液中 c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C. 实验②滴加过程中,溶液中均存在 c(CH3COO-)
17. 高铁酸钾(K2FeO4)作为多功能水处理剂具有广泛的用途,下面是利用次氯酸盐在碱性条件下氧化硝酸铁制备K2FeO4 的生产工艺流程图:
下列判断正确的是( )
A. 反应①中氯气只起氧化剂的作用
B. 溶液Ⅰ的溶质只有 KClO
C. 反应③中氧化剂与还原剂的物质的量之比为 1∶1
D. 溶液Ⅱ的溶质成分中含有K2FeO4
18. N2O5 是一种新型硝化剂,一定温度下发生反应 2N2O5(g)4NO2(g)+O2(g)
ΔH>0,T1 温度下的部分实验数据为:
t/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法不正确的是( )
A.反应进行到 1000 s 时,该反应已经达到了化学平衡状态
B. T1温度下的平衡常数为K1 =125,1 000 s 时 N2O5 的转化率为 50%
C.其他条件不变时,T2 温度下反应到 1 000 s 时测得 N2O5(g)浓度为 2.98 mol•L-1,则有T1 < T2
D. T1 温度下的平衡常数为 K1,T2 温度下的平衡常数为 K2,若 T1> T2,则有 K1> K2
19. 柠檬酸(用 H3R 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中 H3R、H2R-、HR2-、R3-的含量随 pH 的变化曲线如图所示。下列说法中正确的是( )
A.H3R 的第二步电离常数 Ka2(H3R)的数量级为 10-4
B.pH=6 时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C.Na2HR 溶液中 HR2-的水解程度大于电离程度
D.pH=4 时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
20. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中 CO2 和 H2S 的高效去除。示意图如图所示,其中电极分别为 ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe 2+-e-===EDTA-Fe 3+
②2EDTA-Fe 3++H2S===2H++S+2EDTA-Fe 2+
该装置工作时,下列叙述错误的是( )
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比 ZnO@石墨烯上的低
D. 若采用 Fe3+/Fe2+取代 EDTA-Fe 3+/EDTA-Fe 2+,溶液需为酸性
第Ⅱ卷(非选择题 共 40 分)
21.I.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国际新标准。
(1)In 在周期表中的位置是_ 。
(2)In 的最高价氧化物的水化物的碱性_ Ba(OH)2 的碱性(填“>”或“<”)。
(3) In 的中子数与电子数的差值为 。
II. A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a. A+、B2-、F3+核外电子层结构相同
b. C-是由两种元素组成的
c.D 是两种元素组成的四原子分子
d.E 在常温下是无色液体
e.往含 F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式: 。
(5)A+、B2-、F3+离子半径由大到小的顺序为 (用离子符号表示)。
(6)电子式表示 A2B 的形成过程 。
(7)含 F3+的溶液中通入过量D,反应的离子方程式是 。
(8)A 单质与 E 反应的离子方程式为 ,生成的化合物中化学键的类型是___ _ 。
22. TiO2 和 TiCl4 均为重要的工业原料。已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH1=-175.4 kJ•mol - 1
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH2=-220.9 kJ•mol -1
请回答下列问题:
(1) TiCl4(g) 与 CO(g) 反应生成 TiO2(s) 、 C(s) 和 氯气的热化学方程式为
____ 。
(2) 若反应Ⅱ的逆反应活化能表示为 E kJ•mol -1,则 E 220.9(填“>”“<”或“=”)。
(3) t ℃时,向 10 L 恒容密闭容器中充入 1 mol TiCl4 和 2 mol O2,发生反应Ⅰ。5 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~5 min 内,用 Cl2 表示的反应速率 v(Cl2)= 。
②TiCl4 的平衡转化率 α=__ 。
③下列措施,既能加快逆反应速率又能增大 TiCl4 的平衡转化率的是 (填选项字母)。
A.缩小容器容积 B.加入催化剂
C.分离出部分 TiO2 D.增大 O2 浓度
④ t ℃时,向 10 L 恒容密闭容器中充入 3 mol TiCl4 和一定量 O2 的混合气体,发生反应
Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比é 的关系如图所示:
ë
能表示 TiCl4 平衡转化率的曲线为 (填“L1”或“L2”);M 点的坐标为 。
23. 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回 收 V2O5 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1) “酸浸”时 V2O5 转化为VO2+,反应的离子方程式为_ ,
同时 V2O4 转化成VO2+。“废渣 1”的主要成分是_ 。
(2)“氧化”中欲使 3 mol 的VO2+变为 VO2+,则需要氧化剂KClO3至少为_ _ mol。
(3)“中和”作用之一是使钒以 V4O124-形式存在于溶液中。“废渣 2”中含有 。
(4)“流出液”中阳离子最多的是 _ 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式
____ _ 。
24. 某兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点-64.5℃,沸点-5.5 ℃)是一种黄色气体,液态时呈红褐色,易水解,可用于合成洗涤剂和催化剂等,对眼睛、皮肤和黏膜有强烈刺激性,有毒。冰水中加入NaCl 可降低水的凝固点。
【原料制备】 在实验室分别制备原料气NO 和 Cl2。
(1) 用如下装置制备纯净干燥的气体,请补充表中各仪器中的试剂。
原料制备
烧瓶中试剂
分液漏斗中试剂
装置Ⅱ中试剂
制备纯净 Cl2
MnO2
①________
②________
制备纯净 NO
Cu
③________
④________
【合成亚硝酰氯】 利用制得的 NO 和 Cl2 制备 NOCl,装置如图所示。
(2) 装置连接顺序为 a→ (按气流自左向右方向)。
(3) 装置Ⅶ的作用是 _ 。
(4) 用装置Ⅷ吸收尾气时,NOCl 发生反应的化学方程式为 _ 。
(5) 查阅资料,得到配制王水(浓硝酸与浓盐酸按体积比 1∶3 混合而成)时会生成亚硝酰氯和氯气,该反应的化学方程式为 _ 。
参考答案及评分细则
1
2
3
4
5
6
7
8
9
10
D
D
A
A
B
C
D
D
B
D
11
12
13
14
15
16
17
18
19
20
C
B
B
D
D
C
D
C
B
C
21 ( 10 分)
(1) 第五周期IIIA 族 (1 分)
(2)< (1 分)
(3)17 (1 分)
(4) (l 分)
(5)O2->Na+>Al3+ ( 1 分)
(6) (l分)
(7)A l3++3NH3• 3H2O= Al( OH) 3↓ +3NH4+ ( 1 分)
(8) 2Na+2H2O = 2Na++2OH- +H2 ↑(1分) 离子键和极性键 ( 2 分)
22 (10 分)
(l)TiCl4(g)+2CO(g) =TiO2(s)+2Cl2(g)+2C(s) ΔH= +45.5 kJ•mo1 -1( 2 分)
(2)> ( 1 分)
(3) ①0.008 mol•L-1·min-1 ( 1 分)
②20% ( 1 分)
③D ( 1 分)
④L2( 2 分) (1,) ( 2 分 )
23 ( 10 分)
(l )V2O5+2H+ =2VO2++H2O ( 2 分) SiO2 (l 分)
(2)0.5 ( 2 分)
(3)Fe(OH)3、 Al(OH)3 ( 2 分)
(4)K+ (l 分)
(5)2NH4VO3 V2O5+ +H2O↑ + 2NH3 ↑( 2 分)
24 (10 分)
(1) ①浓盐酸 (1 分)
②饱和食盐水 (1 分)
③稀硝酸 (1 分)
④水 (1 分)
(2) e→f→b→c→d(或 f→e→b →c→d) ( 1 分)
(3)防止水蒸气进入装置IX和装置VI (l 分)
(4)NOCl+2NaOH= NaCl+ NaNO2+H2O ( 2 分)
(5)HNO3(浓)+ 3HC1 (浓 )= NOCl↑+Cl2↑+2H2O ( 2 分)
相关资料
更多








