
还剩14页未读,
继续阅读
所属成套资源:2020高考化学通用版新创新一轮复习3-12章学案()
成套系列资料,整套一键下载
2020版高考新创新一轮复习化学通用版学案:第三章第一节钠及其化合物
展开
第三章 金属及其化合物
第一节
钠及其化合物
1.了解钠及其重要化合物的制备方法。
2.掌握钠及其重要化合物的主要性质及其应用。
考点(一) 钠及其氧化物 【点多面广精细研】
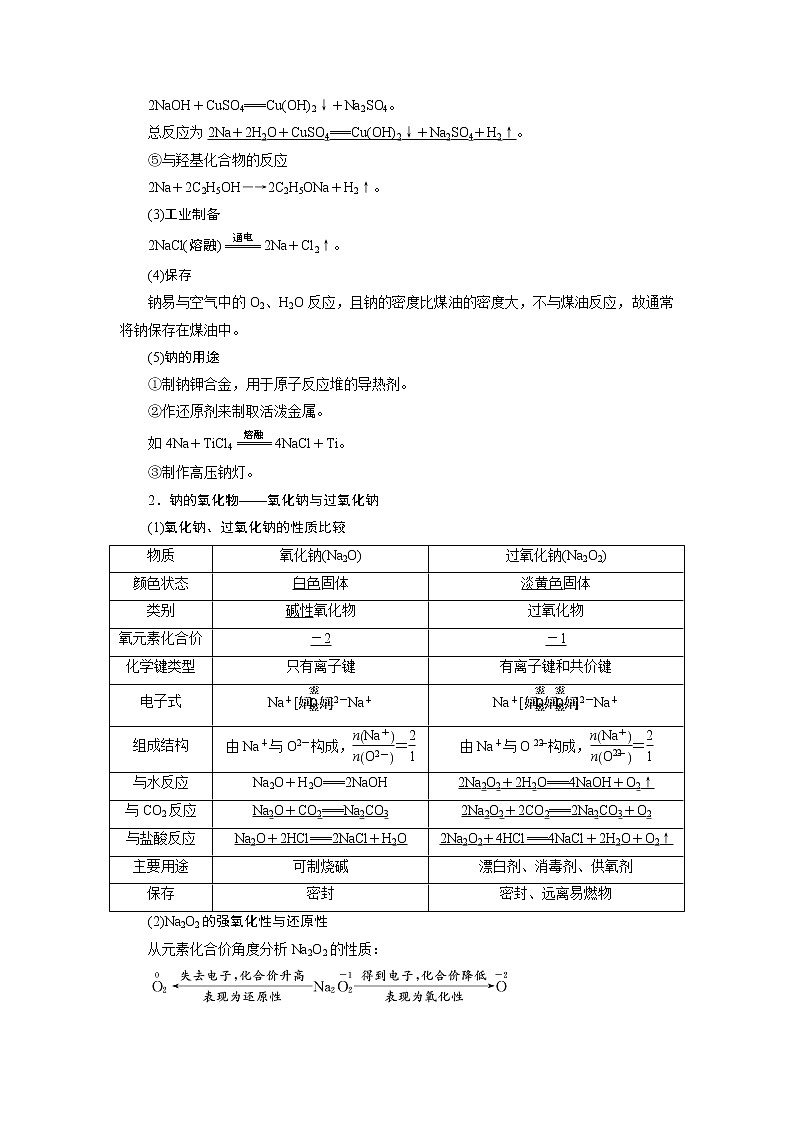
1.钠的性质与应用
(1)物理性质
颜色状态
密度
硬度
熔点
银白色固体
比水小,比煤油大
较小
较低,低于100 ℃
(2)化学性质
钠在化学反应中易失去最外层的一个电子,表现还原性。
①与非金属单质(如O2、Cl2)的反应
O2
常温:4Na+O2===2Na2O(白色固体)
加热:2Na+O2Na2O2(淡黄色固体)
Cl2
2Na+Cl22NaCl
②与水的反应
2Na+2H2O===2NaOH+H2↑。
钠与水(含酚酞)反应的实验现象分析:
③与酸的反应
2Na+2H+===2Na++H2↑。
[注意] Na先与酸反应,再与水反应——先酸后水。
④与盐溶液的反应
与盐溶液反应时先与水反应,生成的碱与盐可能发生复分解反应。如与CuSO4溶液反应:
2Na+2H2O===2NaOH+H2↑,
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
总反应为2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑。
⑤与羟基化合物的反应
2Na+2C2H5OH―→2C2H5ONa+H2↑。
(3)工业制备
2NaCl(熔融)2Na+Cl2↑。
(4)保存
钠易与空气中的O2、H2O反应,且钠的密度比煤油的密度大,不与煤油反应,故通常将钠保存在煤油中。
(5)钠的用途
①制钠钾合金,用于原子反应堆的导热剂。
②作还原剂来制取活泼金属。
如4Na+TiCl44NaCl+Ti。
③制作高压钠灯。
2.钠的氧化物——氧化钠与过氧化钠
(1)氧化钠、过氧化钠的性质比较
物质
氧化钠(Na2O)
过氧化钠(Na2O2)
颜色状态
白色固体
淡黄色固体
类别
碱性氧化物
过氧化物
氧元素化合价
-2
-1
化学键类型
只有离子键
有离子键和共价键
电子式
Na+[]2-Na+
Na+[]2-Na+
组成结构
由Na+与O2-构成,=
由Na+与O构成,=
与水反应
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
与CO2反应
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
与盐酸反应
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
主要用途
可制烧碱
漂白剂、消毒剂、供氧剂
保存
密封
密封、远离易燃物
(2)Na2O2的强氧化性与还原性
从元素化合价角度分析Na2O2的性质:
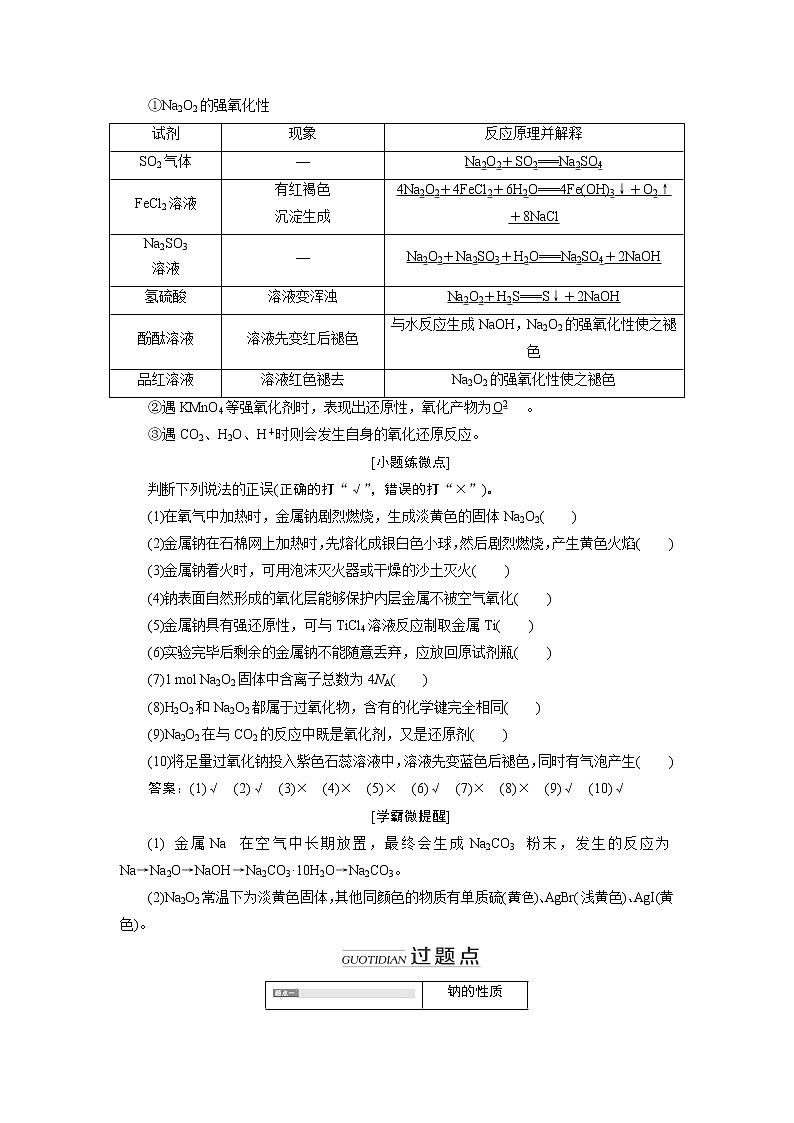
①Na2O2的强氧化性
试剂
现象
反应原理并解释
SO2气体
—
Na2O2+SO2===Na2SO4
FeCl2溶液
有红褐色
沉淀生成
4Na2O2+4FeCl2+6H2O===4Fe(OH)3↓+O2↑+8NaCl
Na2SO3
溶液
—
Na2O2+Na2SO3+H2O===Na2SO4+2NaOH
氢硫酸
溶液变浑浊
Na2O2+H2S===S↓+2NaOH
酚酞溶液
溶液先变红后褪色
与水反应生成NaOH,Na2O2的强氧化性使之褪色
品红溶液
溶液红色褪去
Na2O2的强氧化性使之褪色
②遇KMnO4等强氧化剂时,表现出还原性,氧化产物为。
③遇CO2、H2O、H+时则会发生自身的氧化还原反应。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2( )
(2)金属钠在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,产生黄色火焰( )
(3)金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( )
(4)钠表面自然形成的氧化层能够保护内层金属不被空气氧化( )
(5)金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti( )
(6)实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶( )
(7)1 mol Na2O2固体中含离子总数为4NA( )
(8)H2O2和Na2O2都属于过氧化物,含有的化学键完全相同( )
(9)Na2O2在与CO2的反应中既是氧化剂,又是还原剂( )
(10)将足量过氧化钠投入紫色石蕊溶液中,溶液先变蓝色后褪色,同时有气泡产生( )
答案:(1)√ (2)√ (3)× (4)× (5)× (6)√ (7)× (8)× (9)√ (10)√
[学霸微提醒]
(1)金属Na在空气中长期放置,最终会生成Na2CO3粉末,发生的反应为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3。
(2)Na2O2常温下为淡黄色固体,其他同颜色的物质有单质硫(黄色)、AgBr(浅黄色)、AgI(黄色)。
钠的性质
1.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
A.BaCl2溶液 B.K2SO4溶液
C.Ca(HCO3)2溶液 D.NH4NO3溶液
解析:选C 因为是溶液中的反应,所以都有H2产生,NH4NO3溶液还产生NH3,Ca(HCO3)2溶液还产生CaCO3沉淀。
2.(2019·崇明模拟)少量金属钠投入下列试剂中,反应最缓慢的是__________,既有气体又有沉淀的是__________。
A.NaHCO3溶液反应 B.饱和氯化铵溶液
C.0.1 mol·L-1 NaOH溶液 D.无水乙醇
解析:A项,少量金属钠投入NaHCO3溶液中,反应为2Na+2H2O===2NaOH+H2↑,NaOH+NaHCO3===Na2CO3+H2O;B项,金属钠投入饱和氯化铵溶液中,反应为2Na+2H2O===2NaOH+H2↑,反应消耗水,饱和氯化铵溶液析出氯化铵固体,可能释放出氨气;C项,少量金属钠投入0.1 mol·L-1 NaOH溶液中,反应为2Na+2H2O===2NaOH+H2↑;D项,少量金属钠投入无水乙醇中,反应为2Na+2C2H5OH===2C2H5ONa+H2↑;钠为活泼金属,钠与水溶液的反应,实质都是与H+的反应,乙醇为非电解质,不电离,与钠反应最缓慢。
答案:D B
[方法规律] 钠与盐溶液反应的原理分析
(1)与NaCl、Na2SO4、NaNO3溶液反应:实质是与水反应。
(2)与CuSO4溶液反应:钠先与水反应,生成的NaOH再与CuSO4反应,2OH-+Cu2+===Cu(OH)2↓。
(3)与铝盐溶液反应:要考虑钠与铝盐的量的问题,因为过量的NaOH溶液能溶解Al(OH)3,OH-+Al(OH)3===AlO+2H2O。
(4)与NaHCO3溶液反应:钠先与水反应,生成的NaOH再与NaHCO3反应,OH-+HCO===H2O+CO。
(5)与NH4Cl溶液反应:钠先与水反应,生成的NaOH再与NH4Cl反应,OH-+NH===NH3·H2O。
过氧化钠的性质
3.下列说法错误的是( )
A.(2017·江苏高考)Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.(2015·全国卷Ⅰ)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
C.(2014·全国卷Ⅱ)CO2通过Na2O2粉末后固体质量增重
D.(2015·四川高考)标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
解析:选D A项,Na2O2与CO2反应产生O2,可用作呼吸面具供氧剂,正确;B项,过氧化钠与水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,根据电子转移情况得关系式O2~2e-,可知生成0.1 mol氧气转移的电子数为0.2NA,正确;C项,2Na2O2+2CO2
===2Na2CO3+O2,2 mol CO2 生成1 mol O2,所以粉末固体质量增重,正确;D项,CO2与Na2O2发生反应的化学方程式为2CO2+2Na2O2===2Na2CO3+O2,每有2 mol CO2参加反应转移2 mol电子,标准状况下,5.6 L CO2的物质的量为0.25 mol,反应转移的电子数为0.25NA,错误。
4.过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项
二氧化碳
碳酸钠
转移的电子
A
1 mol
2NA
B
22.4 L
1 mol
C
106 g
1 mol
D
106 g
2NA
解析:选C
+2CO2===2Na2CO3+O2 Δm 转移电子
2 mol 2 mol 56 g 2 mol
1 mol 1 mol 28 g 1 mol
由上述关系可得出C项正确;B项未指明标准状况,错误。
[方法规律]
1.掌握Na2O2的强氧化性的两个角度
(1)从结构角度
Na2O2的结构中含有过氧链(—O—O—),含有过氧链结构的物质有较强的氧化性,以此类推,如H2O2、H2SO5(过一硫酸,相当于H2O2中的一个H被—SO3H取代)、Na2S2O8(过二硫酸钠)中都有过氧链结构,都是很强的氧化剂。
(2)从化合价的角度
Na2O2中的氧元素为-1价,有很强的氧化性,能氧化一些常见的还原剂,如SO2、Fe2+、SO、HSO、H2S、S2-、I-。同时-1价的O也有还原性,如遇到强氧化剂KMnO4也可以被氧化成O2。
2.Na2O2与H2O、CO2反应计算的三个关系
电子转
移关系
当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-,n(e-)=n(Na2O2)=2n(O2)
气体体
积变化
关系
若CO2、水蒸气(或两混合气体)通过足量Na2O2,气体体积的减少量是原气体体积的,等于生成氧气的量,ΔV=V(O2)=V(原气体)
固体质
量变化
关系
CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”,所以固体增加的质量Δm=28 g·mol-1×n(CO2)、Δm=2 g·mol-1×n(H2O)
1.(2019·商丘模拟)在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( )
A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中无水CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
解析:选C 实验现象说明熔融的钠将CuSO4中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,CuSO4作氧化剂。
2.下列有关Na2O2的说法不正确的是( )
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,涉及的氧化还原反应中,Na2O2
D.Na2O2粉末加入Ca(HCO3)2溶液中,会产生气体和浑浊
点拨:既是氧化剂又是还原剂,说明物质发生了歧化反应,类似的反应有S+NaOH(浓)、Cl2+NaOH、Na2O2+H2O等。
解析:选B A项,燃烧说明脱脂棉的温度达到着火点且有助燃物质氧气生成,正确;B项,反应物中没有单质参加反应,不符合置换反应的定义,错误;C项,Na2O2与CO2、H2O的反应都是Na2O2自身的氧化还原反应,正确;D项,Na2O2先和水反应生成O2和NaOH,NaOH再与Ca(HCO3)2 反应产生CaCO3沉淀,正确。
3.200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,则原混合气体的总物质的量是( )
A.0.125 mol B.0.25 mol
C.0.5 mol D.1 mol
点拨:CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”。
解析:选C 根据质量守恒定律可知,生成O2的质量为11.6 g-3.6 g=8 g,n(O2)==0.25 mol,根据Na2O2与H2O(g)、CO2反应的物质的量的关系可知,CO2和H2O(g)的物质的量之和为0.25 mol×2=0.5 mol。
4.某同学探究钠的性质时,将等量的金属钠分别投入下列溶液中,请你帮他完成实验报告:
序号
溶液
现象
解释及离子方程式
①
饱和NaCl溶液
②
饱和石灰水
③
CuSO4溶液
④
FeCl3溶液
归纳:钠与盐溶液反应的现象:浮、熔、游、响。消耗的水会使饱和盐溶液中的盐晶体析出;生成的NaOH再与溶液中的溶质反应产生现象。
答案:①溶液中出现浑浊 Na与H2O反应使水量减少,2Na+2H2O===2Na++2OH-+H2↑
②溶液中出现浑浊 Na与H2O反应放热,Ca(OH)2溶解度随温度升高而减小,且Na与H2O反应使水量减少,2Na+2H2O===2Na++2OH-+H2↑,产生的OH-促进Ca(OH)2(s)Ca2+(aq)+2OH-(aq)溶解平衡逆向移动
③溶液中出现蓝色沉淀 2Na+2H2O+Cu2+===Cu(OH)2↓+2Na++H2↑
④溶液中出现红褐色沉淀 6Na+6H2O+2Fe3+===2Fe(OH)3↓+6Na++3H2↑
考点(二) 氢氧化钠、钠的碳酸盐 【点多面广精细研】
1.氢氧化钠
(1)物理性质
NaOH的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有吸水性;吸收空气中的水分而潮解;有很强的腐蚀性。
(2)化学性质
①具有碱的通性。
②其他反应
与金属铝反应:
2Al+2OH-+2H2O===2AlO+3H2↑。
与非金属单质(Cl2)反应:
Cl2+2OH-===Cl-+ClO-+H2O。
酯类(CH3COOC2H5)水解:
CH3COOC2H5+NaOHCH3COONa+CH3CH2OH。
(3)NaOH的制取
①土法制碱:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
②现代工业制碱:
2NaCl+2H2O2NaOH+H2↑+Cl2↑。
2.碳酸钠和碳酸氢钠
(1)Na2CO3与NaHCO3的性质比较
Na2CO3
NaHCO3
俗名
纯碱、苏打
小苏打
颜色状态
白色粉末
白色晶体
溶解性
易溶于水
易溶于水
(溶解度比Na2CO3小)
水解(离子方程式,下同)
CO+H2OHCO+OH-
HCO+H2OH2CO3+OH-
与盐酸反应
CO+2H+===CO2↑+H2O
HCO+H+===H2O+CO2↑
与NaOH反应
不反应
HCO+OH-===CO+H2O
与足量Ca(OH)2反应
Ca2++CO===CaCO3↓
Ca2++OH-+HCO===CaCO3↓+H2O
与BaCl2反应
CO+Ba2+===BaCO3↓
不反应
与CO2反应
CO+CO2+H2O===2HCO
不反应
热稳定性
较稳定
2NaHCO3Na2CO3+CO2↑+H2O
相互转化
Na2CO3NaHCO3
(2)Na2CO3、NaHCO3的用途
①Na2CO3是一种非常重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。
②NaHCO3是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多的一种药剂。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在酒精灯加热条件下,Na2CO3、NaHCO3固体都会分解( )
(2)向Na2CO3饱和溶液中通入足量CO2,会有NaHCO3晶体析出( )
(3)苏打是面包发酵粉的主要成分之一( )
(4)用酚酞溶液可鉴别饱和食盐水和饱和Na2CO3溶液( )
(5)相同温度下溶解度:小苏打<苏打,热稳定性:Na2CO3>NaHCO3( )
(6)Na2CO3溶液(杂质NaHCO3),选用适量的NaOH溶液( )
(7)NaHCO3溶液(杂质Na2CO3),应通入过量的CO2气体( )
答案:(1)× (2)√ (3)× (4)√ (5)√ (6)√ (7)√
[学霸微提醒]
碳酸盐、碳酸氢盐的区别
(1)溶解性:一般地,碳酸盐小于碳酸氢盐,如CaCO3
碳酸钠和碳酸氢钠的性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·全国卷Ⅱ)碳酸钠可用于去除餐具的油污( )
(2)(2018·江苏高考)物质性质与用途具有对应关系:NaHCO3受热易分解,可用于制胃酸中和剂( )
(3)(2018·江苏高考)NaHCO3(s)Na2CO3(s)NaOH(aq) ( )
(4)(2018·天津高考)溶解度:Na2CO3
(6)(2015·全国卷Ⅱ)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡( )
(7)(2014·全国卷Ⅰ)用热的烧碱溶液洗去油污,是因为Na2CO3可直接与油污反应( )
(8)(2014·全国卷Ⅱ)用热碱水清除炊具上残留的油污,没有发生化学反应( )
(9)(2014·全国卷Ⅱ)碳酸氢钠受热分解实验如图所示( )
答案:(1)√ (2)× (3)√ (4)× (5)× (6)× (7)× (8)× (9)×
2.(2019·雁峰区一模)下列有关Na2CO3和NaHCO3的比较中不正确的是( )
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,0.1 mol·L-1盐溶液的pH值:Na2CO3>NaHCO3
C.等质量的Na2CO3和NaHCO3分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3
D.相同温度下,0.1 mol·L-1盐溶液分别与0.1 mol·L-1 HCl溶液反应的剧烈程度:Na2CO3>NaHCO3
解析:选D NaHCO3受热易分解,不稳定,则热稳定性为Na2CO3>NaHCO3,故A正确;Na2CO3水解程度比NaHCO3大,物质的量浓度相同时,Na2CO3溶液碱性较大,故B正确;设质量都是106 g,则Na2CO3和NaHCO3的物质的量分别为1 mol、 mol,Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1 mol、 mol,即放出CO2的质量:Na2CO3<NaHCO3,故C正确;分别滴加HCl溶液,反应离子方程式分别为CO+2H+===CO2↑+H2O、HCO+H+===H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D错误。
方法规律
1.从“弱”字入手理解Na2CO3、NaHCO3的几个性质
(1)二者的水溶液都显碱性,是因为弱酸根CO和HCO的水解。Na2CO3溶液的碱性更强,是因为弱酸根CO的水解程度更大。
(2)与同浓度的盐酸反应,NaHCO3反应更剧烈,是因为CO和HCO与酸反应生成CO2,HCO只需要结合一个H+,而CO需要结合2个H+。
(3)向Na2CO3溶液中逐滴加入稀盐酸,边滴加边振荡,无气泡产生,是因为H+首先和CO反应生成HCO。
(4)向Na2CO3溶液中通入CO2气体,生成NaHCO3,可以理解为弱酸碳酸电离出的H+结合了CO生成了HCO。
2.Na2CO3、NaHCO3的鉴别与除杂
(1)Na2CO3、NaHCO3的鉴别方法
(2)Na2CO3、NaHCO3的除杂方法
依据二者性质的差异确定除杂方法(后者为杂质)
序号
混合物
除杂方法
①
Na2CO3(s)、NaHCO3
加热法
②
NaHCO3(aq)、Na2CO3
通入足量CO2
③
Na2CO3(aq)、NaHCO3
加入适量NaOH溶液
侯氏制碱法
3.(2016·江苏高考)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )
解析:选C A项,制取NH3应用Ca(OH)2和NH4Cl固体加热,不正确;B项,CO2气体应长管进、短管出,不正确;C项,析出的NaHCO3晶体用过滤的方法分离,正确;D项,NaHCO3应低温烘干,不能直接加热,易发生反应2NaHCO3Na2CO3+CO2↑+H2O,不正确。
4.工业上以粗盐(含Ca2+、Mg2+、SO等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如图甲所示。下列说法正确的是( )
A.饱和食盐水中先通入的气体为CO2
B.流程图中的“系列操作”中一定需要使用玻璃棒
C.如图乙所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
D.除去粗盐溶液中的杂质可依次加入过量NaOH、Na2CO3、BaCl2溶液,过滤后再加入盐酸调节溶液的pH
解析:选B A项,CO2在水中溶解度较小,NH3溶解度较大,故应先通入NH3,使溶液为碱性溶液,再通入CO2,可以达到实验目的,错误;B项,从溶液中得到固体,需要加热浓缩、冷却结晶、过滤等操作,因此流程图中的“系列操作”中一定需要玻璃棒搅拌、引流等,正确;C项,Na2CO3加热不易分解,NaHCO3晶体加热容易分解,故小试管中盛放NaHCO3,大试管中盛放Na2CO3,错误;D项,除去粗盐中的Ca2+、Mg2+、SO及泥沙,可以加过量BaCl2除去SO,然后加NaOH除去Mg2+,用Na2CO3除去Ca2+和过量的Ba2+,盐酸要放在最后,除去过量的NaOH和Na2CO3,错误。
[归纳拓展] 侯氏制碱法
(1)原料
食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气,其反应为C+H2O(g) CO+H2,CO+H2O(g)CO2+H2。
(2)工艺流程
(3)反应原理
①产生NaHCO3的反应:
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。
②产生Na2CO3的反应:
2NaHCO3Na2CO3+CO2↑+H2O。
(4)循环使用的物质:CO2、饱和食盐水。
Na2CO3、NaHCO3、NaOH及其混合物与盐酸反应的图像问题
5.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
解析:选C 向NaOH与Na2CO3的混合溶液中滴加盐酸,盐酸首先与NaOH反应,然后与Na2CO3反应转化为NaHCO3:CO+H+===HCO,之后与HCO反应生成CO2,因n(OH-)=n(CO)=0.01 mol,故加入0.02 mol HCl后开始有气体生成。结合各物质的量分析图像可知,选项C符合题意。
6.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
(1)在A情况下,溶质是__________________(填化学式),其物质的量之比为________。
(2)在B情况下,溶质是__________________(填化学式),其物质的量之比为________。
(3)原氢氧化钠溶液的物质的量浓度为___________________________________。
解析:(1)CO2与NaOH溶液反应后,其溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3;A中,x=100时开始生成CO2,x=150时反应完全,溶质为Na2CO3与NaOH,且n(Na2CO3)∶n(NaOH)=1∶1。
(2)B图像中,开始无CO2生成,含有Na2CO3,至无气体放出时消耗盐酸150 mL-50 mL=100 mL,是50 mL的2倍,则含有NaHCO3,n(Na2CO3)∶n(NaHCO3)=1∶1。
(3)当加入150 mL盐酸时,恰好完全反应,此时溶液中溶质为NaCl。据物料守恒有n(NaOH)=n(Na+)=n(Cl-)=0.2 mol·L-1×0.15 L=0.03 mol,所以c(NaOH)==1.5 mol·L-1。
答案:(1)NaOH、Na2CO3 1∶1
(2)Na2CO3、NaHCO3 1∶1 (3)1.5 mol·L-1
归纳拓展
Na2CO3、NaHCO3、NaOH及其混合物与盐酸反应的4类图像
(1)向Na2CO3溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示)。
图像特点
Oa段、ab段消耗盐酸的体积相等
反应原理
Oa段离子方程式:
CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
(2)向NaHCO3溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示)。
图像特点
从O点开始即产生CO2气体
反应原理
离子方程式:HCO+H+===H2O+CO2↑
(3)向Na2CO3、NaHCO3的混合溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示,设Na2CO3、NaHCO3的物质的量之比为m∶n=1∶1,其他比例时的图像略)。
图像特点
Oa段消耗盐酸的体积小于ab段消耗盐酸的体积
反应原理
Oa段离子方程式:CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
(4)向NaOH、Na2CO3的混合溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示,设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略)。
图像特点
Oa段消耗盐酸的体积大于ab段消耗盐酸的体积
反应原理
Oa段离子方程式:
H++OH-===H2O,CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
1.(2019·衡阳模拟)我国医学家通过研究发现小苏打可去除肿瘤内的氢离子,从而快速有效地杀死处于葡萄糖饥饿或缺乏状态的肿瘤细胞,为治疗原发性肝癌开辟了新路径。下列有关小苏打的说法错误的是( )
A.可用于制备苏打
B.可用于制作糕点
C.与H+作用易产生CO2
D.可用饱和食盐水与CO2反应制得
解析:选D NaHCO3俗称小苏打,Na2CO3俗称苏打,NaHCO3受热分解生成Na2CO3,则可用于制备苏打,故A正确;NaHCO3能与H+反应生成CO2,用于制发酵粉,可用于制作糕点,故B、C正确;饱和食盐水与CO2不反应,所以不能用饱和食盐水与CO2反应制得小苏打,故D错误。
2.关于Na2CO3和NaHCO3的下列说法中正确的是( )
A.CaCl2溶液和二者的溶液都能反应产生白色沉淀
B.石灰水能和NaHCO3溶液反应,不与Na2CO3溶液反应
C.与足量的盐酸反应,Na2CO3产生气体的体积大
D.等物质的量的Na2CO3和NaHCO3与足量的盐酸反应,产生CO2的物质的量相同
抓关键:“等质量”说明Na2CO3的物质的量小于NaHCO3,则与足量盐酸反应生成CO2气体的物质的量:n(Na2CO3)
CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O(NaHCO3足量),故B错误;根据反应的方程式Na2CO3+2HCl===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O可知,106 g Na2CO3完全反应生成1 mol CO2,84 g NaHCO3完全反应生成1 mol CO2,所以等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大,故C错误;由方程式Na2CO3+2HCl===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O可知,等物质的量的两种盐与足量盐酸反应,产生的CO2的物质的量相同,故D正确。
3.向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0
D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况)
掌握图像题的解题技巧
①图像题往往涉及按不同产物产生不同情况,即横轴的物质开始时不足,逐渐加入会出现过量。
②注意图像中“拐点”,“拐点”表示一个反应刚刚结束,另一个反应刚刚开始。
③曲线的变化趋势表示物质的反应顺序,如:OH-、CO、HCOCO、HCOHCOCO2↑+H2O。
④解题时将曲线的变化趋势转化成反应,即书写反应方程式,代入数值计算。
解析:选A 加入50 mL盐酸时,恰好反应生成NaCl,根据物料守恒可知,n(HCl)=n(NaOH),所以c(NaOH)==0.5 mol·L-1,A项正确;根据图像可知,甲溶液中含有的溶质为Na2CO3和NaHCO3,所以当0
(1)A中制备气体时,所需药品是____________(填字母)。
(2)B中盛有饱和碳酸氢钠溶液,其作用是_________________________________。
(3)在实验过程中,向C中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是________________________________________________________________________
________________________________________________________________________。
(4)E装置向C中通气的导管不能插入液面下的原因是
________________________________________________________________________。
牢记侯氏制碱法工作原理
向饱和NaCl溶液中先通入足量NH3,再通入足量CO2,析出晶体:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,该反应利用了物质溶解度差异来制备NaHCO3。
解析:(1)制取CO2是用石灰石和盐酸在烧瓶中发生反应产生的,由于CO2在水中溶解度不大,所以导气管要伸入到液面以下,而制取氨气是将浓氨水滴入到盛有生石灰的烧瓶中反应制取的,氨气在水中非常容易溶解,所以导气管要在液面以上,根据在C中导气管的长短可知:在A中制备CO2气体,所需药品是ac。(2)用盐酸制取CO2气体时,由于盐酸有挥发性,所以其中含有杂质HCl,在B中盛有饱和碳酸氢钠溶液,其作用就是除去CO2中的杂质HCl。(3)CO2在水中的溶解度小,产生的HCO的浓度也就小,不容易形成NaHCO3的饱和溶液,所以难形成沉淀,因此在实验过程中,向C中先通入NH3使溶液呈碱性,能吸收大量CO2气体产生较高浓度的HCO,才能析出NaHCO3晶体。(4)E装置向C中通气的导管不能插入液面下是为了防止倒吸现象的发生。
答案:(1)ac (2)除去CO2中的HCl
(3)由于CO2在NaCl溶液中的溶解度很小,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO,才能析出NaHCO3晶体 (4)防倒吸
第一节
钠及其化合物
1.了解钠及其重要化合物的制备方法。
2.掌握钠及其重要化合物的主要性质及其应用。
考点(一) 钠及其氧化物 【点多面广精细研】
1.钠的性质与应用
(1)物理性质
颜色状态
密度
硬度
熔点
银白色固体
比水小,比煤油大
较小
较低,低于100 ℃
(2)化学性质
钠在化学反应中易失去最外层的一个电子,表现还原性。
①与非金属单质(如O2、Cl2)的反应
O2
常温:4Na+O2===2Na2O(白色固体)
加热:2Na+O2Na2O2(淡黄色固体)
Cl2
2Na+Cl22NaCl
②与水的反应
2Na+2H2O===2NaOH+H2↑。
钠与水(含酚酞)反应的实验现象分析:
③与酸的反应
2Na+2H+===2Na++H2↑。
[注意] Na先与酸反应,再与水反应——先酸后水。
④与盐溶液的反应
与盐溶液反应时先与水反应,生成的碱与盐可能发生复分解反应。如与CuSO4溶液反应:
2Na+2H2O===2NaOH+H2↑,
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
总反应为2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑。
⑤与羟基化合物的反应
2Na+2C2H5OH―→2C2H5ONa+H2↑。
(3)工业制备
2NaCl(熔融)2Na+Cl2↑。
(4)保存
钠易与空气中的O2、H2O反应,且钠的密度比煤油的密度大,不与煤油反应,故通常将钠保存在煤油中。
(5)钠的用途
①制钠钾合金,用于原子反应堆的导热剂。
②作还原剂来制取活泼金属。
如4Na+TiCl44NaCl+Ti。
③制作高压钠灯。
2.钠的氧化物——氧化钠与过氧化钠
(1)氧化钠、过氧化钠的性质比较
物质
氧化钠(Na2O)
过氧化钠(Na2O2)
颜色状态
白色固体
淡黄色固体
类别
碱性氧化物
过氧化物
氧元素化合价
-2
-1
化学键类型
只有离子键
有离子键和共价键
电子式
Na+[]2-Na+
Na+[]2-Na+
组成结构
由Na+与O2-构成,=
由Na+与O构成,=
与水反应
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2↑
与CO2反应
Na2O+CO2===Na2CO3
2Na2O2+2CO2===2Na2CO3+O2
与盐酸反应
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
主要用途
可制烧碱
漂白剂、消毒剂、供氧剂
保存
密封
密封、远离易燃物
(2)Na2O2的强氧化性与还原性
从元素化合价角度分析Na2O2的性质:
①Na2O2的强氧化性
试剂
现象
反应原理并解释
SO2气体
—
Na2O2+SO2===Na2SO4
FeCl2溶液
有红褐色
沉淀生成
4Na2O2+4FeCl2+6H2O===4Fe(OH)3↓+O2↑+8NaCl
Na2SO3
溶液
—
Na2O2+Na2SO3+H2O===Na2SO4+2NaOH
氢硫酸
溶液变浑浊
Na2O2+H2S===S↓+2NaOH
酚酞溶液
溶液先变红后褪色
与水反应生成NaOH,Na2O2的强氧化性使之褪色
品红溶液
溶液红色褪去
Na2O2的强氧化性使之褪色
②遇KMnO4等强氧化剂时,表现出还原性,氧化产物为。
③遇CO2、H2O、H+时则会发生自身的氧化还原反应。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2( )
(2)金属钠在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,产生黄色火焰( )
(3)金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( )
(4)钠表面自然形成的氧化层能够保护内层金属不被空气氧化( )
(5)金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti( )
(6)实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶( )
(7)1 mol Na2O2固体中含离子总数为4NA( )
(8)H2O2和Na2O2都属于过氧化物,含有的化学键完全相同( )
(9)Na2O2在与CO2的反应中既是氧化剂,又是还原剂( )
(10)将足量过氧化钠投入紫色石蕊溶液中,溶液先变蓝色后褪色,同时有气泡产生( )
答案:(1)√ (2)√ (3)× (4)× (5)× (6)√ (7)× (8)× (9)√ (10)√
[学霸微提醒]
(1)金属Na在空气中长期放置,最终会生成Na2CO3粉末,发生的反应为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3。
(2)Na2O2常温下为淡黄色固体,其他同颜色的物质有单质硫(黄色)、AgBr(浅黄色)、AgI(黄色)。
钠的性质
1.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
A.BaCl2溶液 B.K2SO4溶液
C.Ca(HCO3)2溶液 D.NH4NO3溶液
解析:选C 因为是溶液中的反应,所以都有H2产生,NH4NO3溶液还产生NH3,Ca(HCO3)2溶液还产生CaCO3沉淀。
2.(2019·崇明模拟)少量金属钠投入下列试剂中,反应最缓慢的是__________,既有气体又有沉淀的是__________。
A.NaHCO3溶液反应 B.饱和氯化铵溶液
C.0.1 mol·L-1 NaOH溶液 D.无水乙醇
解析:A项,少量金属钠投入NaHCO3溶液中,反应为2Na+2H2O===2NaOH+H2↑,NaOH+NaHCO3===Na2CO3+H2O;B项,金属钠投入饱和氯化铵溶液中,反应为2Na+2H2O===2NaOH+H2↑,反应消耗水,饱和氯化铵溶液析出氯化铵固体,可能释放出氨气;C项,少量金属钠投入0.1 mol·L-1 NaOH溶液中,反应为2Na+2H2O===2NaOH+H2↑;D项,少量金属钠投入无水乙醇中,反应为2Na+2C2H5OH===2C2H5ONa+H2↑;钠为活泼金属,钠与水溶液的反应,实质都是与H+的反应,乙醇为非电解质,不电离,与钠反应最缓慢。
答案:D B
[方法规律] 钠与盐溶液反应的原理分析
(1)与NaCl、Na2SO4、NaNO3溶液反应:实质是与水反应。
(2)与CuSO4溶液反应:钠先与水反应,生成的NaOH再与CuSO4反应,2OH-+Cu2+===Cu(OH)2↓。
(3)与铝盐溶液反应:要考虑钠与铝盐的量的问题,因为过量的NaOH溶液能溶解Al(OH)3,OH-+Al(OH)3===AlO+2H2O。
(4)与NaHCO3溶液反应:钠先与水反应,生成的NaOH再与NaHCO3反应,OH-+HCO===H2O+CO。
(5)与NH4Cl溶液反应:钠先与水反应,生成的NaOH再与NH4Cl反应,OH-+NH===NH3·H2O。
过氧化钠的性质
3.下列说法错误的是( )
A.(2017·江苏高考)Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.(2015·全国卷Ⅰ)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
C.(2014·全国卷Ⅱ)CO2通过Na2O2粉末后固体质量增重
D.(2015·四川高考)标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
解析:选D A项,Na2O2与CO2反应产生O2,可用作呼吸面具供氧剂,正确;B项,过氧化钠与水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,根据电子转移情况得关系式O2~2e-,可知生成0.1 mol氧气转移的电子数为0.2NA,正确;C项,2Na2O2+2CO2
===2Na2CO3+O2,2 mol CO2 生成1 mol O2,所以粉末固体质量增重,正确;D项,CO2与Na2O2发生反应的化学方程式为2CO2+2Na2O2===2Na2CO3+O2,每有2 mol CO2参加反应转移2 mol电子,标准状况下,5.6 L CO2的物质的量为0.25 mol,反应转移的电子数为0.25NA,错误。
4.过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项
二氧化碳
碳酸钠
转移的电子
A
1 mol
2NA
B
22.4 L
1 mol
C
106 g
1 mol
D
106 g
2NA
解析:选C
+2CO2===2Na2CO3+O2 Δm 转移电子
2 mol 2 mol 56 g 2 mol
1 mol 1 mol 28 g 1 mol
由上述关系可得出C项正确;B项未指明标准状况,错误。
[方法规律]
1.掌握Na2O2的强氧化性的两个角度
(1)从结构角度
Na2O2的结构中含有过氧链(—O—O—),含有过氧链结构的物质有较强的氧化性,以此类推,如H2O2、H2SO5(过一硫酸,相当于H2O2中的一个H被—SO3H取代)、Na2S2O8(过二硫酸钠)中都有过氧链结构,都是很强的氧化剂。
(2)从化合价的角度
Na2O2中的氧元素为-1价,有很强的氧化性,能氧化一些常见的还原剂,如SO2、Fe2+、SO、HSO、H2S、S2-、I-。同时-1价的O也有还原性,如遇到强氧化剂KMnO4也可以被氧化成O2。
2.Na2O2与H2O、CO2反应计算的三个关系
电子转
移关系
当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-,n(e-)=n(Na2O2)=2n(O2)
气体体
积变化
关系
若CO2、水蒸气(或两混合气体)通过足量Na2O2,气体体积的减少量是原气体体积的,等于生成氧气的量,ΔV=V(O2)=V(原气体)
固体质
量变化
关系
CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”,所以固体增加的质量Δm=28 g·mol-1×n(CO2)、Δm=2 g·mol-1×n(H2O)
1.(2019·商丘模拟)在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( )
A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中无水CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
解析:选C 实验现象说明熔融的钠将CuSO4中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,CuSO4作氧化剂。
2.下列有关Na2O2的说法不正确的是( )
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,涉及的氧化还原反应中,Na2O2
D.Na2O2粉末加入Ca(HCO3)2溶液中,会产生气体和浑浊
点拨:既是氧化剂又是还原剂,说明物质发生了歧化反应,类似的反应有S+NaOH(浓)、Cl2+NaOH、Na2O2+H2O等。
解析:选B A项,燃烧说明脱脂棉的温度达到着火点且有助燃物质氧气生成,正确;B项,反应物中没有单质参加反应,不符合置换反应的定义,错误;C项,Na2O2与CO2、H2O的反应都是Na2O2自身的氧化还原反应,正确;D项,Na2O2先和水反应生成O2和NaOH,NaOH再与Ca(HCO3)2 反应产生CaCO3沉淀,正确。
3.200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,则原混合气体的总物质的量是( )
A.0.125 mol B.0.25 mol
C.0.5 mol D.1 mol
点拨:CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”。
解析:选C 根据质量守恒定律可知,生成O2的质量为11.6 g-3.6 g=8 g,n(O2)==0.25 mol,根据Na2O2与H2O(g)、CO2反应的物质的量的关系可知,CO2和H2O(g)的物质的量之和为0.25 mol×2=0.5 mol。
4.某同学探究钠的性质时,将等量的金属钠分别投入下列溶液中,请你帮他完成实验报告:
序号
溶液
现象
解释及离子方程式
①
饱和NaCl溶液
②
饱和石灰水
③
CuSO4溶液
④
FeCl3溶液
归纳:钠与盐溶液反应的现象:浮、熔、游、响。消耗的水会使饱和盐溶液中的盐晶体析出;生成的NaOH再与溶液中的溶质反应产生现象。
答案:①溶液中出现浑浊 Na与H2O反应使水量减少,2Na+2H2O===2Na++2OH-+H2↑
②溶液中出现浑浊 Na与H2O反应放热,Ca(OH)2溶解度随温度升高而减小,且Na与H2O反应使水量减少,2Na+2H2O===2Na++2OH-+H2↑,产生的OH-促进Ca(OH)2(s)Ca2+(aq)+2OH-(aq)溶解平衡逆向移动
③溶液中出现蓝色沉淀 2Na+2H2O+Cu2+===Cu(OH)2↓+2Na++H2↑
④溶液中出现红褐色沉淀 6Na+6H2O+2Fe3+===2Fe(OH)3↓+6Na++3H2↑
考点(二) 氢氧化钠、钠的碳酸盐 【点多面广精细研】
1.氢氧化钠
(1)物理性质
NaOH的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有吸水性;吸收空气中的水分而潮解;有很强的腐蚀性。
(2)化学性质
①具有碱的通性。
②其他反应
与金属铝反应:
2Al+2OH-+2H2O===2AlO+3H2↑。
与非金属单质(Cl2)反应:
Cl2+2OH-===Cl-+ClO-+H2O。
酯类(CH3COOC2H5)水解:
CH3COOC2H5+NaOHCH3COONa+CH3CH2OH。
(3)NaOH的制取
①土法制碱:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
②现代工业制碱:
2NaCl+2H2O2NaOH+H2↑+Cl2↑。
2.碳酸钠和碳酸氢钠
(1)Na2CO3与NaHCO3的性质比较
Na2CO3
NaHCO3
俗名
纯碱、苏打
小苏打
颜色状态
白色粉末
白色晶体
溶解性
易溶于水
易溶于水
(溶解度比Na2CO3小)
水解(离子方程式,下同)
CO+H2OHCO+OH-
HCO+H2OH2CO3+OH-
与盐酸反应
CO+2H+===CO2↑+H2O
HCO+H+===H2O+CO2↑
与NaOH反应
不反应
HCO+OH-===CO+H2O
与足量Ca(OH)2反应
Ca2++CO===CaCO3↓
Ca2++OH-+HCO===CaCO3↓+H2O
与BaCl2反应
CO+Ba2+===BaCO3↓
不反应
与CO2反应
CO+CO2+H2O===2HCO
不反应
热稳定性
较稳定
2NaHCO3Na2CO3+CO2↑+H2O
相互转化
Na2CO3NaHCO3
(2)Na2CO3、NaHCO3的用途
①Na2CO3是一种非常重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。
②NaHCO3是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多的一种药剂。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)在酒精灯加热条件下,Na2CO3、NaHCO3固体都会分解( )
(2)向Na2CO3饱和溶液中通入足量CO2,会有NaHCO3晶体析出( )
(3)苏打是面包发酵粉的主要成分之一( )
(4)用酚酞溶液可鉴别饱和食盐水和饱和Na2CO3溶液( )
(5)相同温度下溶解度:小苏打<苏打,热稳定性:Na2CO3>NaHCO3( )
(6)Na2CO3溶液(杂质NaHCO3),选用适量的NaOH溶液( )
(7)NaHCO3溶液(杂质Na2CO3),应通入过量的CO2气体( )
答案:(1)× (2)√ (3)× (4)√ (5)√ (6)√ (7)√
[学霸微提醒]
碳酸盐、碳酸氢盐的区别
(1)溶解性:一般地,碳酸盐小于碳酸氢盐,如CaCO3
碳酸钠和碳酸氢钠的性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·全国卷Ⅱ)碳酸钠可用于去除餐具的油污( )
(2)(2018·江苏高考)物质性质与用途具有对应关系:NaHCO3受热易分解,可用于制胃酸中和剂( )
(3)(2018·江苏高考)NaHCO3(s)Na2CO3(s)NaOH(aq) ( )
(4)(2018·天津高考)溶解度:Na2CO3
(6)(2015·全国卷Ⅱ)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡( )
(7)(2014·全国卷Ⅰ)用热的烧碱溶液洗去油污,是因为Na2CO3可直接与油污反应( )
(8)(2014·全国卷Ⅱ)用热碱水清除炊具上残留的油污,没有发生化学反应( )
(9)(2014·全国卷Ⅱ)碳酸氢钠受热分解实验如图所示( )
答案:(1)√ (2)× (3)√ (4)× (5)× (6)× (7)× (8)× (9)×
2.(2019·雁峰区一模)下列有关Na2CO3和NaHCO3的比较中不正确的是( )
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,0.1 mol·L-1盐溶液的pH值:Na2CO3>NaHCO3
C.等质量的Na2CO3和NaHCO3分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3
D.相同温度下,0.1 mol·L-1盐溶液分别与0.1 mol·L-1 HCl溶液反应的剧烈程度:Na2CO3>NaHCO3
解析:选D NaHCO3受热易分解,不稳定,则热稳定性为Na2CO3>NaHCO3,故A正确;Na2CO3水解程度比NaHCO3大,物质的量浓度相同时,Na2CO3溶液碱性较大,故B正确;设质量都是106 g,则Na2CO3和NaHCO3的物质的量分别为1 mol、 mol,Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1 mol、 mol,即放出CO2的质量:Na2CO3<NaHCO3,故C正确;分别滴加HCl溶液,反应离子方程式分别为CO+2H+===CO2↑+H2O、HCO+H+===H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D错误。
方法规律
1.从“弱”字入手理解Na2CO3、NaHCO3的几个性质
(1)二者的水溶液都显碱性,是因为弱酸根CO和HCO的水解。Na2CO3溶液的碱性更强,是因为弱酸根CO的水解程度更大。
(2)与同浓度的盐酸反应,NaHCO3反应更剧烈,是因为CO和HCO与酸反应生成CO2,HCO只需要结合一个H+,而CO需要结合2个H+。
(3)向Na2CO3溶液中逐滴加入稀盐酸,边滴加边振荡,无气泡产生,是因为H+首先和CO反应生成HCO。
(4)向Na2CO3溶液中通入CO2气体,生成NaHCO3,可以理解为弱酸碳酸电离出的H+结合了CO生成了HCO。
2.Na2CO3、NaHCO3的鉴别与除杂
(1)Na2CO3、NaHCO3的鉴别方法
(2)Na2CO3、NaHCO3的除杂方法
依据二者性质的差异确定除杂方法(后者为杂质)
序号
混合物
除杂方法
①
Na2CO3(s)、NaHCO3
加热法
②
NaHCO3(aq)、Na2CO3
通入足量CO2
③
Na2CO3(aq)、NaHCO3
加入适量NaOH溶液
侯氏制碱法
3.(2016·江苏高考)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )
解析:选C A项,制取NH3应用Ca(OH)2和NH4Cl固体加热,不正确;B项,CO2气体应长管进、短管出,不正确;C项,析出的NaHCO3晶体用过滤的方法分离,正确;D项,NaHCO3应低温烘干,不能直接加热,易发生反应2NaHCO3Na2CO3+CO2↑+H2O,不正确。
4.工业上以粗盐(含Ca2+、Mg2+、SO等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如图甲所示。下列说法正确的是( )
A.饱和食盐水中先通入的气体为CO2
B.流程图中的“系列操作”中一定需要使用玻璃棒
C.如图乙所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
D.除去粗盐溶液中的杂质可依次加入过量NaOH、Na2CO3、BaCl2溶液,过滤后再加入盐酸调节溶液的pH
解析:选B A项,CO2在水中溶解度较小,NH3溶解度较大,故应先通入NH3,使溶液为碱性溶液,再通入CO2,可以达到实验目的,错误;B项,从溶液中得到固体,需要加热浓缩、冷却结晶、过滤等操作,因此流程图中的“系列操作”中一定需要玻璃棒搅拌、引流等,正确;C项,Na2CO3加热不易分解,NaHCO3晶体加热容易分解,故小试管中盛放NaHCO3,大试管中盛放Na2CO3,错误;D项,除去粗盐中的Ca2+、Mg2+、SO及泥沙,可以加过量BaCl2除去SO,然后加NaOH除去Mg2+,用Na2CO3除去Ca2+和过量的Ba2+,盐酸要放在最后,除去过量的NaOH和Na2CO3,错误。
[归纳拓展] 侯氏制碱法
(1)原料
食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气,其反应为C+H2O(g) CO+H2,CO+H2O(g)CO2+H2。
(2)工艺流程
(3)反应原理
①产生NaHCO3的反应:
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。
②产生Na2CO3的反应:
2NaHCO3Na2CO3+CO2↑+H2O。
(4)循环使用的物质:CO2、饱和食盐水。
Na2CO3、NaHCO3、NaOH及其混合物与盐酸反应的图像问题
5.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
解析:选C 向NaOH与Na2CO3的混合溶液中滴加盐酸,盐酸首先与NaOH反应,然后与Na2CO3反应转化为NaHCO3:CO+H+===HCO,之后与HCO反应生成CO2,因n(OH-)=n(CO)=0.01 mol,故加入0.02 mol HCl后开始有气体生成。结合各物质的量分析图像可知,选项C符合题意。
6.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
(1)在A情况下,溶质是__________________(填化学式),其物质的量之比为________。
(2)在B情况下,溶质是__________________(填化学式),其物质的量之比为________。
(3)原氢氧化钠溶液的物质的量浓度为___________________________________。
解析:(1)CO2与NaOH溶液反应后,其溶质可能为NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3;A中,x=100时开始生成CO2,x=150时反应完全,溶质为Na2CO3与NaOH,且n(Na2CO3)∶n(NaOH)=1∶1。
(2)B图像中,开始无CO2生成,含有Na2CO3,至无气体放出时消耗盐酸150 mL-50 mL=100 mL,是50 mL的2倍,则含有NaHCO3,n(Na2CO3)∶n(NaHCO3)=1∶1。
(3)当加入150 mL盐酸时,恰好完全反应,此时溶液中溶质为NaCl。据物料守恒有n(NaOH)=n(Na+)=n(Cl-)=0.2 mol·L-1×0.15 L=0.03 mol,所以c(NaOH)==1.5 mol·L-1。
答案:(1)NaOH、Na2CO3 1∶1
(2)Na2CO3、NaHCO3 1∶1 (3)1.5 mol·L-1
归纳拓展
Na2CO3、NaHCO3、NaOH及其混合物与盐酸反应的4类图像
(1)向Na2CO3溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示)。
图像特点
Oa段、ab段消耗盐酸的体积相等
反应原理
Oa段离子方程式:
CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
(2)向NaHCO3溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示)。
图像特点
从O点开始即产生CO2气体
反应原理
离子方程式:HCO+H+===H2O+CO2↑
(3)向Na2CO3、NaHCO3的混合溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示,设Na2CO3、NaHCO3的物质的量之比为m∶n=1∶1,其他比例时的图像略)。
图像特点
Oa段消耗盐酸的体积小于ab段消耗盐酸的体积
反应原理
Oa段离子方程式:CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
(4)向NaOH、Na2CO3的混合溶液中逐滴加入盐酸
消耗盐酸的体积与产生CO2的体积关系(如图所示,设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略)。
图像特点
Oa段消耗盐酸的体积大于ab段消耗盐酸的体积
反应原理
Oa段离子方程式:
H++OH-===H2O,CO+H+===HCO;
ab段离子方程式:HCO+H+===H2O+CO2↑
1.(2019·衡阳模拟)我国医学家通过研究发现小苏打可去除肿瘤内的氢离子,从而快速有效地杀死处于葡萄糖饥饿或缺乏状态的肿瘤细胞,为治疗原发性肝癌开辟了新路径。下列有关小苏打的说法错误的是( )
A.可用于制备苏打
B.可用于制作糕点
C.与H+作用易产生CO2
D.可用饱和食盐水与CO2反应制得
解析:选D NaHCO3俗称小苏打,Na2CO3俗称苏打,NaHCO3受热分解生成Na2CO3,则可用于制备苏打,故A正确;NaHCO3能与H+反应生成CO2,用于制发酵粉,可用于制作糕点,故B、C正确;饱和食盐水与CO2不反应,所以不能用饱和食盐水与CO2反应制得小苏打,故D错误。
2.关于Na2CO3和NaHCO3的下列说法中正确的是( )
A.CaCl2溶液和二者的溶液都能反应产生白色沉淀
B.石灰水能和NaHCO3溶液反应,不与Na2CO3溶液反应
C.与足量的盐酸反应,Na2CO3产生气体的体积大
D.等物质的量的Na2CO3和NaHCO3与足量的盐酸反应,产生CO2的物质的量相同
抓关键:“等质量”说明Na2CO3的物质的量小于NaHCO3,则与足量盐酸反应生成CO2气体的物质的量:n(Na2CO3)
CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O(NaHCO3足量),故B错误;根据反应的方程式Na2CO3+2HCl===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O可知,106 g Na2CO3完全反应生成1 mol CO2,84 g NaHCO3完全反应生成1 mol CO2,所以等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大,故C错误;由方程式Na2CO3+2HCl===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O可知,等物质的量的两种盐与足量盐酸反应,产生的CO2的物质的量相同,故D正确。
3.向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0
D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况)
掌握图像题的解题技巧
①图像题往往涉及按不同产物产生不同情况,即横轴的物质开始时不足,逐渐加入会出现过量。
②注意图像中“拐点”,“拐点”表示一个反应刚刚结束,另一个反应刚刚开始。
③曲线的变化趋势表示物质的反应顺序,如:OH-、CO、HCOCO、HCOHCOCO2↑+H2O。
④解题时将曲线的变化趋势转化成反应,即书写反应方程式,代入数值计算。
解析:选A 加入50 mL盐酸时,恰好反应生成NaCl,根据物料守恒可知,n(HCl)=n(NaOH),所以c(NaOH)==0.5 mol·L-1,A项正确;根据图像可知,甲溶液中含有的溶质为Na2CO3和NaHCO3,所以当0
(1)A中制备气体时,所需药品是____________(填字母)。
(2)B中盛有饱和碳酸氢钠溶液,其作用是_________________________________。
(3)在实验过程中,向C中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是________________________________________________________________________
________________________________________________________________________。
(4)E装置向C中通气的导管不能插入液面下的原因是
________________________________________________________________________。
牢记侯氏制碱法工作原理
向饱和NaCl溶液中先通入足量NH3,再通入足量CO2,析出晶体:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,该反应利用了物质溶解度差异来制备NaHCO3。
解析:(1)制取CO2是用石灰石和盐酸在烧瓶中发生反应产生的,由于CO2在水中溶解度不大,所以导气管要伸入到液面以下,而制取氨气是将浓氨水滴入到盛有生石灰的烧瓶中反应制取的,氨气在水中非常容易溶解,所以导气管要在液面以上,根据在C中导气管的长短可知:在A中制备CO2气体,所需药品是ac。(2)用盐酸制取CO2气体时,由于盐酸有挥发性,所以其中含有杂质HCl,在B中盛有饱和碳酸氢钠溶液,其作用就是除去CO2中的杂质HCl。(3)CO2在水中的溶解度小,产生的HCO的浓度也就小,不容易形成NaHCO3的饱和溶液,所以难形成沉淀,因此在实验过程中,向C中先通入NH3使溶液呈碱性,能吸收大量CO2气体产生较高浓度的HCO,才能析出NaHCO3晶体。(4)E装置向C中通气的导管不能插入液面下是为了防止倒吸现象的发生。
答案:(1)ac (2)除去CO2中的HCl
(3)由于CO2在NaCl溶液中的溶解度很小,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO,才能析出NaHCO3晶体 (4)防倒吸
相关资料
更多








