
- 2020版高考一轮复习化学新课改省份专用学案:第五章第3课时 化学能与电能(1)——原电池、化学电源(过基础) 学案 0 次下载
- 2020版高考一轮复习化学新课改省份专用学案:第五章第4课时 化学能与电能(2)——新型化学电源(过题型) 学案 0 次下载
- 2020版高考一轮复习化学新课改省份专用学案:第五章第6课时 化学能与电能(4)——电化学原理的综合应用(过综合) 学案 0 次下载
- 2020版高考一轮复习化学新课改省份专用学案:第五章第7课时 化学能与电能(5)——含离子交换膜电池的应用(过热点) 学案 0 次下载
- 2020版高考一轮复习化学新课改省份专用学案:第六章第1课时 点点突破——反应速率及影响因素 学案 0 次下载
2020版高考一轮复习化学新课改省份专用学案:第五章第5课时 化学能与电能(3)——电解原理及应用(过基础)
展开第5课时 化学能与电能(3)——电解原理及应用(过基础)
知识点一 电解原理
1.电解池
(1)电解池:把电能转化为化学能的装置。
(2)构成条件
①有与直流电源相连的两个电极;
②电解质溶液(或熔融盐);
③形成闭合回路。
(3)工作原理(以惰性电极电解CuCl2溶液为例)
总反应离子方程式:Cu2++2Cl-Cu+Cl2↑
①电极
阴极:与电源负极相连,得到电子,发生还原反应。
阳极:与电源正极相连,失去电子,发生氧化反应。
②电子和离子的移动方向(惰性电极)
[提醒] ①金属活动性顺序中银以前的金属(含银)作电极时,由于金属本身可以参与阳极反应,称为金属电极或活性电极(如Zn、Fe、Cu、Ag等);金属活动性顺序中银以后的金属或非金属作电极时,称为惰性电极,主要有铂(Pt)、石墨等。
②电解时,在外电路中有电子通过,而在溶液中是靠离子移动导电,即电子不通过电解质溶液。
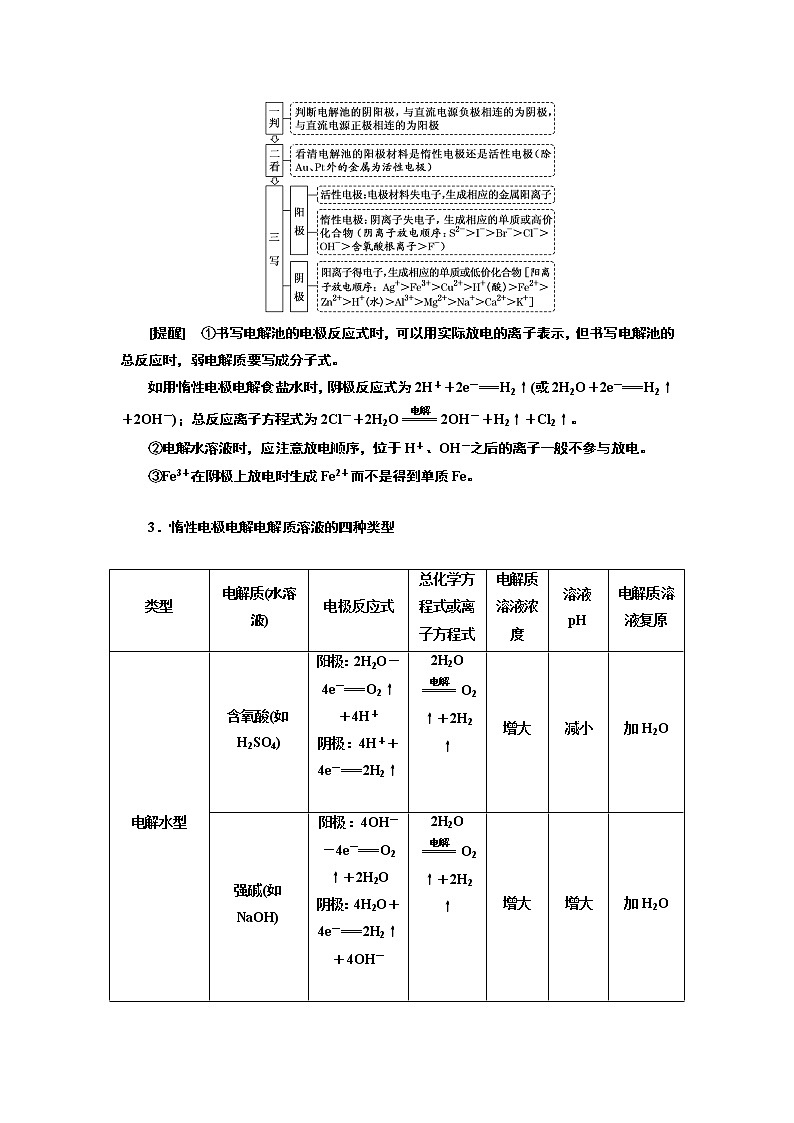
2.电极反应式的书写步骤
[提醒] ①书写电解池的电极反应式时,可以用实际放电的离子表示,但书写电解池的总反应时,弱电解质要写成分子式。
如用惰性电极电解食盐水时,阴极反应式为2H++2e-===H2↑(或2H2O+2e-===H2↑+2OH-);总反应离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑。
②电解水溶液时,应注意放电顺序,位于H+、OH-之后的离子一般不参与放电。
③Fe3+在阴极上放电时生成Fe2+而不是得到单质Fe。
3.惰性电极电解电解质溶液的四种类型
类型 | 电解质(水溶液) | 电极反应式 | 总化学方程式或离子方程式 | 电解质溶液浓度 | 溶液pH | 电解质溶液复原 |
电解水型 | 含氧酸(如H2SO4) | 阳极:2H2O-4e-===O2↑+4H+ 阴极:4H++4e-===2H2↑
| 2H2OO2↑+2H2↑ | 增大 | 减小 | 加H2O |
强碱(如NaOH) | 阳极:4OH--4e-===O2↑+2H2O 阴极:4H2O+4e-===2H2↑+4OH-
| 2H2OO2↑+2H2↑ | 增大 | 增大 | 加H2O | |
活泼金属的含氧酸盐(如K N O3、Na2SO4) | 阳极:4OH--4e-===O2↑+2H2O阴极:4H++4e-===2H2↑ | 2H2OO2↑+2H2↑ | 增大 | 不变 | 加H2O | |
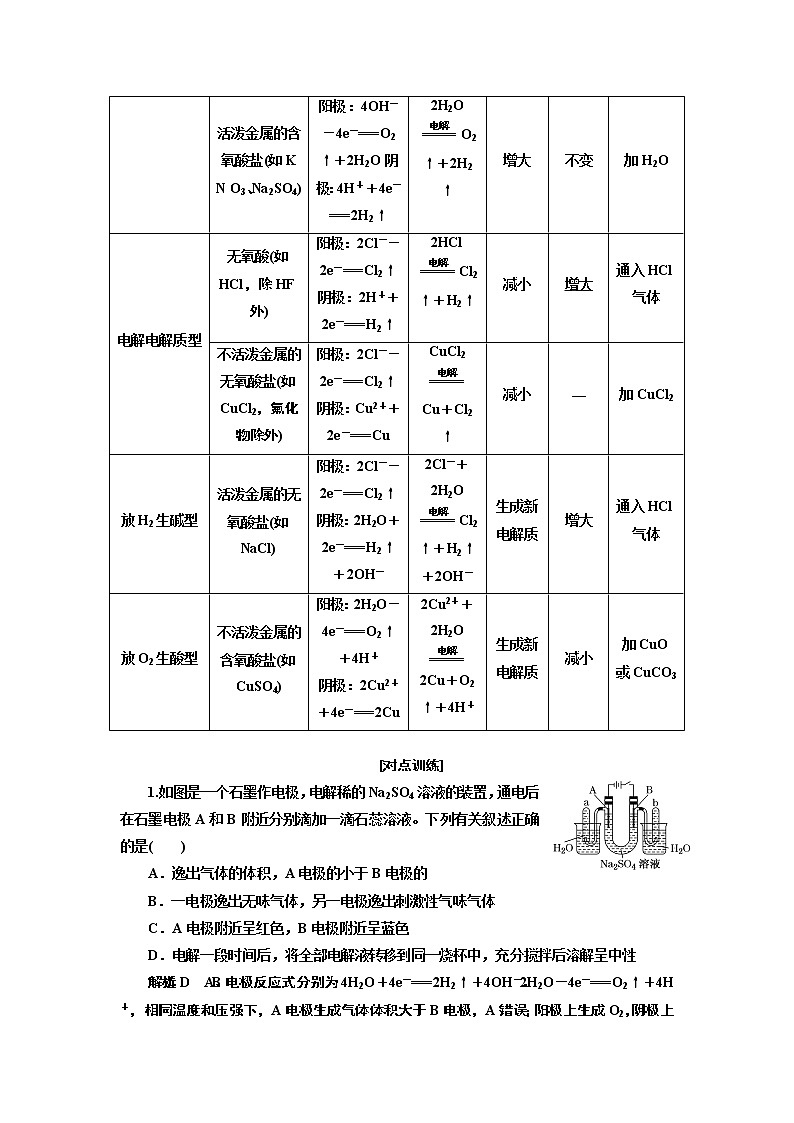
电解电解质型 | 无氧酸(如HCl,除HF外) | 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ | 2HClCl2↑+H2↑ | 减小 | 增大 | 通入HCl气体 |
不活泼金属的无氧酸盐(如CuCl2,氟化物除外) | 阳极:2Cl--2e-===Cl2↑ 阴极:Cu2++2e-===Cu | CuCl2 Cu+Cl2↑ | 减小 | — | 加CuCl2 | |
放H2生碱型 | 活泼金属的无氧酸盐(如NaCl) | 阳极:2Cl--2e-===Cl2↑ 阴极:2H2O+2e-===H2↑+2OH- | 2Cl-+2H2O Cl2↑+H2↑+2OH- | 生成新电解质 | 增大 | 通入HCl气体 |
放O2生酸型 | 不活泼金属的含氧酸盐(如CuSO4) | 阳极:2H2O-4e-===O2↑+4H+ 阴极:2Cu2++4e-===2Cu | 2Cu2++2H2O2Cu+O2↑+4H+ | 生成新电解质 | 减小 | 加CuO或CuCO3 |
[对点训练]
1.如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是( )
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
解析:选D A、B电极反应式分别为4H2O+4e-===2H2↑+4OH-、2H2O-4e-===O2↑+4H+,相同温度和压强下,A电极生成气体体积大于B电极,A错误;阳极上生成O2,阴极上生成H2,O2和H2都是无色无味气体,B错误;由电极反应式知,A电极附近溶液呈碱性,B电极附近溶液呈酸性,则A电极附近溶液呈蓝色,B电极附近溶液呈红色,C错误;惰性电极电解稀的Na2SO4溶液,实际是电解水,将全部电解液转移到同一烧杯中,充分搅拌后溶液呈中性,D正确。
2.用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2
B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3
D.HCl HNO3 K2SO4
解析:选B AgNO3、Cu(NO3)2、CuSO4溶液随电解的进行,有酸产生,溶液pH降低;KCl、CaCl2溶液随电解的进行,有碱产生,溶液pH升高;CuCl2、HCl电解的电解质本身,溶液中CuCl2、HCl减少,对应的H+减少,溶液的pH升高;KOH、HNO3相当于电解H2O,电解质浓度增大,对应的碱溶液碱性更强,酸溶液酸性更强。
3.如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )
A.电路中电子流向:负极→d→c→b→a→正极
B.a、c两极产生气体的物质的量相等
C.SO向b电极移动,Cl-向c电极移动
D.通电后乙烧杯滴入酚酞溶液d极附近会变红
解析:选D 电子只能在外电路中移动,故A错误;a极产生O2,c极产生Cl2,根据电子守恒O2~2Cl2~4e-,O2和Cl2的物质的量之比为1∶2,故B错误;阴离子向阳极移动,a和c是阳极,所以SO向a电极移动,Cl-向c电极移动,故C错误;d极是阴极,电极反应式可表示为2H2O+2e-===H2↑+2OH-,所以滴入酚酞溶液d极附近会变红,故D正确。
4.按要求书写电极反应式和总反应式。
(1)用惰性电极电解AgNO3溶液
阳极反应式: ________________________________________________________;
阴极反应式:_________________________________________________________;
总反应离子方程式: _________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式:________________________________________________________________________;
阴极反应式:__________________________________________________________;
总反应离子方程式: ___________________________________________________。
(3)用Fe作电极电解NaCl溶液
阳极反应式: ______________________________________________________;
阴极反应式: _________________________________________________________;
总反应化学方程式: ___________________________________________________。
(4)用Al作电极电解NaOH溶液
阳极反应式: _________________________________________________________;
阴极反应式:___________________________________________________________;
总反应离子方程式: _______________________________________________。
(5)用Cu作电极电解HCl溶液
阳极反应式:_________________________________________________________;
阴极反应式:_________________________________________________________;
总反应离子方程式:_________________________________________。
(6)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式: ________________________________________________________;
阴极反应式: _________________________________________________________;
总反应离子方程式: ____________________________________________________。
答案:(1)2H2O-4e-===O2↑+4H+
4Ag++4e-===4Ag
4Ag++2H2O4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑
2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+ 2H2O+2e-===H2↑+2OH-
Fe+2H2OFe(OH)2↓+H2↑
(4)2Al-6e-+8OH-===2AlO+4H2O
6H2O+6e-===3H2↑+6OH-
2Al+2H2O+2OH-2AlO+3H2↑
(5)Cu-2e-===Cu2+ 2H++2e-===H2↑
Cu+2H+Cu2++H2↑
(6)2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
2Al+3H2OAl2O3+3H2↑
知识点二 电解原理的应用
1.电解饱和食盐水
(1)电极反应
阳极:2Cl--2e-===Cl2↑(反应类型:氧化反应),
阴极:2H++2e-===H2↑(反应类型:还原反应)。
(2)总反应式
总反应化学方程式:
2NaCl+2H2O2NaOH+H2↑+Cl2↑。
总反应离子方程式:
2Cl-+2H2O2OH-+H2↑+Cl2↑。
(3)氯碱工业制烧碱、氢气和氯气
装置 | 离子交换膜电解槽 |
阳极 | 钛网(涂有钛、钌等氧化物涂层) |
阴极 | 碳钢网 |
阳离子交换膜 | ①只允许阳离子通过,能阻止阴离子和气体通过 ②将电解槽隔成阳极室和阴极室 |
2.电镀
应用电解原理,在某些金属表面镀上一薄层其他金属或合金的过程。
实例——电镀铜
阳极(铜片):Cu-2e-===Cu2+
阴极(待镀铁件):Cu2++2e-===Cu
[提醒 ] ①电镀时阳极固体减少的质量和阴极析出固体的质量相等。
②电镀时,电解质溶液的浓度不变。
3.电解精炼铜
(1)电极材料:阳极为粗铜,阴极为纯铜。
(2)电解质溶液:含Cu2+的盐溶液。
(3)电极反应式
阳极:Zn-2e-===Zn2+ Fe-2e-===Fe2+ Ni-2e-===Ni2+、Cu-2e-===Cu2+;
阴极:Cu2++2e-===Cu。
[提醒] ①电解精炼铜时,阳极减少的质量与阴极增加的质量不相等,电解质溶液的浓度减小。
②粗铜中不活泼的杂质(金属活动性顺序中位于铜之后的银、金等),在阳极难以失去电子,当阳极上的铜失去电子变成离子之后,它们以金属单质的形式沉积于电解槽的底部,成为阳极泥。
4.电冶金
利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。
| 总方程式 | 阳极、阴极反应式 |
冶炼钠 | 2NaCl(熔融)2Na+Cl2↑ | 2Cl--2e-===Cl2↑、2Na++2e-===2Na |
冶炼镁 | MgCl2(熔融)Mg+Cl2↑ | 2Cl--2e-===Cl2↑、Mg2++2e-===Mg |
冶炼铝 | 2Al2O3(熔融)4Al+3O2↑ | 6O2--12e-===3O2↑、4Al3++12e-===4Al |
[对点训练]
1.利用如图所示装置模拟电解原理在工业生产中的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
解析:选D 氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,但是粗铜中含有锌、铁、镍等杂质,使得溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。
2.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
解析:选C 电解法制备高纯度的镍,粗镍作为阳极,金属按还原性顺序Zn>Fe>Ni>Cu>Pt发生氧化反应,电极反应依次为Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+,A项错误;电解过程中,阳极Zn、Fe、Ni溶解,Cu、Pt沉积到电解槽底部,阴极只析出Ni,结合两极转移的电子数相等,阳极质量的减少量与阴极质量的增加量不相等,B项错误;Cu和Pt还原性比Ni弱,不能失去电子,以沉淀的形式沉积在电解槽底部,形成阳极泥,C项正确;电解后,溶液中存在的金属阳离子除了Fe2+、Zn2+外,还有Ni2+,D项错误。
3.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为Al3++3e-===Al
D.SO在电解过程中向阳极移动
解析:选C 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,则铝制品为阳极,即待加工铝质工件为阳极,A正确;选用不锈钢网作为阴极不会影响电极反应及总反应,故可选用不锈钢网作为阴极,B正确;阴极的电极反应式为2H++2e-===H2↑,C不正确;电解过程中,阴离子向阳极移动,故SO在电解过程中向阳极移动,D正确。








