
2020版高考一轮复习化学新课改省份专用学案:第七章第6课时 点点突破——难溶电解质的溶解平衡
展开第6课时 点点突破——难溶电解质的溶解平衡
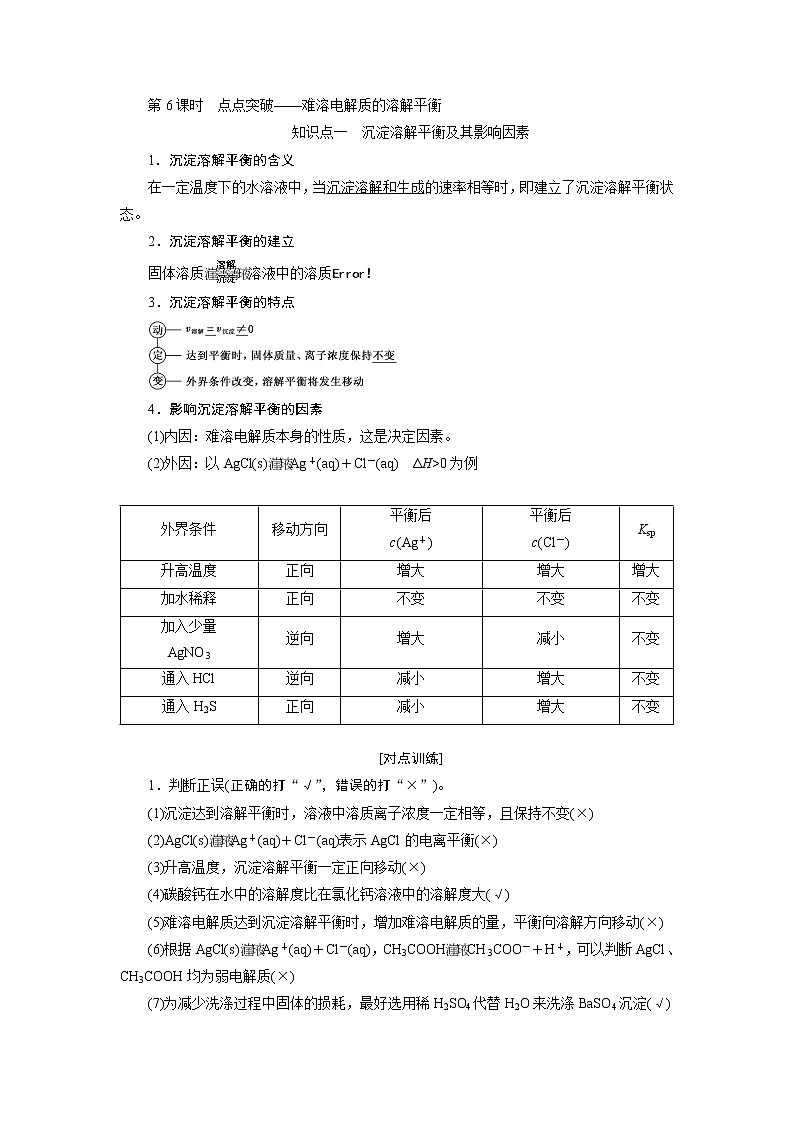
知识点一 沉淀溶解平衡及其影响因素
1.沉淀溶解平衡的含义
在一定温度下的水溶液中,当沉淀溶解和生成的速率相等时,即建立了沉淀溶解平衡状态。
2.沉淀溶解平衡的建立
固体溶质溶液中的溶质
3.沉淀溶解平衡的特点
4.影响沉淀溶解平衡的因素
(1)内因:难溶电解质本身的性质,这是决定因素。
(2)外因:以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例
外界条件 | 移动方向 | 平衡后 c(Ag+) | 平衡后 c(Cl-) | Ksp |
升高温度 | 正向 | 增大 | 增大 | 增大 |
加水稀释 | 正向 | 不变 | 不变 | 不变 |
加入少量 AgNO3 | 逆向 | 增大 | 减小 | 不变 |
通入HCl | 逆向 | 减小 | 增大 | 不变 |
通入H2S | 正向 | 减小 | 增大 | 不变 |
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变(×)
(2)AgCl(s)Ag+(aq)+Cl-(aq)表示AgCl的电离平衡(×)
(3)升高温度,沉淀溶解平衡一定正向移动(×)
(4)碳酸钙在水中的溶解度比在氯化钙溶液中的溶解度大(√)
(5)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动(×)
(6)根据AgCl(s)Ag+(aq)+Cl-(aq),CH3COOHCH3COO-+H+,可以判断AgCl、CH3COOH均为弱电解质(×)
(7)为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀(√)
2.有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
解析:选B 沉淀溶解平衡的实质是v(沉淀)=v(溶解)≠0,A对。AgCl(s)Ag+(aq)+Cl-(aq)是动态平衡,B错。溶解过程吸热,C对。加入NaCl固体,c(Cl-)增大,AgCl溶解平衡左移,D对。
3.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
A.加MgSO4 B.加HCl溶液
C.加NaOH D.加水
解析:选D 加MgSO4会使该溶解平衡左移,Mg(OH)2 固体增多,c(Mg2+)变大;加HCl溶液使该溶解平衡右移,Mg(OH)2固体减少,c(Mg2+)变大;加NaOH使该溶解平衡左移,Mg(OH)2固体增多,c(Mg2+)变小。
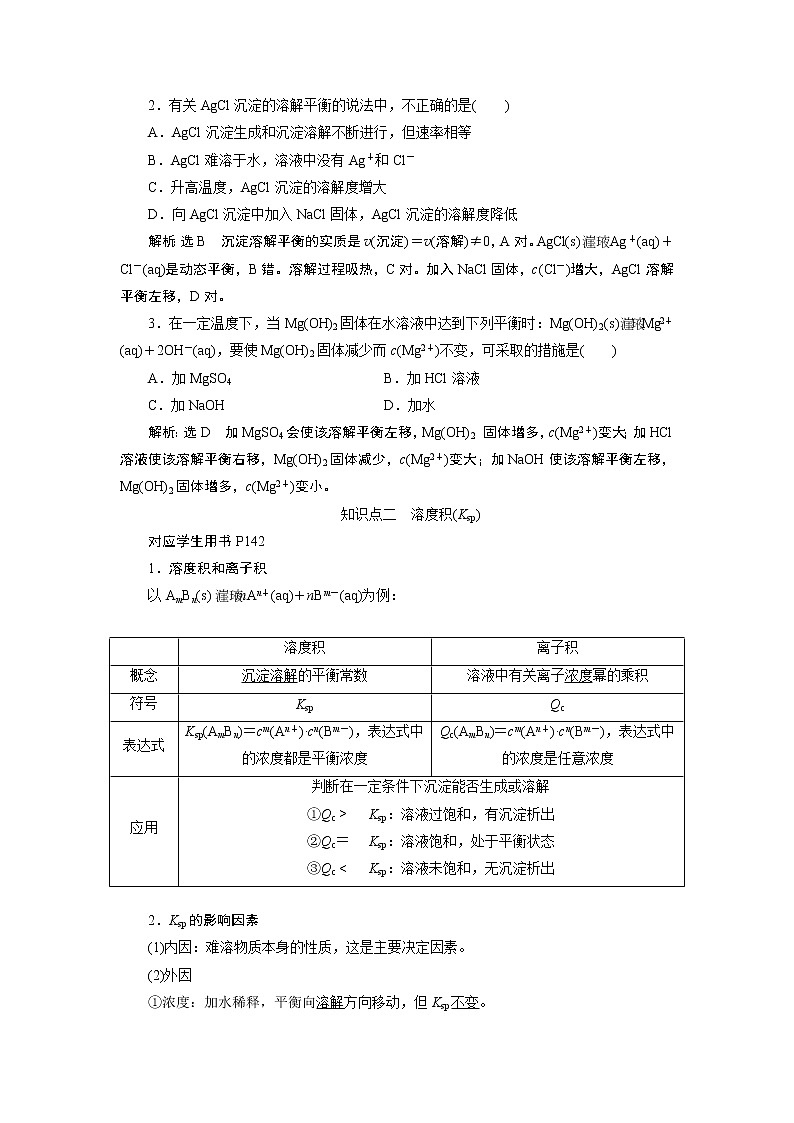
知识点二 溶度积(Ksp)
对应学生用书P142
1.溶度积和离子积
以AmBn(s) mAn+(aq)+nBm-(aq)为例:
| 溶度积 | 离子积 |
概念 | 沉淀溶解的平衡常数 | 溶液中有关离子浓度幂的乘积 |
符号 | Ksp | Qc |
表达式 | Ksp(AmBn)=cm(An+)·cn(Bm-),表达式中的浓度都是平衡浓度 | Qc(AmBn)=cm(An+)·cn(Bm-),表达式中的浓度是任意浓度 |
应用 | 判断在一定条件下沉淀能否生成或溶解 ①QcKsp:溶液过饱和,有沉淀析出 ②QcKsp:溶液饱和,处于平衡状态 ③QcKsp:溶液未饱和,无沉淀析出 | |
2.Ksp的影响因素
(1)内因:难溶物质本身的性质,这是主要决定因素。
(2)外因
①浓度:加水稀释,平衡向溶解方向移动,但Ksp不变。
②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度(×)
(2)向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI)(√)
(3)常温下,向BaCO3的饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小(×)
(4)溶度积常数Ksp只受温度影响,温度升高,Ksp增大(×)
(5)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变(√)
2.(2019·孝义模拟)25 ℃,向100 mL 0.09 mol·L-1 BaCl2溶液中加入100 mL 0.1 mol·L-1 H2SO4溶液生成BaSO4沉淀。已知:Ksp(BaSO4)=1.1×10-10,且溶液的温度和体积的变化都忽略不计,则生成沉淀后的体系中c(Ba2+)和pH分别为( )
A.1.1×10-9 mol·L-1、1 B.1.1×10-9 mol·L-1、2
C.2.2×10-8 mol·L-1、1 D.2.2×10-8 mol·L-1、2
解析:选C BaCl2与H2SO4溶液发生反应:BaCl2+H2SO4===BaSO4↓+2HCl,n(BaCl2)=0.09 mol·L-1×0.1 L=0.009 mol,n(H2SO4)=0.1 L×0.1 mol·L-1=0.01 mol,故两溶液反应后剩余0.001 mol H2SO4,此时c(H2SO4)==0.005 mol·L-1,故生成沉淀后的体系中c(Ba2+)== mol·L-1=2.2×10-8 mol·L-1。溶液中H+未参与离子反应,则有c(H+)=0.1 mol·L-1×2×=0.1 mol·L-1,故溶液的pH=-lg c(H+)=-lg 0.1=1。
3.(2019·昌乐二中月考)已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,下列说法正确的是( )
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中Ksp(CaF2)=
D.该体系中有CaF2沉淀产生
解析:选D HF为弱酸,不能完全电离,则25 ℃时,0.1 mol·L-1 HF溶液中pH>1,A项错误;Ksp只与温度有关,B项错误;由已知得Ksp(CaF2)≠,C项错误;两溶液混合后,c(Ca2+)=0.1 mol·L-1,c(F-)==6×10-3 mol·L-1,则Qc=c2(F-)·c(Ca2+)=3.6×10-6>Ksp(CaF2),故体系中有CaF2沉淀产生,D项正确。
知识点三 沉淀溶解平衡的应用
1.沉淀的生成
(1)原理:当Qc>Ksp时,难溶电解质的溶解平衡向左移动,生成沉淀。
(2)应用:可利用生成沉淀来达到除去溶液中杂质离子的目的。
(3)方法:
①调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右,离子方程式为Fe3++3NH3·H2O=== 。
②沉淀剂法:如用H2S沉淀Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+。
[提醒] 若一种沉淀剂可使溶液中多种离子产生沉淀时,则可控制条件,使这些离子先后分别沉淀。
①对同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀效果越好。
②对不同类型的沉淀,其沉淀先后顺序要通过计算才能确定。
2.沉淀的溶解
(1)原理:当Qc<Ksp时,难溶电解质的溶解平衡向右移动,沉淀溶解。
(2)方法:
①酸溶解法: CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O。
②盐溶解法:Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH===Mg2++2NH3·H2O。
③氧化还原溶解法:不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法:AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
3.沉淀的转化
(1)实质:沉淀溶解平衡的移动。
(2)举例:MgCl2溶液Mg(OH)2Fe(OH)3,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
(3)规律:一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
(4)应用
①锅炉除水垢:将CaSO4转化为CaCO3,离子方程式为CaSO4+CO===CaCO3+SO。
②矿物转化:CuSO4溶液遇ZnS转化为CuS,离子方程式为ZnS+Cu2+===CuS+Zn2+。
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)BaCO3不溶于水,故可用作钡餐(×)
(2)在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl,沉淀量不变(×)
(3)FeS可使Hg2+转化为HgS而除去,是因为HgS的溶解度比FeS的溶解度更小(√)
(4)一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全(√)
(5)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀(√)
(6)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色沉淀,离子方程式为2AgCl+S2-===Ag2S+2Cl-(√)
(7)向Na2SO4溶液中加入过量的BaCl2溶液,则SO沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO(×)
2.要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,沉淀剂最好选用( )
A.硫化物 B.硫酸盐
C.碳酸盐 D.以上沉淀剂均可
解析:选A 沉淀工业废水中的Pb2+时,生成沉淀的反应进行得越完全越好,由于PbS的溶解度最小,故选硫化物作为沉淀剂。
3.化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=
解析:选B 根据沉淀转化向溶度积小的方向进行,Ksp(MnS)>Ksp(CuS),A对;该反应达平衡时c(Mn2+)、c(Cu2+)保持不变,但不一定相等,B错;往平衡体系中加入少量CuSO4固体后,平衡正向移动,c(Mn2+)变大,C对;该反应的平衡常数K===,D对。








