






人教版 (2019)必修 第一册第三节 物质的量教案配套ppt课件
展开1994年美国俄亥俄州丹佛市的路易斯·史丹佛决定将他收藏了65年共40桶硬币存入银行,可是,他的财富对于银行的工作人员来说却意味着繁重的工作。
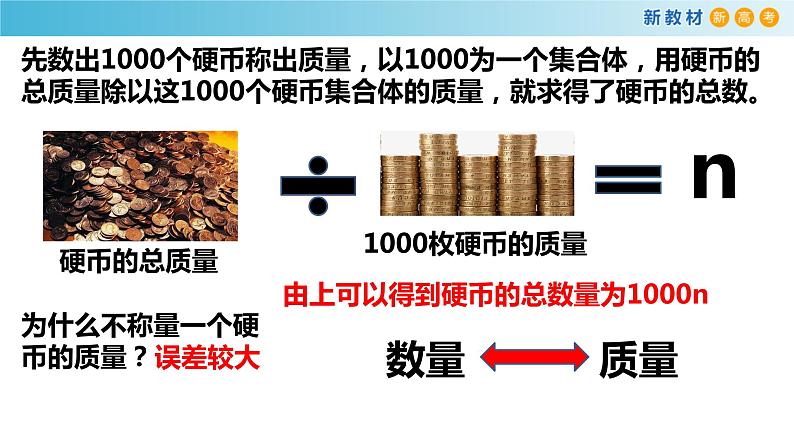
由上可以得到硬币的总数量为1000n
为什么不称量一个硬币的质量?
先数出1000个硬币称出质量,以1000为一个集合体,用硬币的总质量除以这1000个硬币集合体的质量,就求得了硬币的总数。
这杯水里有多少水分子呢?
就如同上面的1000枚硬币的作用,我们需要建立一个将质量和粒子数量联系起来的纽带。
我们也可以先得到一定数量的水分子的质量,再用一杯水的质量除以上面的数字,进而得到一杯水中的水分子数量。
物质的量是一个物理量,它表示一定数目粒子的集合体,符号是n。
长度是衡量物体长短的物理量
物质的量是衡量物质所含微观粒子数目的物理量
1、物质的量是衡量物质所含微观粒子数目的物理量
物理量可能有很多单位,例如,长度的单位有:
毫米、厘米、米、尺、光年……
国际单位制的单位是米,原因是什么?
物质的量选择“个”作为单位是不是合适呢?
2、摩尔(ml):摩尔是物质的量的单位
摩尔应该是一个很庞大的数量单位,那么多少是1ml呢?
1ml任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023ml-1
N代表物质中所含的粒子数量
1、物质的量只用于衡量微观粒子,不可用于衡量宏观物质
人不会多到值当用摩尔来度量
2、初中的粒子数量一般用“个”衡量,高中用“摩尔”衡量
1个CO2分子由1个C原子和2个O原子构成
1ml CO2分子中含有1ml C原子和2mlO原子
练习:0.1mlCH4中有 ml H;含有0.12ml O的SO3的物质的量为 ml;0.1ml CuSO4·5H2O中含有 ml H2O。
1个CH4中有4个H→1ml CH4中有4ml H→0.1ml CH4中有0.4ml H
1个SO3中有3个O→1ml SO3中有3ml O→0.04ml SO3中有0.12ml O
1个CuSO4·5H2O中有5个H2O→1ml CuSO4·5H2O中有5ml H2O →0.1ml CuSO4·5H2O中有0.5ml H2O
这种“整体”和“部分”的物质的量求算问题,可以先讨论1个“整体”中有几个“部分”,再延伸至1ml“整体”中有多少ml“部分”。
0.2ml CuSO4·5H2O中含有 ml O
1个CuSO4·5H2O中含有9个O原子,所以1ml CuSO4·5H2O中含有9ml O原子,即0.2ml CuSO4·5H2O中含有1.8 ml的O原子
【练习】(1)有1mlCl2与足量氢氧化钠溶液反应,生成 ml NaCl,转移 ml电子。(2)过氧化钠与水反应,当转移0.2ml电子时得到 ml氧气。(3)0.1ml NH4+中有 ml电子,有 ml质子。
Cl2 + 2NaOH= NaCl + NaClO + H2O
每反应1个Cl2应该得到1个NaCl,所以1mlCl2与足量氢氧化钠溶液反应,生成1ml NaCl
每反应1个Cl2应该转移1个电子,所以1mlCl2与足量氢氧化钠溶液反应,转移1ml 电子
2Na2O2 + 2H2O = 4NaOH + O2↑
每生成1个O2,转移2个电子,所以当转移0.2ml电子时得到0.1ml氧气
N是第7号元素,原子内有7个电子和7个质子;H是第1号元素,原子内有1个电子和1个质子;所以1个NH4+中有4×1+7-1=10个电子和4×1+7=11个质子。
所以0.1ml NH4+中有1ml电子,有1.1ml质子
我们已经学习了一个计算物质的量的公式
显然这个问题依然是无法解决的,因为这仍然是一个微观问题,因此必须要借用一个工具,将微观粒子数量这个微观问题宏观化,这个工具就是摩尔质量。
我们是不是就可以解决刚才的那个问题,一杯水中有多少水分子?
单位物质的量的物质所具有的质量,符号为M,单位为g/ml
已知金属Fe的摩尔质量为56g/ml,用天平称取56g Fe,其物质的量为1ml,大约含有6.02×1023个Fe原子
摩尔质量实际就是每1ml物质的质量,知道物质的摩尔质量,就可以通过物质的质量来得到物质的粒子数量。
28g Fe就是 ml,如果需要大约6.02×1022个Fe原子,应该称取 g的Fe。
利用摩尔质量将物质的粒子数量这一微观问题转化为物质质量这一宏观问题。
如何得到物质的摩尔质量呢?
当规定1ml代表的数量大约是6.02×1023时,1ml任何物质的质量(以克为单位)都与该物质粒子的相对原子质量或相对分子质量的数值相同。
Na的摩尔质量是 ,KCl的摩尔质量是 ,Cl2的摩尔质量是 ,CO32-的摩尔质量是 ,
相对原子质量或相对分子质量与摩尔质量的数值相等但单位不同
26.5gNa2CO3物质的量是多少?
【练习】(1)9.8g H2SO4的物质的量是 ml (2)5.3gNa2CO3的物质的量是 ml(3)0.25ml CaCO3的质量是 g (4)2.0ml H2O的质量是 g(5)0.02ml某物质的质量为0.73g,,则该物质的摩尔质量为 g/ml
完全中和10.2g某二元酸H2A需要氢氧化钠24g,则此二元酸H2A的物质的量是多少?A的相对原子质量是多少?
H2A + 2NaOH = Na2A + 2H2O
1个H2A和2个NaOH中和,所以1ml H2A和2ml NaOH中和
24g氢氧化钠的物质的量为0.6ml,所以中和的H2A的物质的量为0.3ml
H2A的物质的量为0.3ml,已知其质量为10.2g,所以其摩尔质量为34g/ml,因为摩尔质量和相对分子质量在数值上相等,所以H2A的分子量为34,进而得到A的相对原子质量为32
高中化学人教版 (2019)必修 第一册第三节 物质的量教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学课件ppt,共20页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 物质的量教学ppt课件: 这是一份人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共25页。PPT课件主要包含了新闻热点,课堂任务,类比迁移,国际七个基本单位,及时巩固,5NA,还需要哪个物理量,mol物质的质量,课堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量课文配套课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量课文配套课件ppt,共26页。PPT课件主要包含了7×1021,阿伏加德罗常数,练习1,练一练,02×1023,gmol,物质的量n,质量m,粒子数N,×NA等内容,欢迎下载使用。













