






高中化学鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第1节 化学反应的热效应课文内容ppt课件
展开1.常见的放热反应有哪些?
2.常见的吸热热反应有哪些?
①所有可燃物的燃烧反应,例如H2在Cl2中燃烧; ②酸碱中和反应;③金属与酸的反应; ④铝热反应; ⑤大部分化合反应,例如CaO+H2O====Ca(OH)2。
①铵盐与碱的反应;②C、H2、CO等还原金属氧化物的反应;③大部分分解反应。
通常情况下,化学反应中能量的转化主要是化学能与热能之间的转化。化学反应几乎都伴随着热能的释放或吸收,而且在一定条件下,一个反应释放或吸收的热量是一定的。那么,应如何定量地描述一个化学反应释放或吸收的热能呢?用什么方法可以准确地测量一个化学反应释放或吸收的热量?通过理论方法能够计算出化学反应释放或吸收的热量吗?
铝粉与铁的氧化物反应(放热)
氯化铵与氢氧化钙的反应(吸热)
如何定量地描述一个化学反应释放或吸收的热能呢?
定量地描述化学反应释放或吸收的热能
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热 。
Q>0 反应吸热
Q<0 反应放热
用什么方法可以获得一个化学反应的反应热呢?
1.反应热的数值可以通过实验测得。2.反应热的数值也可以通过理论计算求得。
热化学:用实验方法和理论方法研究反应热的化学分支。
用什么方法可以准确地测量一个化学反应释放或吸收的热量呢?
如果知道体系的热容,如何计算体系吸收或放出的热量?
热容和比热 在不发生化学反应和物质聚集状态变化的条件下,物质吸收热量,温度升高时,温度每升高1K所吸收的热量称为该物质的热容,用符号C表示。热容的单位是J·K-1。 纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热。比热的单位是KJ·K-1·kg-1 。常温下,液态水的比热为4.18KJ·K-1·kg-1。
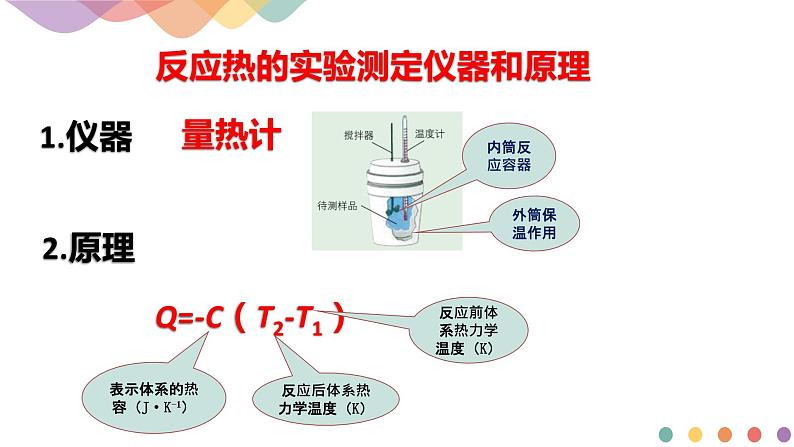
反应热的实验测定仪器和原理
Q=-C(T2-T1)
表示体系的热容(J·K-1)
反应前体系热力学温度(K)
反应后体系热力学温度(K)
1.向量热计内筒中加入1.0 ml·L-1的盐酸100 mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。
2.向250 mL的烧杯中加入1.0 ml·L-1 NaOH溶液100 mL,调节其温度与量热计中盐酸的温度相同。
3.快速将烧杯中的碱液倒入量热计中,盖好杯盖,匀速搅拌,记录体系达到的最高温度T2。
4.近似认为溶液的比热等于水的比热,根据溶液温度升高的数值计算此中和反应的反应热。
2.在实验室中有玻璃搅拌器和金属搅拌器,在进行测定反应热的实验时应选择哪种搅拌器?
1.根据实验原理分析,对实验结果造成影响的主要因素是什么?在第三步操作中快速将烧杯总的盐酸倒入量热计的目的是什么?
应选用玻璃搅拌器。因为金属是热的良导体而玻璃不是,选用金属搅拌器会增大反应过程中热量的散失,造成实验误差。
为什么三个反应的热效应相同?
2.所用溶液的体积相同,溶液中H+和OH-的浓度相同,即H+和OH-的量相同。
1.反应的实质相同:H+ + OHˉ== H2O
3.反应温度的变化值相同。
三个反应的热效应不完全相同,造成误差的原因是什么?
1.量取溶液的体积有误差2.温度计的读数有误。3.实验过程中有液体洒在外面。4.混合酸、碱溶液时,动作缓慢,导致实验误差。5.隔热操作不到位,致使实验过程中热量损失而导致误差。6.测了酸后的温度计未用水清洗便立即去测碱的温度,致使热量损失而引起误差。
在稀溶液中,强酸跟强碱发生中和反应生成1 ml液态水时所释放的热量叫做中和热。
有11.2 g KOH的稀溶液与1 L 0.1 ml·L-1的H2SO4溶液反应,放出11.46 kJ的热量,则该反应的中和热为 。
注意: 1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热. 2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ·ml-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·ml-1; 3.以生成1ml液态水为基准。 4. 反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4↓+2H2O)
化学反应能量变化的原因是什么?
1.化学反应的实质:旧化学键断裂和新化学键的形成
2.反应物和生成物所具有的能量不同
旧化学键断裂吸收能量>新化学键的形成释放能量 反应吸收能量旧化学键断裂吸收能量<新化学键的形成释放能量 反应释放能量
反应物总能量>生成物总能量 反应释放能量反应物总能量<生成物总能量 反应吸收能量
二、化学反应的内能变化与焓变
1.化学反应的内能变化
体系内所含各种微观粒子的能量总和
物质的种类、数量、聚集状态、温度、压强
△U=U(反应产物)-U(反应物)
物质内能与哪些因素有关?内能变化与能量变化什么关系?
内能变化与能量变化的关系
U(反应产物)>U(反应物) 反应吸收能量
U(反应产物)<U(反应物) 反应释放能量
内能变化与反应热是否相同?有什么关系?
体系与环境之间的能量交换 体系和环境之间能量的交换有两种形式:热和功。由于体系和环境的温度不同而在体系和环境之间交换的能量称为热,用符号Q表示;并且约定,体系吸热时Q取正值,体系放热时Q取负值。除热能外,体系与环境之间交换的其他形式的能(如电能、光能、机械能等)都称为功,用符号W表示;并且约定,环境对体系做功时W取正值,体系对环境做功时W取负值。 在一定的环境压强下,当体系的体积发生变化时,环境对体系(或体系对环境)做的功称为体积功。
内能变化与反应热的关系
化学反应体系与环境间能量交换的形式
因温度不同而传递的能量
符号:Q 单位:KJ或J
除热以外的其他能量形式
符号:W 单位:KJ或J
结论:根据能量守恒定律,化学反应中内能的变化等于反应热和功的加和。
若反应过程中体系没有做功,既W=0时,化学反应的反应热(Q)等于化学反应前后体系内能变化(△U)
U(反应产物)>U(反应物) 反应吸热 Q>0U(反应产物)<U(反应物) 反应放热 Q<0
Q>0 反应吸热
U(反应产物)>U(反应物)
U(反应产物)<U(反应物)
反应热的测定:量热计 Q=-C(T2-T1)
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文课件ppt,共48页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,保温作用,反应容器,-CT2-T1,聚集状态,反应热,Q+W等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应图片ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应图片ppt课件,共47页。PPT课件主要包含了任务分项突破,课堂小结提升,学科素养测评,自主梳理,互动探究,题组例练,答案②④⑥⑦,J·mol-1,kJ·mol-1,题点一ΔH图像问题等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文配套ppt课件: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文配套ppt课件,共60页。PPT课件主要包含了释放或吸收,反应前后,反应前和反应后,判一判,数量及聚集状态,热和功,反应热和功,反应热,等压反应的反应热,数量聚集状态等内容,欢迎下载使用。













