

人教版 (新课标)第二节 几种重要的金属化合物优秀教学设计及反思
展开《铁的重要化合物》教学设计
一、教材分析:
(一)本节在教材中的地位和作用:
本节课是新课改人教版化学必修1第三章第二节的第二课时,这一节识是金属的化学性质知识的延伸和发展。在自然界中金属元素基本上都以化合物的形式存在,只有几了解金属单质的性质,又了解它们化合物的性质才是比较全面的了解金属。
本节课主要介绍了帖的重要化合物,主要以它们的化学性质为主,对于物理性质没有详细描述。
本节课通过实验探究的方法,介绍了Fe(OH)2的制备与性质、Fe2+与Fe3+的检验、Fe2+与Fe3+相互转化等知识,有助于培养学生的实验观察与分析能力。
(二)教学目标分析:
1、识与技能目标
(1)了解铁的氧化物性质和用途。
(2)了解铁的氢氧化物的性质及制备方法。
(3)掌握Fe3+与Fe2+的检验方法及相互转化。
⒉ 过程与方法目标:
(1)体验实验学习的一般方法:将实验探究与讨论交流密切结合;
(2)学习运用比较、归纳、分析、综合的学习方法
⒊ 情感态度与价值观:
培养学生实事求是的科学品质和“主动参与、乐于探究、交流合作”的精神。
(三)教学重点、难点:
教学重点:Fe(OH)2的制备 、Fe2+和Fe3+的检验和相互转化
教学难点:Fe2+和Fe3+的相互转化
二、教法分析:
教学活动是教和学的双边活动,必须充分发挥学生的主体作用和教师的主导作用,使之相互促进,协调发展。本节课采用实验促学、情景激学、探究归纳、多媒体辅助等教学方法。
三、学情分析:
本节课是在学生学习了过钠和铝的重要化合物,初步具备了学习金属元素化合物的一些经验,并对氧化还原反应知识有一定的认知,这些都为本课时的学习奠定了基础。但对金属化合物的性质规律和学习方法大多数学生仍需加深认识,另外实验设计的能力和运用氧化还原反应规律进行学习的水平可能参差不齐。
四、教学准备:
1、多媒体电教设备;
2、化学实验用品:
(1)实验仪器:试管、试管架、胶头滴管。
(2)实验药品:FeSO4溶液、NaOH溶液、稀HCl、H2O2、FeCl3溶液、KSCN溶液、铁粉、蒸馏水等
五、教学思路:
问题引入→学生实验探究→学生汇报探究情况→学生得出结论→点评扩充。
六、教学方法:
问题引导、实验探究
七、教学过程:
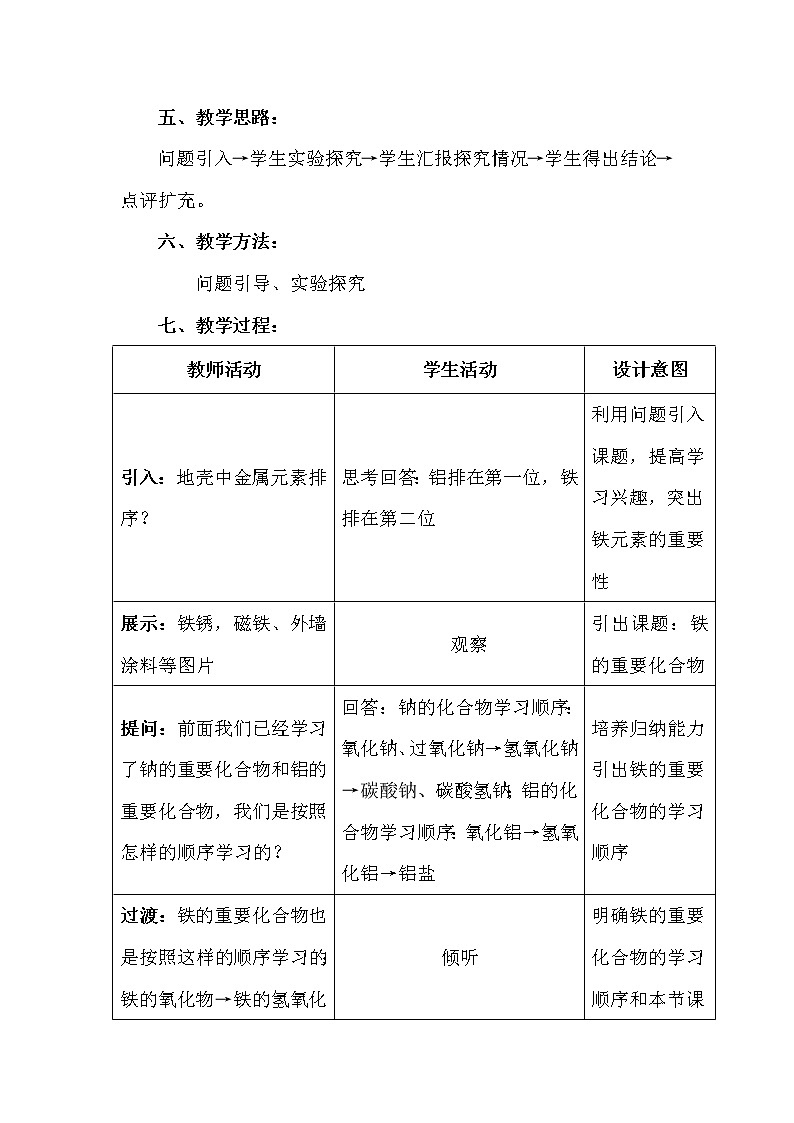
教师活动 | 学生活动 | 设计意图 | ||||||||||||||||||||||||||||
引入:地壳中金属元素排序? | 思考回答:铝排在第一位,铁排在第二位 | 利用问题引入课题,提高学习兴趣,突出铁元素的重要性 | ||||||||||||||||||||||||||||
展示:铁锈,磁铁、外墙涂料等图片 | 观察 | 引出课题:铁的重要化合物 | ||||||||||||||||||||||||||||
提问:前面我们已经学习了钠的重要化合物和铝的重要化合物,我们是按照怎样的顺序学习的? | 回答:钠的化合物学习顺序:氧化钠、过氧化钠→氢氧化钠→碳酸钠、碳酸氢钠;铝的化合物学习顺序:氧化铝→氢氧化铝→铝盐 | 培养归纳能力引出铁的重要化合物的学习顺序 | ||||||||||||||||||||||||||||
过渡:铁的重要化合物也是按照这样的顺序学习的:铁的氧化物→铁的氢氧化物→铁盐 | 倾听 | 明确铁的重要化合物的学习顺序和本节课的学习内容 | ||||||||||||||||||||||||||||
投影:学习目标 | 朗读学习目标 | 进一步明确本节课的学习任务 | ||||||||||||||||||||||||||||
板书: 铁的重要化合物
追问:铁的氧化物有哪些,有怎样的性质? 安排学生自学铁的氧化物,归纳铁的三种氧化物的性质。
板书:一、铁的氧化物 |
阅读课本P59铁的氧化物的内容并完成给出的表格:
|
培养学生自学能力和动手能力。使学生了解铁的三种氧化物的性质 | ||||||||||||||||||||||||||||
提问:铁的化合价有+2和+3价,铁的氢氧化物有哪些?如何制备? | 学生回答:有Fe(OH)2和Fe(OH)3,讨论铁的氢氧化物的制备原理:由相对应的可溶性盐和可溶性碱反应制取 | 培养学生的分析能力,明确铁的氢氧化物的制备原理 | ||||||||||||||||||||||||||||
板书:二、铁的氢氧化物 1、制备: Fe3++3OH-=Fe(OH)3↓红褐色 Fe2++2OH-=Fe(OH)2↓白色 | 分组实验,观察并描述实验现象:
| 培养学生动手能力以及小组合作能力。复习巩固离子方程式的书写。 | ||||||||||||||||||||||||||||
设疑:制备Fe(OH)2看不到白色为什么?应该怎样处理呢? | 讨论分析得出:Fe(OH)2中的Fe2+容易被空气中的O2氧化成Fe3+,应隔绝O2,即避免溶液与空气接触,除去反应试剂中的溶解氧。 可采取下列措施: 1、配置试剂的蒸馏水煮沸; 2、滴加植物油; 3、将滴管插入液面以下。 | 设置问题,引导学生探讨问题的兴趣,突破难点。 | ||||||||||||||||||||||||||||
提问:Fe(OH)2和Fe(OH)3有什么性质? | 讨论,归纳性质 | 培养学生交流和表达能力 | ||||||||||||||||||||||||||||
板书:2、性质: 颜色: Fe(OH)3红褐色;Fe(OH)2白色 溶解性:均不溶于水 与酸反应: Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O ④稳定性: 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
思考并记录 | 使学生加深对Fe(OH)2和Fe(OH)3的性质的理解 | ||||||||||||||||||||||||||||
过渡:前面我们学习了FeO、Fe(OH)2与酸反应可以生成亚铁盐,Fe2O3和Fe(OH)3与酸反应可以生成铁盐,下面我们学习铁盐和亚铁盐 | 倾听 | 与前面知识衔接,过渡到新知识的学习 | ||||||||||||||||||||||||||||
板书:三、铁盐和亚铁盐 提问:桌面上有FeSO4溶液和FeCl3溶液,我们用什么方法可以鉴别? |
回顾刚刚学习过的知识,讨论: 1、根据溶液的颜色。 2、分别取两者的溶液,加入NaOH溶液。 |
培养学生对比归纳知识的能力 | ||||||||||||||||||||||||||||
过渡:老师讲解一种灵敏的方法 | 分组实验,观察现象填写表格。
| 培养学生的实验技能 | ||||||||||||||||||||||||||||
板书:1、Fe2+和Fe3+的鉴别: ①观察法: Fe2+:浅绿色;Fe3+:棕黄色 ②加NaOH溶液法: Fe2+:产生白色沉淀; Fe3+:产生红褐色沉淀 ③KSCN溶液法: Fe2+:无明显变化; Fe3+:溶液呈血红色 | 思考理解并记录 | 掌握Fe2+和Fe3+的鉴别方法 | ||||||||||||||||||||||||||||
设问:如何判断溶液中有Fe2+? | 思考、讨论 | 创设问题情境,引起学习的兴趣 | ||||||||||||||||||||||||||||
实验:在FeSO4溶液中加入KSCN溶液后,再滴入H2O2溶液。 | 观察实验现象:溶液呈血红色 | 培养学生的观察能力 | ||||||||||||||||||||||||||||
提问:根据实验现象,说明了什么? | 思考后回答:溶液呈现血红色,说明存在Fe3+,是Fe2+被H2O2氧化产生的,说明Fe2+可以被转化为Fe3+。 | 培养学生分析问题,解决问题的能力 | ||||||||||||||||||||||||||||
设问:Fe3+能不能转化为Fe2+呢?请设计实验证明。 | 分组实验,观察实验现象: 实验:在FeCl3溶液时加入铁粉、震荡、静置 | 培养学生动手能力和观察能力 | ||||||||||||||||||||||||||||
提问:通过上面的实验我们得出了什么结论? | 思考后回答:Fe2+和Fe3+可以相互转化 |
| ||||||||||||||||||||||||||||
板书:2、Fe2+和Fe3+的相互转化
| 倾听、思考、做笔记 | 巩固Fe2+和Fe3+的相互转化关系 | ||||||||||||||||||||||||||||
应用 | 1、如何除去FeCl2溶液中混有的FeCl3? 2、如何除去FeCl3溶液中混有的FeCl2溶液? 3、实验室如何保存FeSO4溶液? | 通过练习,培养学生学以致用的能力,突破本节课的难点。 | ||||||||||||||||||||||||||||
布置课后思考与讨论 | 设计实验检验补铁试剂中铁元素的价态。 | 给学生空间和时间,充分挖掘学生的潜力。 | ||||||||||||||||||||||||||||
布置作业:P63页7、9、10 | ||||||||||||||||||||||||||||||
板书设计 第二节 几种重要的金属化合物 铁的重要化合物 一、铁的氧化物 二、铁的氢氧化物 1、制备: Fe3++3OH-=Fe(OH)3↓ 红褐色 Fe2++2OH-=Fe(OH)2↓ 白色 2、性质: 颜色:Fe(OH)3红褐色 Fe(OH)2白色 溶解性:均不溶于水 与酸反应:Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O ④稳定性:4Fe(OH)2+O2+2H2O=4Fe(OH)3 三、铁盐和亚铁盐 1、Fe2+和Fe3+的鉴别: ①观察法:Fe2+:浅绿色;Fe3+:棕黄色 ②加NaOH溶液法:Fe2+:白色沉淀;Fe3+:红褐色沉淀 ③KSCN溶液法:Fe2+:无明显变化;Fe3+:溶液呈血红色 2、Fe2+和Fe3+的相互转化:
| ||||||||||||||||||||||||||||||
人教版 (新课标)必修1第二节 几种重要的金属化合物获奖教学设计: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物获奖教学设计,共4页。
化学必修1第二节 几种重要的金属化合物优质教学设计: 这是一份化学必修1第二节 几种重要的金属化合物优质教学设计,共7页。
高中化学第二节 几种重要的金属化合物优秀教学设计: 这是一份高中化学第二节 几种重要的金属化合物优秀教学设计,共13页。













