

综合测评 课后习题【新教材】人教版(2019)高中化学选择性必修一
展开一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
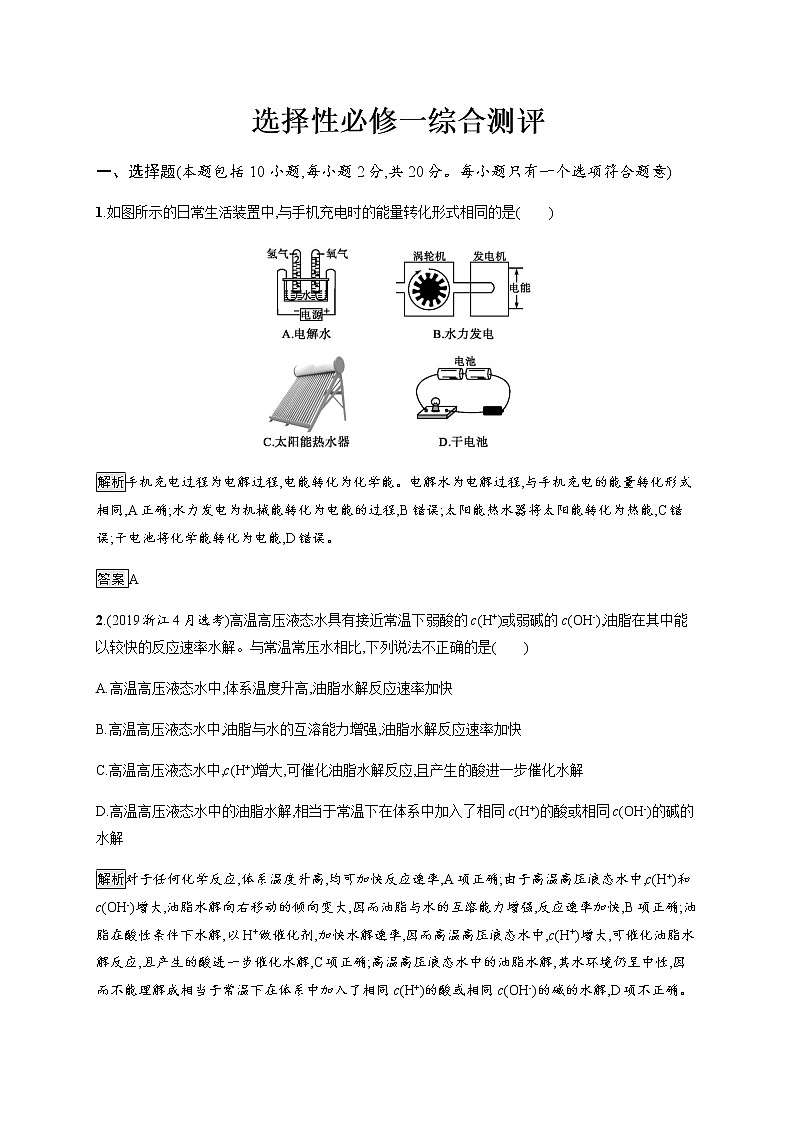
1.如图所示的日常生活装置中,与手机充电时的能量转化形式相同的是( )
解析手机充电过程为电解过程,电能转化为化学能。电解水为电解过程,与手机充电的能量转化形式相同,A正确;水力发电为机械能转化为电能的过程,B错误;太阳能热水器将太阳能转化为热能,C错误;干电池将化学能转化为电能,D错误。
答案A
2.(2019浙江4月选考)高温高压液态水具有接近常温下弱酸的c(H+)或弱碱的c(OH-),油脂在其中能以较快的反应速率水解。与常温常压水相比,下列说法不正确的是( )
A.高温高压液态水中,体系温度升高,油脂水解反应速率加快
B.高温高压液态水中,油脂与水的互溶能力增强,油脂水解反应速率加快
C.高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解
D.高温高压液态水中的油脂水解,相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH-)的碱的水解
解析对于任何化学反应,体系温度升高,均可加快反应速率,A项正确;由于高温高压液态水中,c(H+)和c(OH-)增大,油脂水解向右移动的倾向变大,因而油脂与水的互溶能力增强,反应速率加快,B项正确;油脂在酸性条件下水解,以H+做催化剂,加快水解速率,因而高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水解,C项正确;高温高压液态水中的油脂水解,其水环境仍呈中性,因而不能理解成相当于常温下在体系中加入了相同c(H+)的酸或相同c(OH-)的碱的水解,D项不正确。
答案D
3.下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.3 kJ· ml-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ· ml-1,则氢气的燃烧热为241.8 kJ· ml-1
C.已知2C(s)+2O2(g)2CO2(g) ΔH=a;2C(s)+O2(g)2CO(g) ΔH=b,则a>b
D.已知P(白磷,s)P(红磷,s) ΔH<0,则白磷比红磷稳定
解析醋酸是弱酸,其电离过程是吸热过程,故含40.0 g 即1 ml NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ,故A正确;氢气的燃烧热必须是生成液态水所放出的热量,液态水变为气态水是吸热的,故氢气的燃烧热大于241.8 kJ· ml-1,B错误;等量的焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,因两反应的ΔH<0,即a
答案A
4.(2019浙江温州“十五校联合体”期中)一定温度下,等体积、pH相等的盐酸和醋酸溶液,下列说法正确的是( )
A.两溶液中,所含溶质的分子数相等
B.与等体积等浓度NaHCO3溶液混合,开始产生CO2速率相等,后来盐酸快
C.等体积、pH相等的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多
D.用同浓度的NaOH溶液分别与两溶液恰好反应完全,根据消耗的NaOH溶液体积的多少可以判断醋酸是弱电解质
解析HCl是强电解质,溶液中不存在溶质的分子,A错误;与等体积等浓度NaHCO3溶液混合,开始产生CO2速率相等,随着反应的进行,未电离的醋酸继续电离出H+,反应速率快,B错误;等体积、pH相等的盐酸和醋酸溶液分别与足量的Zn完全反应,由于醋酸的浓度较大,则醋酸产生的H2多,C错误;同浓度的NaOH溶液分别与等体积、pH相等的盐酸和醋酸溶液恰好反应完全,由于醋酸是弱电解质,浓度大于盐酸,则醋酸消耗的NaOH溶液体积多,故D正确。
答案D
5.(2019湖南长沙中学月考)已知:反应mX(g)+nY(g)qZ(g) ΔH<0,m+n>q,在密闭容器中反应达到平衡时,下列说法不正确的是( )
A.恒容时通入稀有气体使压强增大,平衡不移动
B.增大压强,反应速率加快且可以提高Z的产率
C.恒压时,增加一定量Z(g),平移时,混合气体的平均相对分子质量变大
D.恒容时增加X的物质的量,Y的转化率增大
解析恒容时通入稀有气体,体系的压强增大,但反应物的浓度不变,则平衡不移动,A正确。由于m+n>q,增大压强,平衡正向移动,则Z的产率提高,B正确。恒压时,增加一定量Z(g),达到的新平衡与原平衡等效,各物质的浓度不变,则混合气体的平均相对分子质量不变,C错误。恒容时增大X(g)的物质的量,平衡正向移动,则Y的转化率增大,D正确。
答案C
6.H2与ICl的反应分①②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为ΔH=-218 kJ· ml-1
解析根据图像,反应①②中反应物的总能量大于生成物的总能量,均是放热反应,故A说法正确;反应①中H的化合价由0→+1,部分I的化合价降低,属于氧化还原反应,反应②中,I的化合价发生变化,属于氧化还原反应,故B说法正确;反应①比反应②慢,说明反应①中正反应的活化能较大,反应②中正反应的活化能较小,故C说法错误;根据盖斯定律知,反应的焓变只与始态和终态有关,与反应的途径无关,因此反应①、反应②的焓变之和ΔH=-218 kJ· ml-1,故D说法正确。
答案C
7.(2019黑龙江哈尔滨一模)观察如图装置,下列说法正确的是( )
A.a、b接电流表,该装置为原电池
B.a、b接直流电源,该装置为电解池
C.a、b接直流电源,铁可能不易被腐蚀
D.a、b接电流表或接直流电源,铁都可能是负极
解析A项,a、b接电流表,若液体c为非电解质溶液,不满足原电池的构成条件,不能形成原电池,错误;B项,a、b接直流电源,若液体c为非电解质溶液,溶液不导电,所以不能电解,即不是电解池,错误;C项,若该装置是电解池,Fe与负极相连作阴极时被保护,即铁可能不易被腐蚀,正确;D项,接直流电源时,该装置可能为电解池,没有正、负极,Fe作阴极或阳极,错误。
答案C
8.常温时,将V1 mL c1 ml·L-1的氨水滴加到V2 mL c2 ml·L-1的盐酸中,下列结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl-)
C.若混合溶液的pH=7,则溶液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1=c2
解析常温下氨水与盐酸恰好中和(即c1V1=c2V2)生成的氯化铵溶液为强酸弱碱盐溶液,常温下溶液呈酸性,pH<7,若混合溶液的pH=7,则说明氨水相对过量,即c1V1>c2V2,A正确;V1=V2,c1=c2,即c1V1=c2V2,两者恰好中和,溶液呈酸性,c(H+)>c(OH-),则另两离子c(NH4+)
答案A
9.加热N2O5依次发生的分解反应为
①N2O5(g)N2O3(g)+O2(g)
②N2O3(g)N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 ml N2O5,加热到t ℃,达到平衡状态后O2的物质的量为9 ml,N2O3的物质的量为3.4 ml。则t ℃时反应①的平衡常数为( )
A.8.5B.9.6C.10.2D.10.7
解析设分解的N2O3物质的量为x ml,反应过程中共生成N2O3(x+3.4)ml,在①反应中N2O5分解了(x+3.4)ml,同时生成O2(x+3.4)ml,在②反应中生成氧气x ml。则(x+3.4)+x=9,求得x=2.8,所以平衡后N2O5、N2O3、O2浓度依次为c(N2O5)=(8-2.8-3.4) ml÷2 L=0.9 ml·L-1,c(N2O3)=3.4 ml÷2 L=1.7 ml·L-1,c(O2)=9 ml÷2 L=4.5 ml·L-1,反应①的平衡常数K=1.7×。
答案A
10.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.石墨棒上发生的电极反应:4OH--4e-O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水的pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
解析该装置中石墨棒为阳极,电极反应式为4OH--4e-2H2O+O2↑,A项正确;B项,由于C室中Ni2+、H+不断减少,Cl-通过阴离子膜从C室移向B室,A室中OH-不断减少,Na+通过阳离子膜从A室移向B室,所以B室中NaCl溶液的物质的量浓度不断增大,错误;C项,由于H+的氧化性大于Ni2+(低浓度)的氧化性,所以为了提高Ni的产率,电解过程需要控制废水的pH,正确;D项,若去掉阳离子膜,Cl-在阳极放电生成Cl2,反应总方程式发生改变,正确。
答案B
二、选择题(本题包括5小题,每小题4分,共20分。每小题有一个或两个选项符合题意)
11.(2018海南卷)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
解析根据图示,活化一个氧分子放出0.29 eV的能量,A错误;图中相对能量为0.73 eV时对应的状态只是无水的过渡态,相对能量为0.75 eV时对应的状态才是无水的中间态,因此水可使氧分子活化反应的活化能降低0.18 eV,B错误;氧气中存在O—O键,活性氧中存在C—O键,由图示知C正确;由题给信息“活化氧可以快速氧化二氧化硫”,结合氧化二氧化硫的总反应可知D正确。
答案CD
12.已知:①H+(aq)+OH-(aq)H2O(l) ΔH1=-57.3 kJ· ml-1,②H2(g)+12O2(g)H2O(g) ΔH2=-241.8 kJ· ml-1,下列有关说法正确的是( )(提示:乙二酸为二元弱酸)
A.向含0.1 ml NaOH的溶液中加入一定体积的0.1 ml·L-1乙二酸,反应中的能量变化如图所示
B.H2SO4(aq)+Ba(OH)2(aq)BaSO4(s)+2H2O(l) ΔH=-114.6 kJ· ml-1
C.氢气的燃烧热为241.8 kJ· ml-1
D.若反应②中水为液态,则同样条件下的反应热ΔH<ΔH2
解析乙二酸二元是弱酸,向含0.1 ml NaOH的溶液中加入500 mL 0.1 ml·L-1乙二酸溶液反应放出的热量小于5.73 kJ,故A正确;H2SO4(aq)+Ba(OH)2(aq)BaSO4(s)+2H2O(l),由于有硫酸钡沉淀生成,反应放出的热量大于114.6 kJ,故B错误;氢气的燃烧热是生成液态水放出的热量,故C错误;若反应②中水改为液态,则同样条件下的反应热ΔH<ΔH2,故D正确。
答案AD
13.(2019海南六市联考)世界某著名学术刊物近期介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-Fe+xO2-
C.铁表面发生的反应为xH2O(g)+FeFeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 ml电子转移
解析a极空气中氧气得电子发生还原反应,为正极,氢气在b极失电子发生氧化反应,为负极。在原电池中,阴离子向负极移动,O2-由a极移向b极,A项错误;a极空气中氧气得电子发生还原反应,为正极,电极反应式为O2+4e-2O2-,B项错误;由新型中温全瓷铁—空气电池的装置图可知,铁表面发生的反应为xH2O(g)+FeFeOx+xH2,C项正确;22.4 L(标准状况)空气中氧气的物质的量约为0.2 ml,电路中约转移0.8 ml电子,D项错误。
答案C
14.某温度下,难溶物FeR的水溶液中存在平衡FeR(s)Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.可以通过升温实现由c点变到a点
B.d点可能有沉淀生成
C.a点对应的Ksp等于b点对应的Ksp
D.该温度下,Ksp=4.0×10-18
解析从图像可以看出,从c点到a点,c(R2-)不变,c(Fe2+)变小,而温度变化时,c(R2-)与c(Fe2+)同时变化,A错误;沉淀溶解平衡曲线上方表示过饱和溶液,可析出沉淀,曲线以下表示不饱和溶液,所以d点没有沉淀生成,B错误;温度不变,Ksp不变,C正确;由图知,该温度下,Ksp=2.0×10-18,D错误。
答案C
15.X、Y、Z为三种气体,把a ml X和b ml Y充入一密闭容器中,发生反应X(g)+2Y(g)2Z(g)。达到平衡时,若三者的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为( )
A.a+b5×100%B.2(a+b)5b×100%
C.2(a+b)5×100%D.a+b5b×100%
解析设参加反应的Y的物质的量为n ml,则
X(g) + 2Y(g) 2Z(g)
起始/mlab0
平衡/mla-n2b-nn
由于平衡时n(X)+n(Y)=n(Z),则有(a-n2)+(b-n)=n,解得n=2(a+b)5,所以Y的转化率为2(a+b)5b×100%=2(a+b)5b×100%。
答案B
三、非选择题(本题共5小题,共60分)
16.(12分)(2019湖北枣阳高中模拟)NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(1)常温时,0.1 ml·L-1NH4Al(SO4)2溶液的pH=3。
①溶液中的KW= (填数值),由水电离出的c(H+)= ml·L-1。
②溶液中c(NH4+)+c(NH3·H2O) (填“>”“=”或“<”)c(Al3+)+c[Al(OH)3];2c(SO42-)-c(NH4+)-3c(Al3+)= ml·L-1(填数值)。
(2)80 ℃时,0.1 ml·L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是 。
(3)常温时,向100 mL 0.1 ml·L-1NH4HSO4溶液中滴加0.1 ml·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
①图中a、b、c、d四点中水的电离程度最小的是 。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为 。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是 。
解析(1)①水的离子积常数与温度有关,与溶液的酸碱性无关,故常温时,水的离子积常数KW=1×10-14。NH4Al(SO4)2溶液的pH=3,该溶液中H+全部来源于水的电离,故由水电离出的c(H+)=1×10-3 ml·L-1。
②NH4Al(SO4)2溶液中,NH4+、Al3+均发生水解反应,据物料守恒可得c(NH4+)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3]。据电荷守恒可得2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),则有2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=1×10-3 ml·L-1-1×10-11 ml·L-1≈1×10-3 ml·L-1。
(2)NH4Al(SO4)2溶液中存在NH4+、Al3+的水解平衡,而盐类水解是吸热反应,温度升高,水解平衡正向移动,溶液中c(H+)增大,故溶液的pH减小。
(3)①NH4HSO4溶液中滴加0.1 ml·L-1NaOH溶液,先后发生反应的离子方程式为H++OH-H2O、NH4++OH-NH3·H2O,a点V(NaOH溶液)=100 mL,H+恰好完全中和,此时溶液所含溶质为(NH4)2SO4和Na2SO4,NH4+发生水解反应而促进水的电离;b、c两点溶液所含溶质均为(NH4)2SO4、Na2SO4和NH3·H2O,且c点时c(NH3·H2O)大于b点,但NH3·H2O的存在抑制水的电离,则c点水的电离程度小于b点;d点NH4HSO4与NaOH溶液恰好完全反应,所含溶质为Na2SO4和NH3·H2O,此时c(NH3·H2O)较大,抑制水的电离,则四点中水的电离程度大小关系为a>b>c>d,其中水的电离程度最小的是d点。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,H+与OH-发生反应,离子方程式为H++OH-H2O。
③NH4HSO4溶液中,由电荷守恒可得2c(SO42-)+c(OH-)=c(H+)+c(NH4+),由物料守恒可得c(SO42-)=c(NH4+)+c(NH3·H2O),则c(SO42-)>c(NH4+),即得c(H+)>c(SO42-)+c(OH-),故各离子浓度由大到小的排列顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-)。
答案(1)①1×10-14 1×10-3 ②= 1×10-3
(2)温度升高,NH4+、Al3+的水解平衡正向移动,溶液中c(H+)增大
(3)①d ②H++OH-H2O
③c(H+)>c(SO42-)>c(NH4+)>c(OH-)
17.(12分)知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
(1)图1中,电解一段时间后,气球b中的气体是 (填化学式),U形管 (填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的 极;该发生器中反应的总离子方程式为 。
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。下图是目前已开发出用电解法制取ClO2的新工艺。
①阳极产生ClO2的电极反应式: 。
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为 。
解析(1)图1中,根据电子流向知,左边电极是电解池阳极,右边电极是电解池阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近产生NaOH。
(2)要制取“84”消毒液,应创造氯气和氢氧化钠反应生成NaClO的环境,为了使反应更充分,则下面电极生成氯气,为阳极,上面电极生成氢气,为阴极,阴极附近有NaOH生成,则c为负极,d为正极。
(3)①依据题干信息,阳极Cl-被氧化为ClO2,根据电子守恒和电荷守恒,写出电极反应式。②电极上得到或失去一个电子,电解质溶液中必然有一个阳离子通过阳离子交换膜。
答案(1)H2 右
(2)负 Cl-+H2OClO-+H2↑
(3)①Cl--5e-+2H2OClO2↑+4H+
②0.01 ml
18.(12分)(2019北京卷,27节选)氢能源是最具有应用前景的能源之一,高纯氢的制备是目前的研究热点。
甲烷水蒸气催化重整是制高纯氢的方法之一。
反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是 。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)C(s)+2H2(g) ΔH3
……
ⅲ为积碳反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用 反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是 (选填字母序号)。
a.促进CH4转化
b.促进CO转化为CO2
c.减少积碳生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率 (填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因: 。
解析①由于初始反应的生成物为H2和CO2,且其物质的量之比为4∶1,由质量守恒定律可写出反应方程式为CH4+2H2O(g)4H2+CO2。
②反应ⅰ+反应ⅱ-反应ⅲ可得:C(s)+2H2O(g)CO2(g)+2H2(g),所以,利用ΔH1和ΔH2计算ΔH3时,还需要利用反应C(s)+2H2O(g)CO2(g)+2H2(g)或C(s)+CO2(g)2CO(g)的ΔH。
③增加H2O(g)的量,由ⅰ可知可提高CH4的转化率,由ⅱ可知能促使CO转化为CO2,由ⅲ可知降低积碳反应的发生。
④由图像可知,从t1时开始,H2体积分数显著降低,单位时间CaO消耗率曲线斜率减小,原因是CaO表面被生成的碳酸钙覆盖,失去吸收CO2的能力。
答案①CH4+2H2O(g)4H2+CO2
②C(s)+2H2O(g)CO2(g)+2H2(g)或C(s)+CO2(g)2CO(g)
③abc ④降低
CaO+CO2CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积
19.(12分)(2019全国Ⅱ卷,27节选)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g)(g)+H2(g) ΔH1=100.3 kJ·ml-1①
H2(g)+I2(g)2HI(g) ΔH2=-11.0 kJ·ml-1②
对于反应:(g)+I2(g)(g)+2HI(g) ③
ΔH3= kJ·ml-1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为 ,该反应的平衡常数Kp= Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 (填标号)。
A.通入惰性气体B.提高温度
C.增加环戊烯浓度D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 ml·L-1
解析(1)根据盖斯定律,将反应①和②叠加可得反应③,故ΔH3=ΔH1+ΔH2=100.3 kJ·ml-1+(-11.0 kJ·ml-1)=89.3 kJ·ml-1。
(2)温度、体积一定,压强与物质的量成正比,则起始状态碘和环戊烯的分压分别为5×104 Pa,设环戊烯的转化率为x,根据反应:
(g) + I2(g) (g) + 2HI
起始/Pa 5×1045×104 0 0
转化/Pa 5×104x5×104x5×104x 1×105x
平衡/Pa 5×104(1-x) 5×104(1-x)5×104x 1×105x
根据平衡时总压增加了20%,则5×104(1-x) Pa+5×104(1-x) Pa+5×104x Pa+1×105x Pa=1.2×105 Pa
解得x=0.4,即环戊烯的转化率为40%。平衡时各物质的分压为p(环戊烯)=3×104 Pa,p(I2)=3×104 Pa,p(环戊二烯)=2×104 Pa,p(HI)=4×104 Pa,则该反应的平衡常数Kp=(4×104Pa)2×2×104Pa(3×104Pa)2≈3.56×104 Pa。
通入惰性气体,不会引起各物质的浓度的变化,反应速率不变,平衡不移动,环戊烯的平衡转化率不变,A项不符合题意;由于该反应为吸热反应,故升高温度使平衡向右移动,环戊烯的平衡转化率增大,B项符合题意;增加一种物质的量,自身的转化率减少,而另一种反应物的转化率增大,增加环戊烯浓度,环戊烯的平衡转化率减小,增加碘浓度,环戊烯的平衡转化率增大,C项不符合题意,D项符合题意。
(3)根据曲线的变化趋势可知,T2温度下首先达到平衡,反应速率大,因此T2大于T1,A项错误;a点、c点对应的反应物的浓度、温度都不同,无法比较a、c两点的反应速率的大小,B项错误;a点的正反应速率大于b点的正反应速率,而b点还没有达到平衡,因此b点的正反应速率大于其逆反应速率,则a点的正反应速率大于b点的逆反应速率,C项正确;根据曲线可知,环戊二烯的初始浓度为1.5 ml·L-1,b点环戊二烯的浓度为0.6 ml·L-1,环戊二烯的浓度变化量为0.9 ml·L-1,因此b点二聚体的浓度为0.45 ml·L-1,D项正确。
答案(1)89.3 (2)40% 3.56×104 BD (3)CD
20.(12分)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)CH3OH(g)。
(1)图1是反应CO(g)+2H2(g)CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
图1
①该反应的焓变ΔH (填“>”“<”或“=”)0。
②T1和T2温度下的平衡常数大小关系是K1 (填“>”“<”或“=”)K2。在T1温度下,往体积为1 L的密闭容器中,充入1 ml CO和2 ml H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为 。
图2
③若容器容积不变,下列措施可提升CO转化率的是 (填字母)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 ml)与CO平衡转化率的关系,则曲线z对应的温度是 ℃,该温度下上述反应的化学平衡常数为 。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 。
图3
解析(1)①T2温度下先达到平衡,所以温度T2>T1,由T1→T2升高温度时CO的转化率降低,平衡向左移动,所以正反应为放热反应,ΔH<0。②K=c(CH3OH)c(CO)·c2(H2)=×(2-2×0.75)2=12。③升高温度,平衡向左移动;分离出CH3OH(g),平衡向右移动;使用催化剂,平衡不移动;充入He,反应混合物各物质浓度不变,平衡不移动,故选b。
(2)CO和H2合成甲醇反应的ΔH<0,n(H2)n(CO)相同时,升高温度,平衡向左移动,K减小,由图像可知曲线z表示的温度为270 ℃。a点:起始浓度c(CO)=1 ml·L-1,c(H2)=1.5 ml·L-1;平衡浓度c(CO)=0.5 ml·L-1,c(CH3OH)=0.5 ml·L-1,c(H2)=1.5 ml·L-1-1 ml·L-1=0.5 ml·L-1,所以270 ℃时K=c(CH3OH)c(CO)·c2(H2)=0.50.5×0.52=4。温度相同时K为定值,该反应ΔH<0,温度越高K值越小,所以K1=K2
答案(1)①< ②> 12 ③b
(2)270 4 K1=K2
高中人教版 (2019)第一章 化学反应的热效应本单元综合与测试精品同步测试题: 这是一份高中人教版 (2019)第一章 化学反应的热效应本单元综合与测试精品同步测试题,共14页。试卷主要包含了选择题,H2,非选择题等内容,欢迎下载使用。
化学选择性必修1第三章 水溶液中的离子反应与平衡本单元综合与测试优秀课时训练: 这是一份化学选择性必修1第三章 水溶液中的离子反应与平衡本单元综合与测试优秀课时训练,共14页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡本单元综合与测试精品同步练习题: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡本单元综合与测试精品同步练习题,共15页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。













