





化学必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量优质课件ppt
展开知识点一 物质的量的单位——摩尔
化学反应是原子、分子等粒子之间的反应,如何把微观的水分子的量和宏观的水的量联系起来,完成下列知识点我相信你就会知道:
七个基本物理量:长度(m)、时间(s)、质量(kg)、热力学温度(K)、电流(A)、发光强度(cd)、物质的量(ml)
(1)概念:表示含有一定数目粒子的__________的基本物理量。(2)符号及单位:符号为_____,单位为_____。
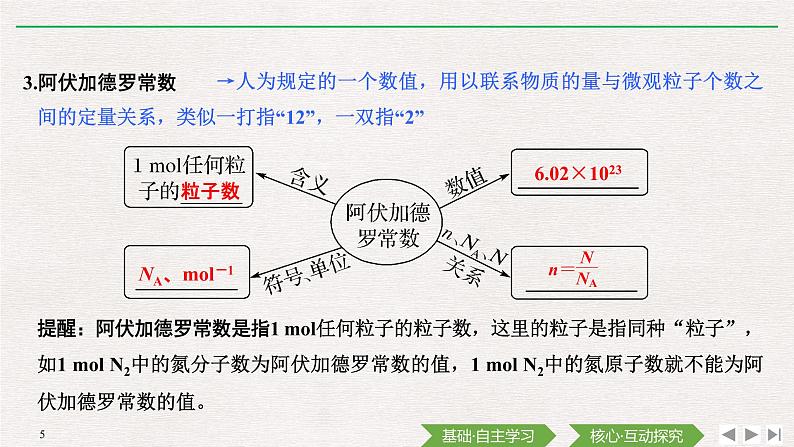
→人为规定的一个数值,用以联系物质的量与微观粒子个数之间的定量关系,类似一打指“12”,一双指“2”
提醒:阿伏加德罗常数是指1 ml任何粒子的粒子数,这里的粒子是指同种“粒子”,如1 ml N2中的氮分子数为阿伏加德罗常数的值,1 ml N2中的氮原子数就不能为阿伏加德罗常数的值。
我们在用铁单质做化学实验时,不可能一个一个的查铁原子从而确定它的物质的量,我们只能通过测量铁的质量来确定它的物质的量,那么如何把质量和物质的量联系在一起?
提醒:一种微粒的摩尔质量就是1 ml该微粒的质量,这种说法不正确,因为摩尔质量的单位是 g/ml,物质的质量单位是 g,二者的意义不同。
g·ml-1或g/ml
微判断(1)物质的量可以理解为物质的微观粒子数目。( )(2)摩尔是国际单位制中七个基本物理量之一。( )(3)1 ml氧气中约含有6.02×1023个原子。( )(4)1 ml任何粒子所含有的粒子数相等。( )(5)阿伏加德罗常数就是6.02×1023。( )(6)H2O的摩尔质量(以g·ml-1为单位)在数值上等于18。( )答案 (1)× (2)× (3)× (4)√ (5)× (6)√
微训练1.下列叙述错误的是( )
A.1 ml任何物质都含有约6.02×1023个原子B.1 ml C含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一答案 A
2.(1)9 g H2O的物质的量为________,含有的氢原子数为________。
(2)3.01×1023个H2SO4分子的物质的量为________,质量为__________。(3)0.5 ml H2SO4分子中N(H)________,N(O)________。(4)Fe的摩尔质量为56 g/ml,则1个Fe原子质量为________(列式)。
微思考1.引入物质的量的意义是什么?
提示 平时方程式所表示的为化学物质按个数比的反应,而实验室常用的量具为托盘天平 、量筒、滴定管等,如何把微观的微粒个数与宏观的质量、体积联系到一起,这就是物质的量,这个物理量的意义所在。
2.为什么摩尔质量在数值上与相对分子质量相同?
学习任务1 理解物质的量的基本概念
在日常生活和工作中我们经常用到一些小物品,比如曲别针。在商店里曲别针不是按个出售的,而是按盒出售的,一盒100个,而构成物质的原子、分子和离子非常微小,用数宏观物体的方式数微观粒子极其困难,也没有意义。因此科学家引入了“物质的量”这一基本物理量,来描述微观粒子集体数目的多少。
双、盒、打、箱针对宏观物质,物质的量(摩尔)只能针对具体的微观粒子
1.“物质的量”这一物理量表示的是微粒的质量还是微粒的数目?提示 “物质的量”是一个专有名词,描述的是一定数目微观粒子集合体数目的多少,可反映微粒的多少。2.“1 ml小米”、“1 ml氯”的说法正确吗?提示 错误。物质的量不能表示宏观物质。“1 ml氯”指代不明。3.阴、阳离子的摩尔质量在数值上也等于其相对原子质量吗?提示 错误。阴、阳离子摩尔质量以 g/ml为单位时,数值上等于其相对原子质量。
1.物质的量——“四化”
(1)专有化:物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。(2)微观化:物质的量的单位是摩尔,只能用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不适合表示宏观物质的数量。
例:1 ml苹果、1 ml铁元素等说法都是错误的。
(3)具体化:在使用物质的量表示物质时,必须具体指明粒子的种类。如1 ml H2表示1摩尔氢分子,1 ml H表示1摩尔氢原子,1 ml H+表示1摩尔氢离子。而1 ml氢的表述是错误的,因为“氢”是元素名称,是宏观物质名称,不是微观微粒名称。(4)集体化:微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可以是小数。例:5 ml H2O、0.5 ml H2O。
2.摩尔质量——“三性”
(1)等同性:摩尔质量只是在数值上与相对分子质量或相对原子质量相等,其含义和单位是不同的。(2)确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。(3)近似性:由于电子的质量非常微小,所以粒子的摩尔质量以 g·ml-1为单位时,其数值近似等于该粒子的相对分子质量或相对原子质量。
【例题1】 下列叙述中正确的是( )
A.物质的量是国际单位制中七个基本物理量之一B.1 ml氢C.1 ml粒子集体所含的粒子数就是6.02×1023个碳原子D.摩尔是物质的量的单位,也是粒子数量的单位
物质的量与粒子个数之间的关系是什么?
解析 物质的量是国际单位制中七个基本物理量之一,其单位是摩尔,A正确,D错误;使用摩尔时必须指明具体的粒子,1 ml氢的说法指代不明确,B错误;1 ml粒子集体所含的粒子数与0.012 kg12C含有的碳原子数相同,约是6.02×1023,C错误。答案 A
变式训练1 下列说法正确的是( )
A.1 ml氢约含有6.02×1023个微粒B.H2的摩尔质量是2 gC.1 ml O2的质量是32 g,含有的氧原子数为2NAD.2NA个H2SO4的摩尔质量为196 g·ml-1解析 A项未指出1 ml氢具体是什么微粒,无法确定其个数,如1 ml H2含1 ml氢气分子,含2 ml氢原子;B项摩尔质量的单位为 g·ml-1;D项2NA个H2SO4的质量为196 g,但其摩尔质量仍然为98 g·ml-1。答案 C
学习任务2 摩尔质量的含义
古时候有一个勇敢的小伙子想娶国王女儿——美丽的公主,国王出题刁难,其中的一个问题是:10 kg小米是多少粒?小伙子很快就想到了解决这个问题的办法,顺利地娶到了公主。提示 先称出5 g小米,看一下有多少粒,就知道10 kg小米有多少粒。
1.已知某物质的质量如何求其粒子数?
2.一种微粒的摩尔质量就是1 ml该微粒的质量,这种说法对吗?
提示 不对;摩尔质量的单位是 g/ml,质量的单位是 g,两者的意义不同。
×1022个H2O分子的物质的量是多少?
(1)M=m/n,该公式表示的是单位物质的量的物质所具有的质量,物质确定,其摩尔质量就确定。
不能认为摩尔质量与质量成正比,与其物质的量成反比。
(2)M=m(一个粒子)·NA,即阿伏加德罗常数个粒子的质量。(3)Mr=m(一个原子)÷1/12m(12C),摩尔质量在数值上等于其相对原子质量,即一个原子的实际质量与一个12C原子质量的1/12的比值。
【例题2】 准确理解概念内涵才能准确把握概念本质。下列有关1 ml 的含义叙述中错误的是( )
A.1 ml任何物质都含有6.02×1023个分子B.16 g O2约含有6.02×1023个氧原子C.4 ml水中含有8 ml H和4 ml OD.1 ml Ne中含有6.02×1024个电子
解析 有的物质是由分子构成的,如CO2、O2等,而有的物质不含分子,如金属单质、NaCl等,A错误;16 g O2的物质的量为0.5 ml,所含氧原子数约为0.5 ml×6.02×1023ml-1×2=6.02×1023,B正确;由水的组成可知C正确;1个Ne中含10个电子,故1 ml Ne中含6.02×1024个电子,D正确。答案 A
变式训练2 等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的O数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的C数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11 注意:n(CO)=n(CO2)A.①②③④B.②③C.④⑤D.①②③④⑤
学习任务3 (核心素养)探究物质的量、物质的质量、微粒数目之间的计算关系
一、知识要点1.物质的量、阿伏加德罗常数、物质的质量及粒子数之间的相关计算
【素养解题】[典例示范] 下列有关阿伏加德罗常数(NA)的说法错误的是( )
A.44 g CO2所含的原子数为NAB.0.5 ml H2O含有的原子数目为1.5NAC.1 ml H2O含有的H2O分子数目为个O2的物质的量是0.5 ml
[有关NA的计算解题思维模型]
三、对点训练1.下列叙述中正确的是( )
A.摩尔是表示物质所含微粒数量以及物质质量的具有双重意义的单位B.摩尔是国际单位制中7个基本物理量之一C.含有6.02×1023个氧原子的H3PO4的物质的量是0.25 mlD.2H既可以表示2个氢原子又可以表示2 ml氢原子
解析 物质的量是国际单位制中七个基本物理量之一,它表示含有一定数目粒子的集合体,其单位是摩尔,A、B项错误;1个H3PO4分子中含有4个O,即1 ml H3PO4中含有4 ml O,含有6.02×1023个氧原子的H3PO4的物质的量是0.25 ml,C项正确;2H可以表示2个氢原子,但不能表示2 ml氢原子,2 ml氢原子应表示为2 ml H。答案 C
2.下列关于摩尔质量的说法中正确的是( )
A.氢氧化钠的摩尔质量为40 gB.1摩尔氧原子的质量就是氧的相对原子质量C.H2SO4的摩尔质量为96 g·ml-1D.1 ml CO2的质量以克为单位时,在数值上等于CO2的相对分子质量解析 摩尔质量的单位是 g·ml-1,1 ml任何物质的质量以克为单位时,在数值上等于其相对分子或相对原子质量,A、B错误,D正确;H2SO4的摩尔质量为98 g·ml-1,C错误。答案 D
3.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 ml H2SO4C.54 g AlD.1 g CaCO3解析 A、B、C、D中四种物质的摩尔质量分别为18 g·ml-1、98 g·ml-1、27 g·ml-1、100 g·ml-1,摩尔质量最大的是D项。答案 D
4.0.5 ml O2中含有( )
A.1个氧原子B.1 ml氧分子C.NA个氧原子D.0.5个氧分子解析 0.5 ml O2中含有0.5 ml氧分子,氧分子数为3.01×1023(0.5NA),含有的氧原子数为6.02×1023(NA)。答案 C
5.在①、②、③、④处的横线上填上适当的内容。
解析 1 ml CO(NH2)2含有4 ml H、1 ml O,故2 ml CO(NH2)2含有8 ml H、2 ml O;分子数N=n×NA=2NA=2×6.02×1023=1.204×1024;CO(NH2)2的相对分子质量为60,故其质量m=n×M=2 ml×60 g·ml-1=120 g。答案 ①2NA或1.204×1024 ②120 g ③2 ④8
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课文配套ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课文配套ppt课件,共40页。PPT课件主要包含了大显身手,宏观物质,只鸡蛋,瓶矿泉水,枚曲别针,两只袜子,学习任务一物质的量,≈10万年,随堂巩固,世界摩尔日1023等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量完美版ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量完美版ppt课件,共25页。PPT课件主要包含了大约53000年,万4千年,×NA,÷NA等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量课文配套课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量课文配套课件ppt,共26页。PPT课件主要包含了7×1021,阿伏加德罗常数,练习1,练一练,02×1023,gmol,物质的量n,质量m,粒子数N,×NA等内容,欢迎下载使用。













