


重难点11化学反应速率与平衡分析-2025年高考化学 热点 重点 难点 专练(上海专用)
展开
这是一份重难点11化学反应速率与平衡分析-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点11化学反应速率与平衡分析-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点11化学反应速率与平衡分析-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
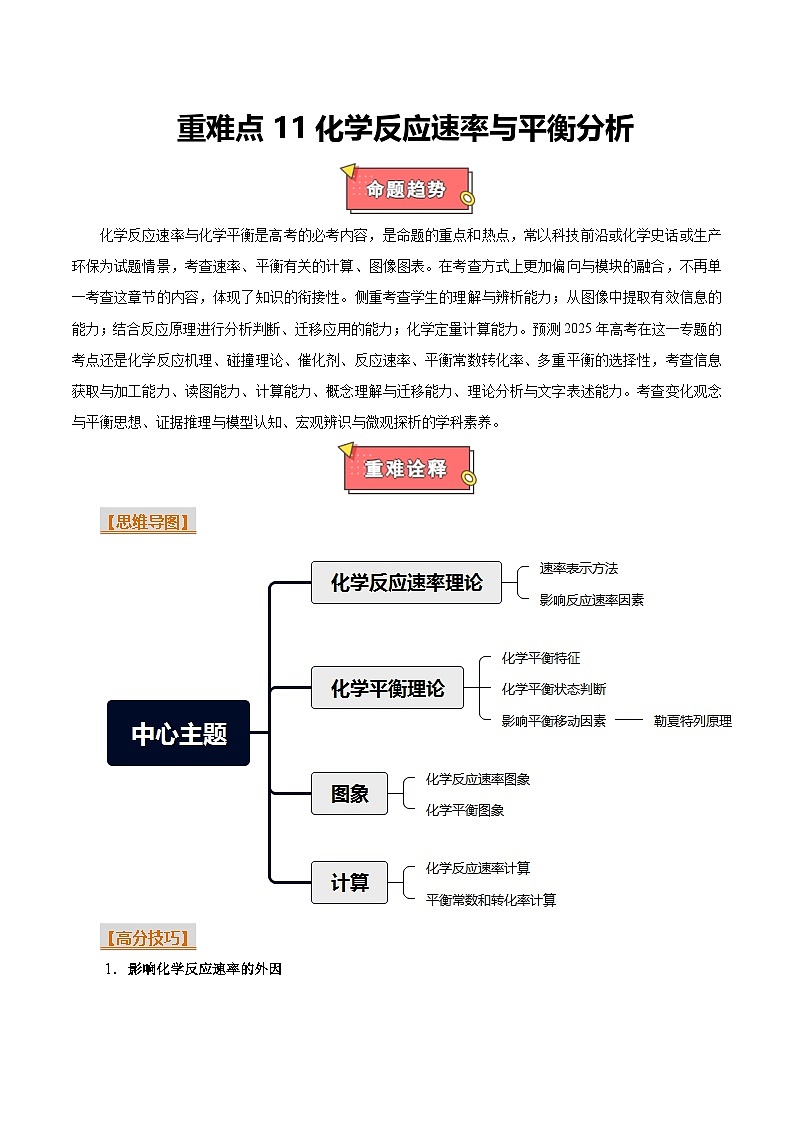
化学反应速率与化学平衡是高考的必考内容,是命题的重点和热点,常以科技前沿或化学史话或生产环保为试题情景,考查速率、平衡有关的计算、图像图表。在考查方式上更加偏向与模块的融合,不再单一考查这章节的内容,体现了知识的衔接性。侧重考查学生的理解与辨析能力;从图像中提取有效信息的能力;结合反应原理进行分析判断、迁移应用的能力;化学定量计算能力。预测2025年高考在这一专题的考点还是化学反应机理、碰撞理论、催化剂、反应速率、平衡常数转化率、多重平衡的选择性,考查信息获取与加工能力、读图能力、计算能力、概念理解与迁移能力、理论分析与文字表述能力。考查变化观念与平衡思想、证据推理与模型认知、宏观辨识与微观探析的学科素养。
【思维导图】
【高分技巧】
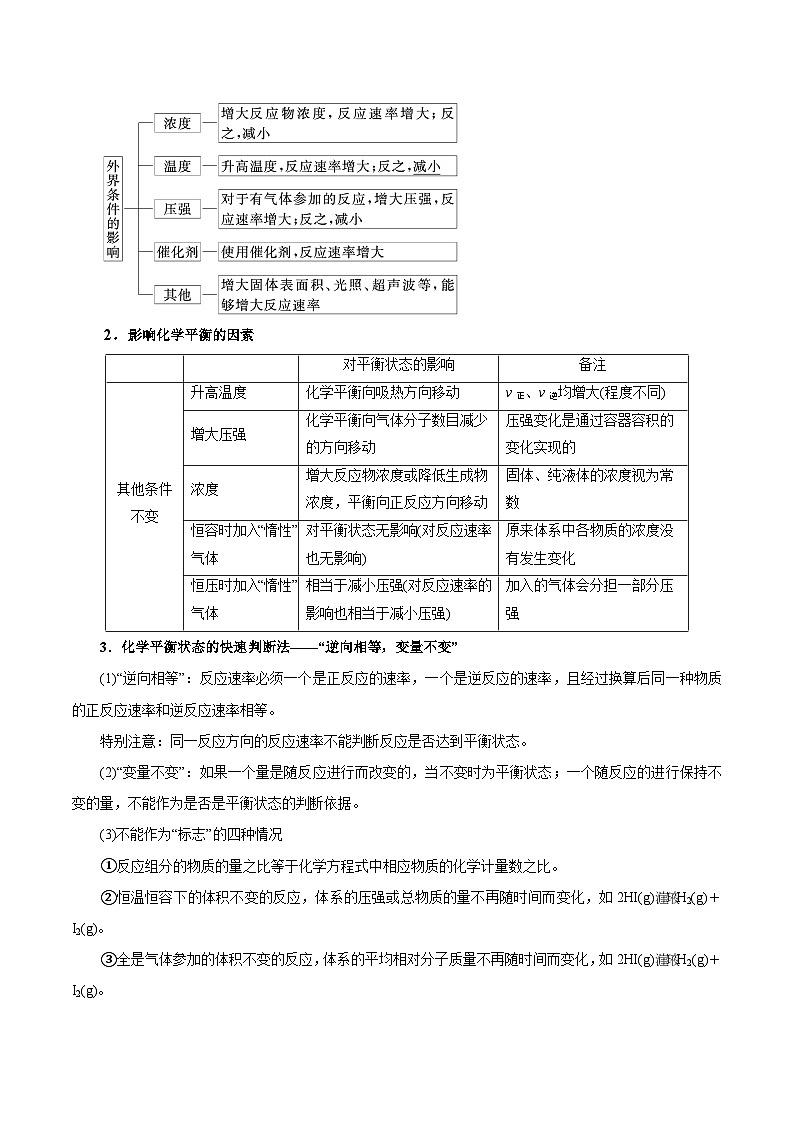
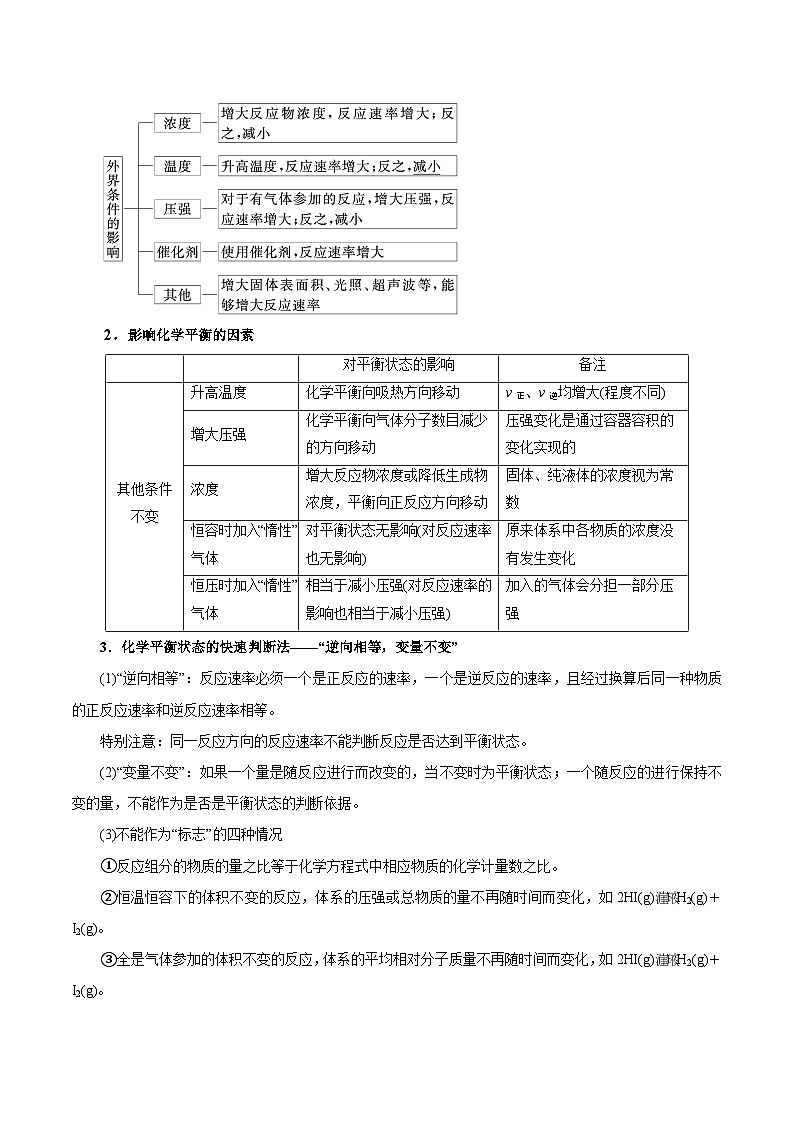
1.影响化学反应速率的外因
2.影响化学平衡的因素
3.化学平衡状态的快速判断法——“逆向相等,变量不变”
(1)“逆向相等”:反应速率必须一个是正反应的速率,一个是逆反应的速率,且经过换算后同一种物质的正反应速率和逆反应速率相等。
特别注意:同一反应方向的反应速率不能判断反应是否达到平衡状态。
(2)“变量不变”:如果一个量是随反应进行而改变的,当不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否是平衡状态的判断依据。
(3)不能作为“标志”的四种情况
①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下的体积不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g)H2(g)+I2(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g)H2(g)+I2(g)。
④全是气体参加的反应,恒容条件下体系的密度保持不变。
4.化学反应速率常数拓展
(1)概念:对于一个基元反应:αA+βD===γG+hH
其化学反应速率常数数学表达式为:v=kcα(A)cβ(D)
上式中的k称为反应速率常数又称速率常数。
(2)k的物理意义:在一定的条件下(温度、催化剂),反应物浓度为1 ml·L-1时的反应速率。k与反应物浓度无关。
= 1 \* GB3 ①反应不同,k值不同。
= 2 \* GB3 ②同一反应,温度不同k值不同。
= 3 \* GB3 ③同一反应,温度一定时,有无催化剂k也是不同的。
= 4 \* GB3 ④不同反应有不同的速率常数,速率常数与反应温度、反应介质(溶剂)、催化剂等有关,甚至会随反应器的形状、性质而异。与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
3.速率常数与平衡常数的关系
= 1 \* GB3 ①两者的关系:对于基元反应aA(g)+bB(g)cC(g)+dD(g),v正=k正·ca(A)·cb(B),
v逆=k逆·cc(C)·cd(D),平衡常数K= eq \f(cc(C)·cd(D),ca(A)·cb(B)) = eq \f(k正·v逆,k逆·v正) ,反应达到平衡时
v正=v逆,故K= eq \f(k正,k逆) 。
= 2 \* GB3 ②两者的区别:①反应速率常数通过量化化学反应速率,来表示反应的快慢;其影响因素包括温度和反应物性质等。②平衡常数属于平衡程度的标志,表示反应进行的最大限度;平衡常数只受温度的影响,而与反应物的浓度无关。
5.速率与平衡计算模式——“三段式”
(1)步骤:书写(写出有关化学平衡的化学反应方程式)→列变量(列出各物质的起始、变化、平衡量)→计算(根据已知条件列方程式计算)。
(2)模式:如反应:mA(g)+nB(g)pC(g)+qD(g),令A、B起始物质的量(ml)分别为a、b,达到平衡后,A的消耗量为mx,容器容积为1 L。
mA(g)+ nB(g) pC(g)+ qD(g)
起始/ml a b 0 0
变化/ml mx nx px qx
平衡/ml a-mx b-nx px qx
①求平衡常数:K= eq \f((px)p·(qx)q,(a-mx)m·(b-nx)n)
②求转化率
转化率= eq \f(某参加反应的物质转化的量,某参加反应的物质起始的量) ×100%,如α(A)平= eq \f(mx,a) ×100%。
(建议用时:25分钟)
1.(2025·上海市奉贤中学年高三期中)硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,合成原理为SO2(g)+Cl2 (g) SO2Cl2 (g) △H<0。
(1)下列关于该反应自发性的判断正确的是_______。
A.高温自发B.低温自发C.任何温度都自发D.任何温度都不自发
(2)保持一定温度,向体积为1.5L的恒容密闭容器中充入1.5ml SO2和1ml Cl2。
①下列说法能说明该反应达到平衡的是 。
A.SO2Cl2的体积分数不再变化
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.v(SO2)=v(SO2Cl2)
②测得体系初始压强P0=72 MPa,达到平衡时体系压强减小了14.4MPa。计算该温度下的平衡常数K= 。(写出计算过程)
③其他条件不变时,将起始投料改为3ml2和2ml Cl2,达到新平衡时,SO2的转化率将 。
A.增大 B.不变 C.减小
2.(2025·上海市奉贤中学高三上学期期中)1874年,Deacn提出可利用以下反应实现HCl向Cl2的转化: 。
(1)下列措施中既能提高HCl的平衡转化率,又能缩短反应时间的是_______。
A.升高温度B.缩小体积以增大压强
C.改变催化剂种类D.液化H2O (g)
(2)工业上使用CuO催化上述反应,已知催化过程分为两步,其中第一步反应为
CuO+2HCl= CuCl2+H2O,则第二步反应方程式为 。
3.(2025·上海市七宝中学高三期中考试)NH3是一种重要的工业原料在工农业生产、生活中有着重要作用。以铁为主的催化剂在400~500℃和20~50MPa的条件下,由N2和H2合成氨。回答下列问题:
(1)下列有关合成氨工业的说法中,正确的是___________
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.依据勒夏特列原理,加热是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20~50MPa,因为该压强下铁触媒的活性最大
(2)该反应放热,但仍选择较高温度400~500℃,其原因是___________。
A.适当提高NH3的合成速率B.适当提高H2的转化率
C.提高NH3的产率D.催化剂在500℃左右活性最大
(3)某温度下,在一容积可变的容器中,反应N2(g)+3H2(g)2NH3(g)达到平衡时,N2、H2和NH3物质的量分别为4ml、2ml和4ml。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是___________。
A.均增加1mlB.均减半C.均减少1mlD.均加倍
4.(2025·上海市三林中学高三期中考试)在4 L恒容密闭容器中投入2 ml N2和5 ml H2发生合成氨反应:N2(g) + 3H2(g) 2NH3(g) (ΔH<0)
(1)该反应平衡常数的表达式K= 。若在某条件下合成氨反应2 min后达到平衡,H2变为0.8 ml·L−1,则这2 min内的化学反应速率为v(NH3)= 。
(2)下列能说明合成氨反应达到化学平衡的是___________。
A.气体密度不变
B.每断裂3根H-H键,同时断裂1根氮氮叁键
C.气体总压强不变
D.N2和NH3的分子数为1:2
(3)如图为合成氨反应速率(ν)与时间(t)关系的示意图,由图判断,在t2时刻曲线发生变化的原因可能是 。
(4)若恒容通入He气使容器内压强增大,则合成氨的化学反应速率 (填:增大、减小、不变,不确定)。
5.(2025·上海市曹杨第二中学年高三上期中考试)镁具有储氢作用:523K,常压下镁和氢气作用生成MgH2,在低压或稍高温下又能释放氢。
Ⅰ. MgH2热分解放出H2:MgH2(s)Mg(s)+H2(g) ΔH=+75kJ·ml−1。
(1)该反应的能量变化如图,反应的活化能为 。
(2)提高H2平衡产率的措施有: 、 (任写两条)。
Ⅱ. MgH2水解制备H2:
(3) MgH2与H2O反应制备H2的化学方程式 。
(4) MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因可能是: 。
6.(2025·上海复旦大学附属中学高三化学期中等级性考试)CO2的资源化利用是实现“碳中和、碳达峰”的途径。CO2合成甲醇的过程中涉及如下反应:
反应i.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.4kJ·ml−1 ;
反应ii.CO2(g)+H2(g)CO(g)+H2O(g) ΔH1=+41.2kJ·ml−1。
T℃时,向2L恒容、密闭容器中充入1ml CO2和4mlH2发生上述反应。10min末已达到平衡时测得容器中CO2的转化率为90%,CO的物质的量为0.3ml。
(1)0~10min内,平均反应速率v(CH3OH)= ml·L-1·min-1 。
(2)T℃时,反应ⅱ的化学平衡常数K= 。(保留2位小数)
(3)近日,我国学者研究发现,在单原子Cu/ZrO2催化时,反应ⅰ的历程以及中间体与物质的量之比随时间变化图如下:
第一步
第二步
第三步
下列说法正确的是___________。
A.任何温度下,反应ⅰ可自发进行
B.用不同催化剂催化反应可以改变反应历程,提高平衡转化率
C.反应历程中,第二步反应的活化能最高,是反应的决速步骤
D.其他条件相同时,升高温度时,三步反应速率均加快
7.(2025·上海复旦大学附属中学高三化学期中等级性考试)脱除汽车尾气中NO和CO包括以下两个反应:
反应ⅰ. 2NO+CON2O+CO2;
反应ⅱ. N2O+CON2+CO2。
将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图。
(1)实验过程中,高于340℃后N2O浓度逐渐减小,试分析发生该变化的原因是 。
(2)450℃时,该时间段内NO的脱除率= (保留2位有效数字,NO的脱除率)。
8.(2025·上海交通大学附属中学高三期中考试)向容积为2L密闭容器中加入足量活性炭和NO,发生反应C(s)+2NO(g)CO2(g)+N2(g),NO和N2的物质的量变化如下表所示。
(1)内,以CO2表示的该反应速v(CO2) ,最终达平衡的NO转化率= 。
(2)该反应的平衡常数表达式: , ℃下的平衡常数 。
(3)保持温度℃不变,向该2L密闭容器中加入该四种反应混合物各2ml,该时刻,正、逆反应速率的大小关系为:v正 (NO) v逆 (NO) (填“>”“”或“”、“”、“
相关试卷
这是一份重难点16 化学实验综合题-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点16化学实验综合题-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点16化学实验综合题-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
这是一份重难点13 化学工艺流程-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点13化学工艺流程-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点13化学工艺流程-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
这是一份重难点12 电解质溶液图像分析-2025年高考化学 热点 重点 难点 专练(上海专用),文件包含重难点12电解质溶液图像分析-2025年高考化学热点重点难点专练上海专用原卷版docx、重难点12电解质溶液图像分析-2025年高考化学热点重点难点专练上海专用解析版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。








