所属成套资源:2025年高考化学 热点 重点 难点 专练(广东专用)
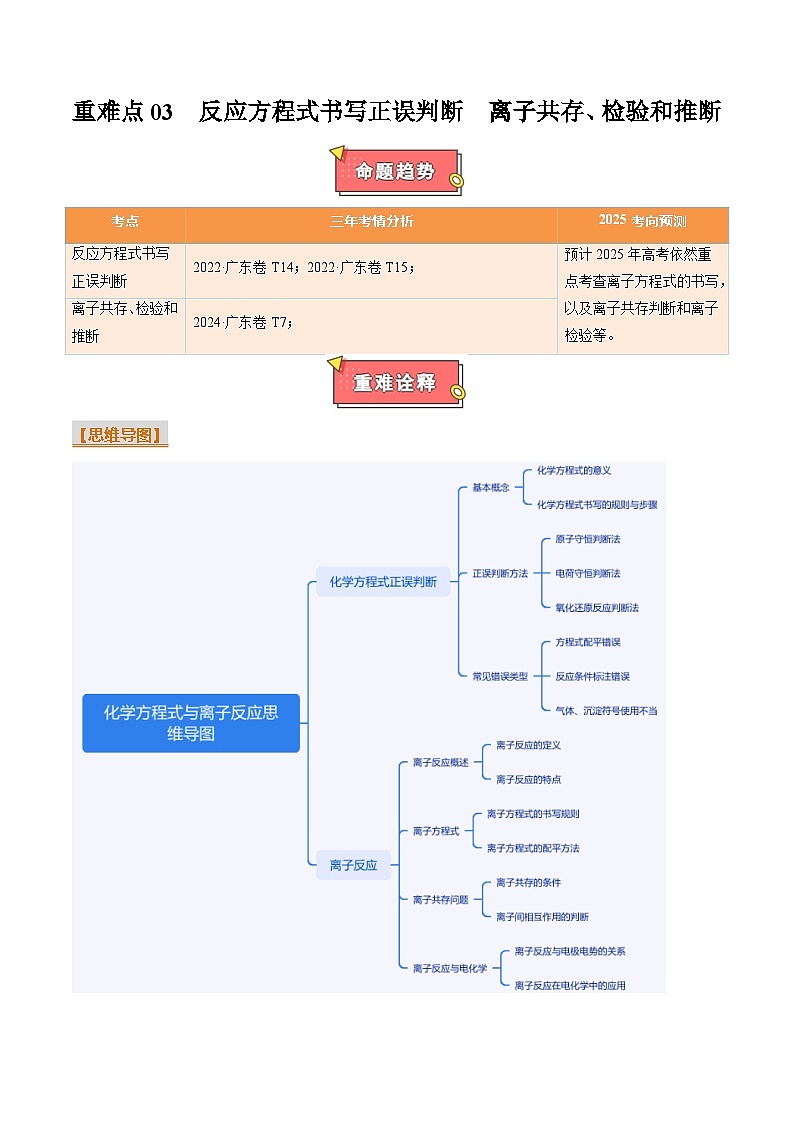
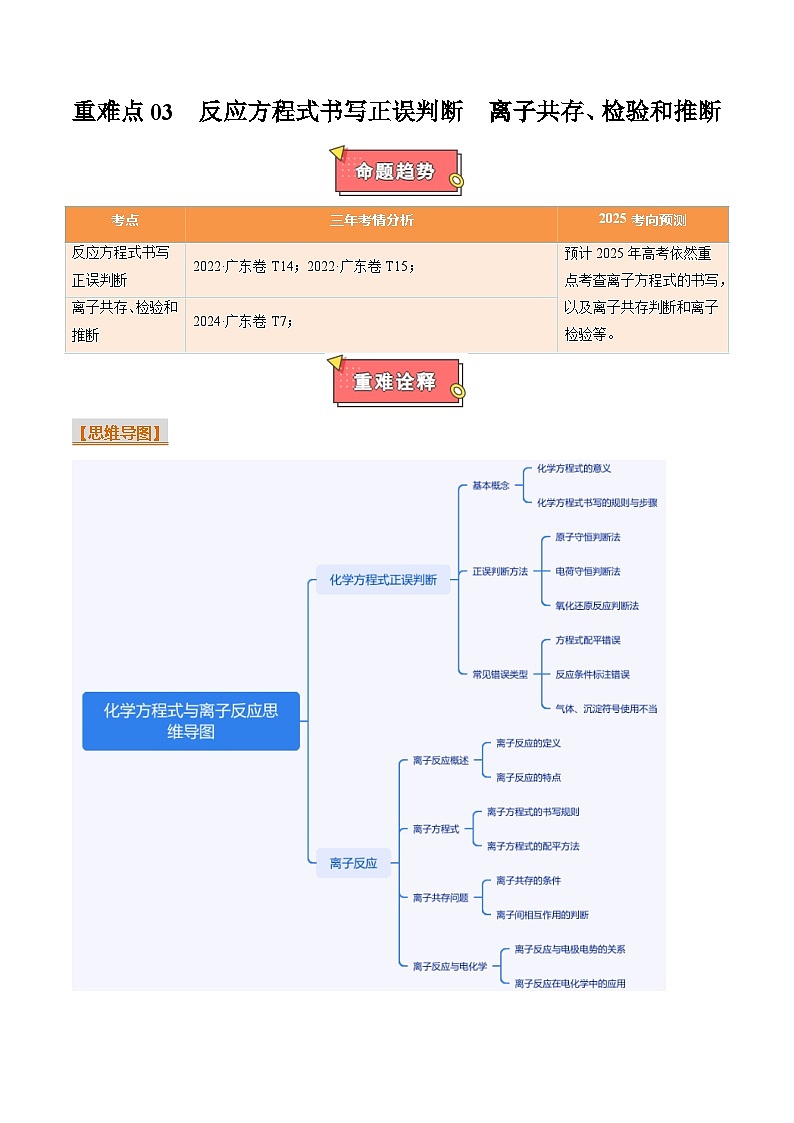
重难点03 反应方程式书写正误判断 离子共存、检验和推断-2025年高考化学 热点 重点 难点 专练(广东专用)
展开
这是一份重难点03 反应方程式书写正误判断 离子共存、检验和推断-2025年高考化学 热点 重点 难点 专练(广东专用),文件包含重难点03反应方程式书写正误判断离子共存检验和推断-2025年高考化学热点重点难点专练广东专用原卷版docx、重难点03反应方程式书写正误判断离子共存检验和推断-2025年高考化学热点重点难点专练广东专用解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
【思维导图】
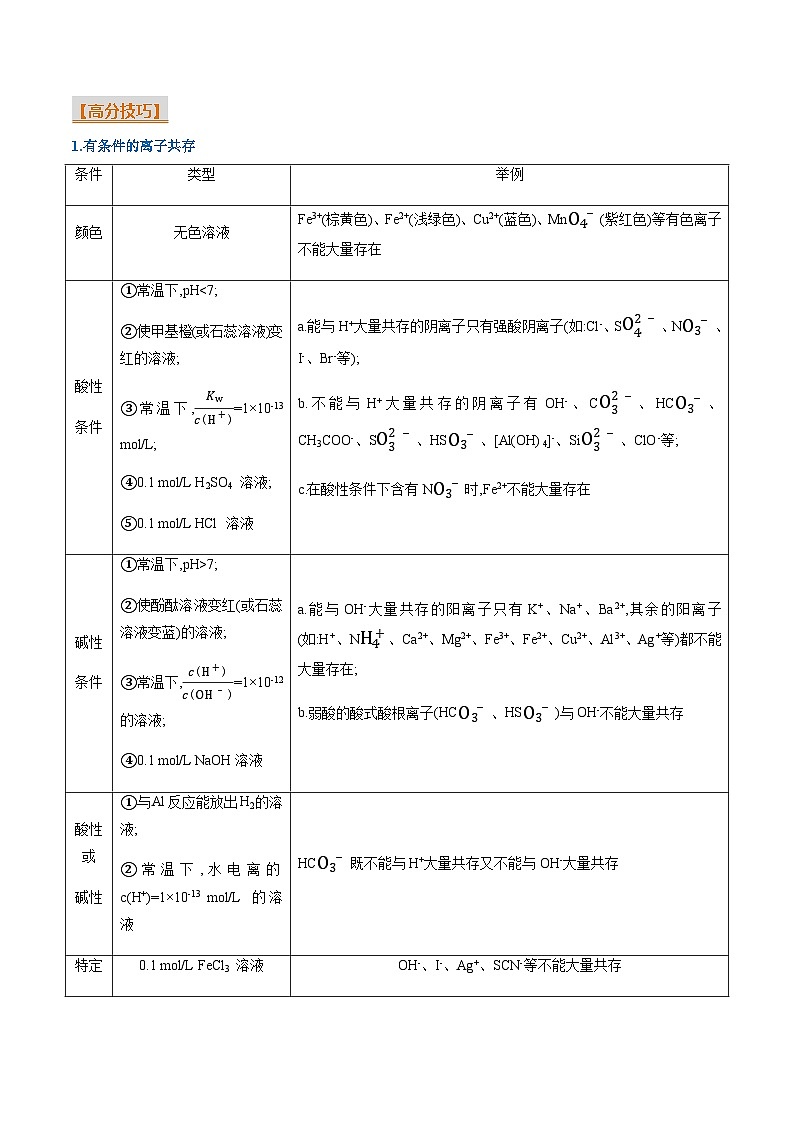
【高分技巧】
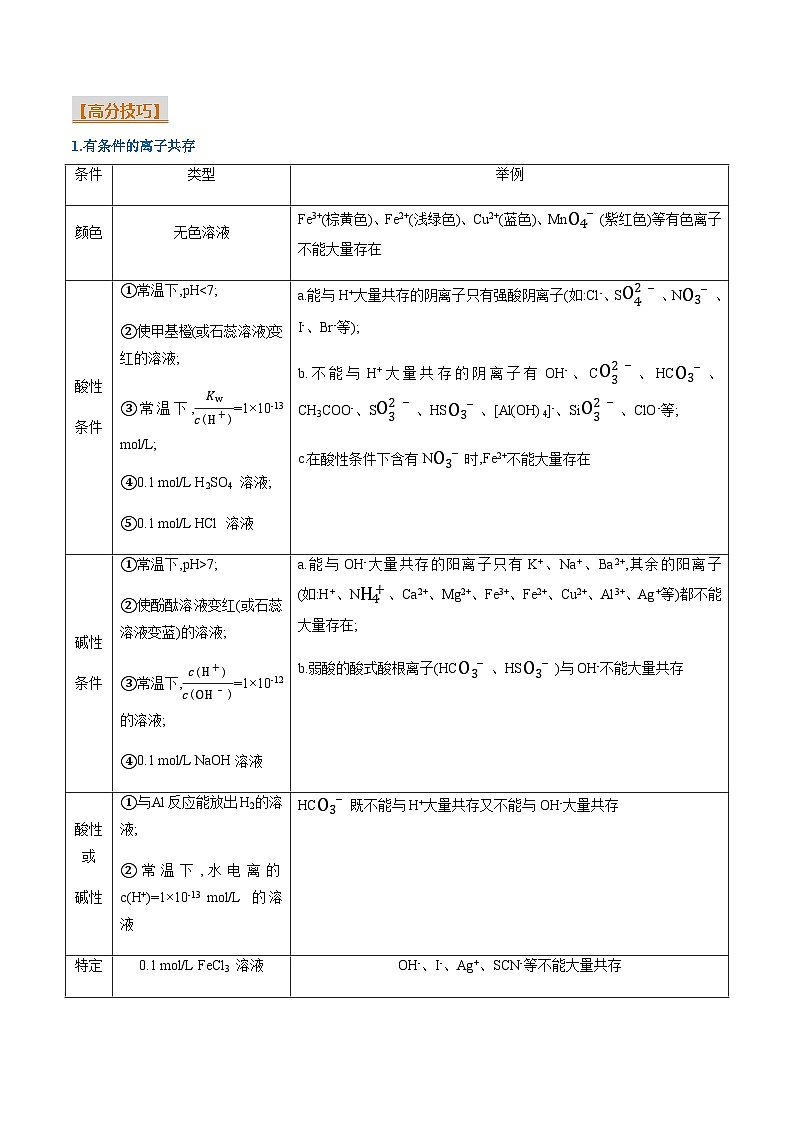
1.有条件的离子共存
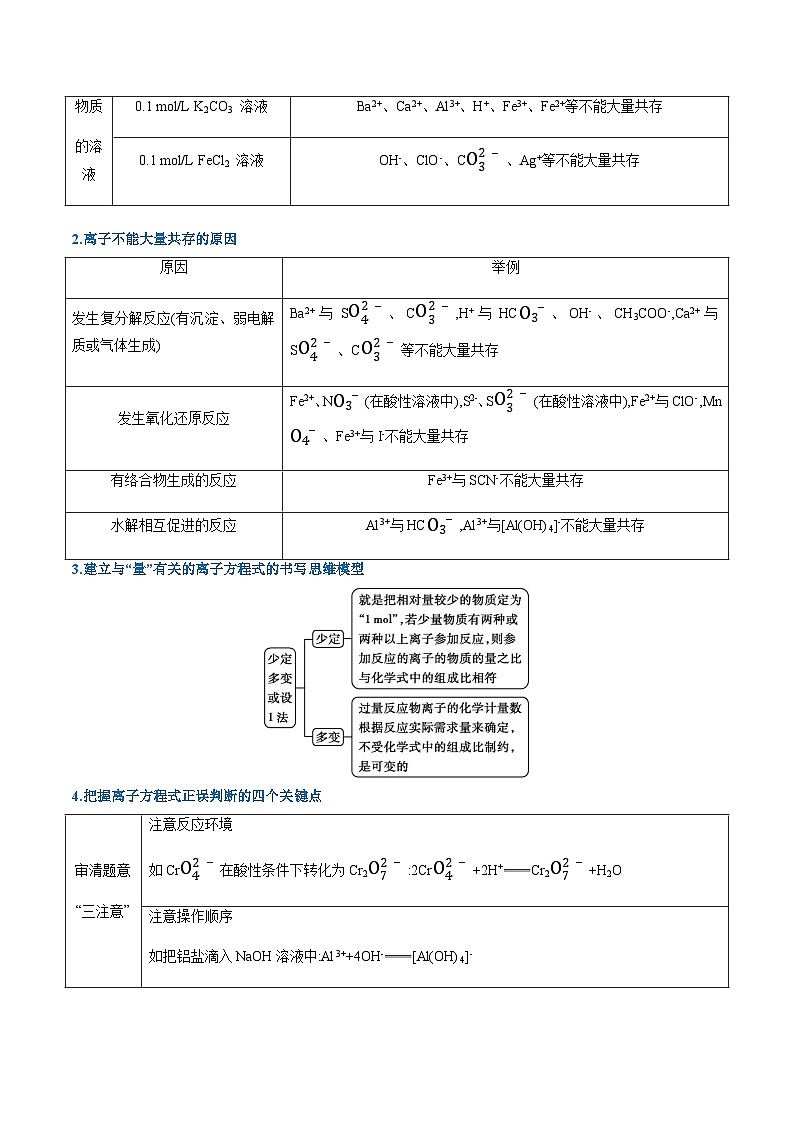
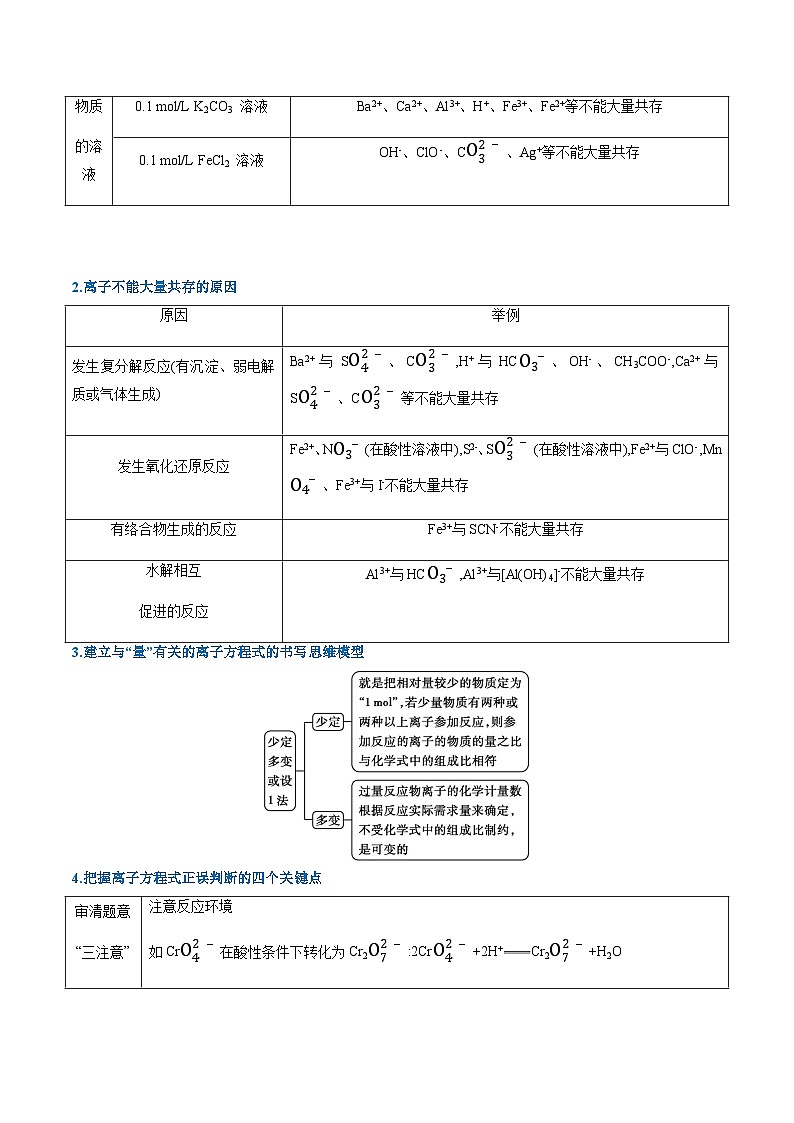
2.离子不能大量共存的原因
3.建立与“量”有关的离子方程式的书写思维模型
4.把握离子方程式正误判断的四个关键点
(建议用时:40分钟)
考向01 化学方程式正误判断
1.(2025·广东广州·联考)下列反应的离子方程式正确的是
A.向CuSO4溶液中滴加过量氨水:
B.用食醋清洗水垢:
C.向碳酸氢钠溶液加入足量澄清石灰水:
D.向次氯酸钠溶液通入少量二氧化硫:
【答案】C
【解析】A.CuSO4与过量氨水反应生成[Cu(NH3)4]SO4,反应的离子方程式为Cu2++4NH3∙H2O=[Cu(NH3)4]2++4H2O,A错误;
B.水垢成分之一碳酸钙难溶于水,反应离子方程式为:,B错误;
C.碳酸氢钠溶液加入足量澄清石灰水反应生成碳酸钙沉淀和NaOH,反应离子方程式为:,C正确;
D.次氯酸钠溶液通入少量二氧化硫,溶液呈碱性,则离子方程式为:,D错误;
故选:C。
2.(2025·广东·联考)下列应用中涉及的方程式或离子方程式不正确的是
A.使用漂白粉消毒:
B.制备白色颜料:
C.泡沫灭火器工作原理:
D.使用FeS处理含汞废水:
【答案】C
【解析】A.碳酸的酸性强于次氯酸,因此在使用漂白粉消毒时,空气中的CO2溶于水,会将ClO-转化为HClO,离子方程式为,A不符合题意;
B.TiCl4为强酸弱碱盐,极易水解,生成TiO2·xH2O和HCl,方程式为,B不符合题意;
C.泡沫灭火器利用的是Al2(SO4)3溶液和NaHCO3溶液,用于灭火时,将两溶液混合, Al3+和发生双水解反应,离子方程式应为,C符合题意;
D.一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。HgS的溶解度比FeS小,因此FeS可用于处理含汞废水,离子方程式为,D不符合题意;
答案选C。
3.(2025·广东·联考)离子方程式是元素及其化合物性质的一种表征形式。下列离子方程式书写不正确的是
A.向漂白粉溶液中通入过量
B.向硫代硫酸钠溶液中加入稀硫酸:
C.用纯碱溶液处理锅炉水垢中的
D.酸性条件下与碘离子的反应:
【答案】D
【解析】A.漂白粉溶液具有氧化性,可将氧化为硫酸根,所以向漂白粉溶液通入过量的离子方程式为,A项正确;
B.向硫代硫酸钠溶液中加入稀硫酸发生氧化还原反应生成、二氧化硫和水等,离子方程式为,B项正确;
C.的溶解度大于,用溶液处理锅炉水垢中的,会转化为,离子方程式为,C项正确;
D.氧化酸性溶液中的碘离子生成碘单质,反应的离子方程式为,D项错误;
故选D。
4.(2025·广东·联考)下列离子方程式书写正确的是
A.漂白粉在空气中久置变质:
B.和面时用小苏打和食醋能使馒头蓬松:
C.硫酸铁溶液用于腐蚀铜质电路板:
D.用氨水吸收烟气中的二氧化硫:
【答案】C
【解析】A.漂白粉在空气中久置,会与空气中的二氧化碳发生反应得到次氯酸,不是水溶液中,不存在离子反应,方程式为,A项错误;
B.食醋的主要成分是醋酸,醋酸是弱酸,在离子方程式中不能拆分,离子方程式为,B项错误;
C.硫酸铁溶液中的具有强氧化性,可以与发生反应,离子方程式为,C项正确;
D.是弱碱,在离子方程式中不能拆分,离子方程式为,D项错误;
答案选C。
5.(2025·广东韶关·一模)下列离子方程式书写错误的是
A.实验室用氯化铝溶液与过量氨水制备氢氧化铝:
B.向溶液中通入少量:
C.溶液与稀硫酸混合:
D.少量金属钠投入溶液中:
【答案】B
【解析】A.氢氧化铝不溶于弱碱,故向氯化铝溶液中加入过量氨水生成氢氧化铝沉淀和氯化铵,反应的离子方程式为:,A正确;
B.碘离子的还原性比亚铁离子强,向溶液中通入少量,氯气先与碘离子反应,反应的离子方程式为:,B错误;
C.溶液与稀硫酸混合,在酸性环境中发生自身歧化反应生成二氧化硫、硫单质和水,离子方程式为:,C正确;
D.少量金属钠投入溶液中,Na非常活泼先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,总反应的离子方程式为:,D正确;
答案选B。
6.(2025·广东肇庆·一模)下列生产生活情境涉及的离子方程式书写正确的是
A.用去除自来水中的余氯():
B.用侯氏制碱法制备碳酸氢钠晶体:
C.用胃舒平[主要成分为]治疗胃酸过多:
D.用溶液刻蚀铜电路板:
【答案】A
【解析】A.用去除自来水中的余氯(),将氧化为,离子方程式为:,A正确;
B.用侯氏制碱法制备碳酸氢钠晶体,碳酸氢钠晶体是固体,离子方程式为:,B错误;
C.用胃舒平[主要成分为]治疗胃酸过多,为难溶物,离子方程式为:,C错误;
D.用溶液刻蚀铜电路板,将Cu氧化为,自身被还原为,离子方程式为:,D错误;
故选A。
7.(2025·广东广州·测试)下列表示对应化学反应的离子方程式正确的是
A.硫酸酸化的淀粉碘化钾溶液久置后变蓝:
B.与水的反应:
C.向溶液中加过量溶液:
D.向溶液中通入过量的:
【答案】A
【解析】A.硫酸酸化的淀粉碘化钾溶液久置后,I-被O2氧化为I2,I2使淀粉变蓝,A正确;
B.钠和水反应生成氢氧化钠和氢气,,B错误;
C.少量的物质完全反应,按照少量物质电离出离子的物质的量之比进行反应,溶液中加过量溶液,碳酸氢根离子完全被反应生成碳酸钙沉淀和水:,C错误;
D.向溶液中通入过量的,发生氧化还原反应,ClO-全部被还原为Cl-,参加反应SO2被氧化为硫酸根离子,并转化为CaSO4沉淀:,D错误;
故选A。
8.(2025·广东广州·月考)下列叙述对应的方程式书写错误的是
A.向溶液中滴加溶液:
B.向饱和NaOH溶液通入过量CO2析出白色晶体: OH-+ CO2=
C.加热蓝色的CuCl2溶液,溶液变黄绿色:[Cu(H2O)4]2+ (aq)[蓝色] + 4Cl-(aq)⇌[CuCl4]2-(aq)[黄色] + 4H2O(l) △H>0
D.向FeSO4溶液中加入H2O2出现红褐色沉淀: 2Fe2+ + H2O2 + 4H2O = 2Fe(OH)3↓+ 4H+
【答案】B
【解析】A.溶液完全电离出Ca2+和OH-离子,完全电离出Ca2+和碳酸氢根离子,反应生成CaCO3沉淀和水,反应的离子方程式为:,A正确;
B.向饱和NaOH溶液通入过量CO2析出白色晶体碳酸氢钠: Na++OH-+ CO2=↓,故B错误;
C.加热蓝色的CuCl2溶液,溶液变黄绿色,说明[Cu(H2O)4]2+向[CuCl4]2-转变,其离子方程式为:[Cu(H2O)4]2+ (aq)[蓝色] + 4Cl-(aq)⇌ [CuCl4]2-(aq)[黄色] + 4H2O(l) △H>0,故C正确;
D.向FeSO4溶液中加入H2O2出现红褐色氢氧化铁沉淀: 2Fe2+ + H2O2 + 4H2O = 2Fe(OH)3↓+ 4H+,故D正确;
答案选B。
9.(2025·广东深圳·统考)下列物质性质与用途对应的离子方程式书写正确的是
A.H2O2氧化海带灰酸性浸出液提取碘:
B.Na2O2与水反应用作潜水艇氧气来源:
C.绿矾处理含的酸性废水:
D.向NaHSO4溶液中加入足量Ba(OH)2溶液:
【答案】A
【解析】A.H2O2氧化海带灰酸性浸出液中的I-,生成I2和水,从而提取碘:,A正确;
B.Na2O2与水反应,生成氧气,作为潜水艇中氧气的来源:,B不正确;
C.绿矾处理含的酸性废水时,将Fe2+氧化为Fe3+,自身被还原为Cr3+:,C不正确;
D.向NaHSO4溶液中加入足量Ba(OH)2溶液,采用“以少定多”法:,D不正确;
故选A。
10.(2025·广东肇庆·月考)对于下列过程中发生的化学反应,相应离子方程式正确的是
A.NaHCO3溶液中通入少量Cl2:HCO+Cl2=CO2+Cl-+HClO
B.用氢氟酸刻蚀玻璃:SiO24H4F-SiF42H2O
C.将FeO固体溶于稀硝酸:FeO+2H+=Fe2++H2O
D.工业废水中的Pb2用FeS去除:Pb2S2-PbS
【答案】A
【解析】A.NaHCO3溶液中通入少量Cl2,先和水反应生成盐酸和次氯酸,盐酸和碳酸氢根离子反应,离子方程式为:HCO+Cl2=CO2+Cl-+HClO ,故A正确;
B.玻璃的主要成分是二氧化硅,氢氟酸能与二氧化硅反应,并且氢氟酸是弱酸,离子方程式中不能拆开,SiO24HFSiF42H2O,故B错误;
C.将FeO固体溶于稀硝酸,正确的离子方程式为:3FeO++10H+=3Fe3++NO+5H2O,故C错误;
D.FeS不溶于水,正确的离子方程式为Pb2+FeSFe2+PbS,故D错误;
答案选A。
11.(2025·广东潮州·质量检测)离于反应能够反映出溶液中反应的实质。下列离子方程式书写正确的是
A.向AlCl3溶液中滴入足量的氨水:
B.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,过滤:
C.向次氯酸钙溶液通入少量二氧化碳:
D.向FeBr2溶液中通入足量Cl2:
【答案】D
【解析】A.氨水的溶质弱碱,生成的Al(OH)3不溶于过量的氨水中,故向溶液中滴入足量的氨水的离子方程式为:,A错误;
B.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,Na2CO3和Na2SO4均会与Ba(OH)2反应,其反应的离子方程式分别为:、,导致Na2CO3也损失,不符合除杂原则,B错误;
C.向次氯酸钙溶液通入少量二氧化碳生成CaCO3和HClO,故离子方程式为:,C错误;
D.向溶液中通入足量反应生成FeCl3和Br2,故离子方程式为:,D正确;
故选D。
12.(2025·广东六校·月考)下列离子方程式或电极反应判断错误的是
A.过量SO2与0.1 ml·L-1 Na2S的溶液反应:3SO2+2S2- = 3S↓+2SO
B.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3- = KFe[Fe(CN)6]↓
C.铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e- = PbO2+4H++
D.利用覆铜板制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
【答案】A
【解析】A.过量SO2与0.1 ml·L-1 Na2S的溶液反应,除了生成黄色沉淀S,还生成了NaHSO3,离子方程式为:5SO2+2S2- +2H2O= 3S↓+4HSO,A项错误;
B.K3[Fe(CN)6]与Fe2+反应生成蓝色沉淀KFe[Fe(CN)6],离子方程式为:K++Fe2++[Fe(CN)6]3- = KFe[Fe(CN)6]↓,B项正确;
C.铅酸蓄电池充电时,阳极硫酸铅失电子生成二氧化铅,阳极反应式为:PbSO4+2H2O-2e- = PbO2+4H++,C项正确;
D.利用覆铜板制作印刷电路板就是铜单质和氯化铁溶液的反应,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,D项正确;
答案选A。
13.(2025·广东东莞·月考)化学反应中有颜色变化之美。下列相关离子方程式表示不正确的是
A.向Na2S2O3溶液中滴加稀硫酸出现黄色沉淀:+2H+=S↓+SO2↑+H2O
B.向过量Fe粉添加稀硝酸:Fe++4H+=Fe3++NO↑+2H2O
C.试管上的银镜用稀硝酸清洗:3Ag++4H+=3Ag++NO↑+2H2O
D.向HI溶液中加入H2O2后溶液变为黄色:2I−+2H++H2O2=I2+2H2O
【答案】B
【解析】A.向Na2S2O3溶液中滴加稀硫酸出现黄色沉淀,生成S和SO2,离子方程式为:+2H+=S↓+SO2↑+H2O,A正确;
B.向过量Fe粉添加稀硝酸,铁被氧化为Fe2+,离子方程式为:3Fe+2+8H+=3Fe2++2NO↑+4H2O,B错误;
C.试管上的银镜用稀硝酸清洗,银和稀硝酸发生反应生成硝酸银、NO和水,离子方程式为:3Ag++4H+=3Ag++NO↑+2H2O,C正确;
D.向HI溶液中加入H2O2后溶液变为黄色,碘离子被氧化为碘单质,离子方程式为:2I−+2H++H2O2=I2+2H2O,D正确;
故选B。
14.(2025·广东东莞·月考)下列指定反应的离子方程式正确的是
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH−═+H2↑
B.NaHCO3溶液中加足量Ba(OH)2溶液:+Ba2++OH-=BaCO3↓+H2O
C.在含有1mlFeI2的溶液中通入2mlCl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.向氯化铁中加入少量的H2S:2Fe3++S2-=2Fe2++S↓
【答案】B
【解析】A.铝粉和NaOH溶液反应生成四羟基合铝酸钠和H2,反应的离子方程式为2Al+2OH−+6H2O═2+3H2↑,故A错误;
B.NaHCO3溶液中加足量Ba(OH)2溶液,生成碳酸钡沉淀、水、氢氧化钠,反应的离子方程式是+Ba2++OH-=BaCO3↓+H2O,故B正确;
C.将2mlCl2通入到含1mlFeI2的溶液中,氯气过量,亚铁离子和碘离子都被氧化,正确的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2,故C错误;
D.铁离子具有氧化性,和硫化氢生成硫单质和亚铁离子,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故D错误;
答案选B。
考向01 离子共存、检验和推断
15.(2025·广东潮州·月考)下列各组离子能大量共存的是
A.能使甲基橙变红的溶液:、、、
B.澄清透明的溶液中:、、、
C.小苏打溶液中:、、、
D.无色强碱性溶液中:、、、
【答案】B
【解析】A.能使甲基橙变红的溶液中含有大量的H+,则H+、、三者之间因发生氧化还原反应而不能大量共存,A不合题意;
B.澄清透明的溶液中、、、离子间不反应,能够大量共存,B符合题意;
C.小苏打溶液中含有大量的,和、均能发生反应而不能大量共存,C不合题意;
D.无色强碱性溶液中含有大量的OH-,则OH-与发生反应生成沉淀而不能大量共存,D不合题意;
故答案为:B。
16.(2025·广东东莞·月考)下列条件下,对应离子一定能大量共存的是
A.0.1 ml·L-1的NaHCO3溶液中:Al3+、K+、Cl-、
B.使甲基橙变红的溶液中:、Al3+、Cl-、Mg2+
C.新制饱和氯水溶液中:S2-、、Na+、Cl-
D.=1×1012的溶液中:Fe2+、、、Na+
【答案】B
【解析】A.0.1 ml·L-1的NaHCO3溶液中Al3+和发生双水解反应,不能大量共存,A错误;
B.使甲基橙变红的溶液呈酸性,、Al3+、Cl-、Mg2+在酸性溶液中不发生反应,可以大量共存,B正确;
C.新制饱和氯水溶液中含有HClO和H+,会和H+反应,S2-会和HClO发生氧化还原反应,不能大量共存,C错误;
D.=1×1012的溶液中,溶液呈碱性,会和OH-、Fe2+反应,不能大量共存,D错误;
故选B。
17.(2025·广东佛山·月考)下列各组离子一定能大量共存的组合是
①在含有大量溶液中:
②常温下的溶液:
③常温下的溶液中:
④在澄清透明的水溶液中:
⑤常温下的溶液:
⑥常温下的溶液中:
A.①②⑥B.②④⑤C.④⑤⑥D.①②③
【答案】B
【解析】①在含有大量四羟基合铝酸根离子溶液中四羟基合铝酸根离子能与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子,不能大量共存,故错误;
②常温下四种离子在硫酸铁溶液中不发生任何反应,一定能大量共存,故正确;
③常温下铁离子在溶液中水解使溶液呈酸性,所以pH为7的溶液中不可能含有铁离子,故错误;
④四种离子在澄清透明的水溶液中不发生任何反应,一定能大量共存,故正确;
⑤常温下氢氧根离子浓度为10—12ml/L的溶液为酸性溶液,四种离子在酸性溶液中不发生任何反应,一定能大量共存,故正确;
⑥常温下pH为1的溶液是酸性溶液,酸性溶液中铬酸根离子能与氢离子反应生成重铬酸根离子和水,不能大量共存,故错误;
②④⑤正确,故选B。
18.(2025·广东广州·月考)室温下,下列各组离子在指定溶液中能大量共存的是
A.Cu2+、Al3+、Na+、B.、Na+、、OH-
C.Fe3+、K+、I-、D.S2-、Na+、OH-、ClO-
【答案】A
【解析】A.各离子之间不反应,可以相互共存,A符合题意;
B.铵根离子与OH-不能大量共存,B不符合题意;
C.铁离子具有强氧化性,I-具有还原性,二者发生氧化还原反应,不能大量共存,C不符合题意;
D.S2-具有还原性,ClO-具有氧化性,二者发生氧化还原反应,不能大量共存,D不符合题意;
故答案为:A。
19.(2025·北京·测试)下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:、、、
B.含有的溶液中:、、、
C.强酸性溶液中:、、、
D.的NaOH溶液中:、、、
【答案】D
【解析】A.铜离子为蓝色,不能在无色溶液中大量存在,故A不符合题意;
B.大量氢离子存在时,硝酸根会把碘离子、亚硫酸根氧化,故B不符合题意;
C.强酸性溶液中氢离子会和碳酸氢根离子反应,不能共存,故C不符合题意;
D.四种离子相互之间不反应,也不与NaOH反应,可以大量共存,故D符合题意;
故选D。
20.(2025·山西·月考)下列离子组在指定条件下能大量共存的是
A.在澄清溶液中:Cu2+、、、Cl-
B.在0.1ml·L-1Ba(OH)2溶液中:Mg2+、Na+、、
C.在0.1ml·L-1HI溶液中:Fe3+、Al3+、Br-、
D.在0.1ml·L-1FeSO4溶液中:Na+、、S2-、Cl-
【答案】A
【解析】A.在澄清溶液中,Cu2+、、、Cl-之间不发生反应,可以大量共存,A正确;
B.在0.1ml·L-1Ba(OH)2溶液中,Mg2+、与反应不能大量共存,B错误;
C.在0.1ml·L-1HI溶液中,Fe3+与发生氧化还原反应不能大量共存,C错误;
D.在0.1ml·L-1FeSO4溶液中,S2-与Fe2+生成FeS沉淀不能大量共存,D错误;
答案选A。
21.(2025·广东·质检)碳酸钠,作为一种多功能的化合物,在日常生活和工业生产中扮演着举足轻重的角色。其一种工业制法如图所示,下列说法错误的是
A.上述过程不涉及氧化还原反应
B.可用浓溶液和湿润的红色石蕊试纸验证母液中含有
C.将和通入饱和食盐水时,应先通入
D.将投入母液中,发生反应的离子方程式之一为
【答案】B
【分析】侯德榜联合制碱反应为:NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,在沉淀池中,加入饱和食盐水,先通氨气,后通CO2,生成的NaHCO3大部分以晶体的形式析出,过滤后加热便可获得纯碱产品,CO2气体循环使用;母液为NH4Cl溶液,通入NH3并撒入食盐细粒,便可让NH4Cl结晶析出,据此分析。
【解析】A.涉及的反应有:、、CO2 + NH3+H2O+ NaCl =NaHCO3 ↓+ NH4Cl、,均是非氧化还原反应,A正确;
B. NaOH浓溶液并加热,产生的NH3用湿润的红色石蕊试纸检验,试纸变为蓝色可验证母液中含有,B错误;
C.将和通入饱和食盐水时,应先通入,由于氨气极易溶于水,再通二氧化碳,能较多的吸收二氧化碳,生成更多NaHCO3晶体,C正确;
D.石灰石煅烧后产生CaO、CO2,CaO加入到母液中,CaO溶于水产生Ca(OH)2,母液为氯化铵,发生反应:、,因此将CaO投入母液中,发生反应的离子方程式之一为,D正确;
故选B。
考点
三年考情分析
2025考向预测
反应方程式书写正误判断
2022·广东卷T14;2022·广东卷T15;
预计2025年高考依然重点考查离子方程式的书写,以及离子共存判断和离子检验等。
离子共存、检验和推断
2024·广东卷T7;
条件
类型
举例
颜色
无色溶液
Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)、MnO4-(紫红色)等有色离子不能大量存在
酸性
条件
①常温下,pH7;
②使酚酞溶液变红(或石蕊溶液变蓝)的溶液;
③常温下,c(H+)c(OH-)=1×10-12的溶液;
④0.1 ml/L NaOH溶液
a.能与OH-大量共存的阳离子只有K+、Na+、Ba2+,其余的阳离子(如:H+、NH4+、Ca2+、Mg2+、Fe3+、Fe2+、Cu2+、Al3+、Ag+等)都不能大量存在;
b.弱酸的酸式酸根离子(HCO3-、HSO3-)与OH-不能大量共存
酸性或
碱性
①与Al反应能放出H2的溶液;
②常温下,水电离的c(H+)=1×10-13 ml/L 的溶液
HCO3-既不能与H+大量共存又不能与OH-大量共存
特定
物质
的溶液
0.1 ml/L FeCl3 溶液
OH-、I-、Ag+、SCN-等不能大量共存
0.1 ml/L K2CO3 溶液
Ba2+、Ca2+、Al3+、H+、Fe3+、Fe2+等不能大量共存
0.1 ml/L FeCl2 溶液
OH-、ClO-、CO32-、Ag+等不能大量共存
原因
举例
发生复分解反应(有沉淀、弱电解质或气体生成)
Ba2+与SO42-、CO32-,H+与HCO3-、OH-、CH3COO-,Ca2+与SO42-、CO32-等不能大量共存
发生氧化还原反应
Fe2+、NO3-(在酸性溶液中),S2-、SO32-(在酸性溶液中),Fe2+与ClO-,MnO4-、Fe3+与I-不能大量共存
有络合物生成的反应
Fe3+与SCN-不能大量共存
水解相互
促进的反应
Al3+与HCO3-,Al3+与[Al(OH)4]-不能大量共存
审清题意
“三注意”
注意反应环境
如CrO42-在酸性条件下转化为Cr2O72-:2CrO42-+2H+Cr2O72-+H2O
注意操作顺序
如把铝盐滴入NaOH溶液中:Al3++4OH-[Al(OH)4]-
注意反应物之间量的关系
如向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀:H++OH-+SO42-+Ba2+BaSO4↓+H2O
化学式拆写
“四原则”
易溶强电解质拆,弱电解质、难溶物不拆;微溶物清拆浊不拆;单质、氧化物不拆;浓硫酸不拆,浓盐酸、浓硝酸拆
反应产物
“三分析”
分析量不同时的产物
如向Ca(OH)2溶液中滴加少量NaHCO3溶液:HCO3-+OH-+Ca2+CaCO3↓+H2O
分析是否漏掉同步反应
如Ba(OH)2与硫酸反应:2H++2OH-+SO42-+Ba2+BaSO4↓+2H2O,而不是SO42-+Ba2+BaSO4↓
分析变价元素的产物
如Fe3O4与盐酸反应:Fe3O4+8H+Fe2++2Fe3++4H2O
方程式遵循
“三守恒”
原子守恒、电荷守恒、电子转移守恒
相关试卷
这是一份重难点04 有关阿伏加德罗常数的正误判断-2025年高考化学 热点 重点 难点 专练(广东专用),文件包含重难点04有关阿伏加德罗常数的正误判断-2025年高考化学热点重点难点专练广东专用原卷版docx、重难点04有关阿伏加德罗常数的正误判断-2025年高考化学热点重点难点专练广东专用解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份重难点03 离子方程式正误判断、离子共存、检验和推断-2025年高考化学 热点 重点 难点 专练(浙江专用),文件包含重难点03离子方程式正误判断离子共存检验和推断-2025年高考化学热点重点难点专练浙江专用原卷版docx、重难点03离子方程式正误判断离子共存检验和推断-2025年高考化学热点重点难点专练浙江专用解析版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
这是一份重难点04 离子反应与离子方程式-2025年高考化学 热点 重点 难点 专练(北京专用),文件包含重难点04离子反应与离子方程式-2025年高考化学热点重点难点专练北京专用原卷版docx、重难点04离子反应与离子方程式-2025年高考化学热点重点难点专练北京专用解析版docx等2份试卷配套教学资源,其中试卷共75页, 欢迎下载使用。








