
所属成套资源:【备战2025】2025年高考化学二轮复习易错重难点提升【新高考】(含解析)
专题04 氧化还原反应(讲练)—2025学高考化学二轮复习易错重难提升(含解析)【新高考】
展开
这是一份专题04 氧化还原反应(讲练)—2025学高考化学二轮复习易错重难提升(含解析)【新高考】,共14页。试卷主要包含了易错点分析,易错训练等内容,欢迎下载使用。
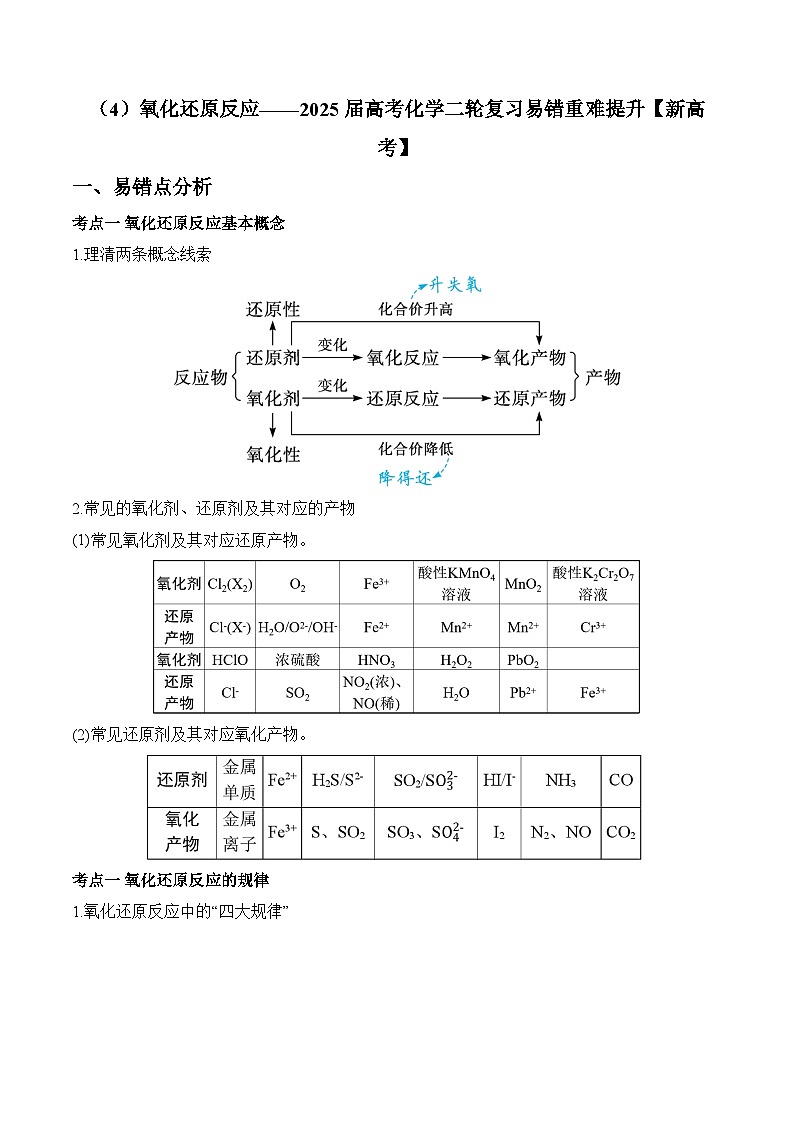
考点一 氧化还原反应基本概念
1.理清两条概念线索
2.常见的氧化剂、还原剂及其对应的产物
(1)常见氧化剂及其对应还原产物。
(2)常见还原剂及其对应氧化产物。
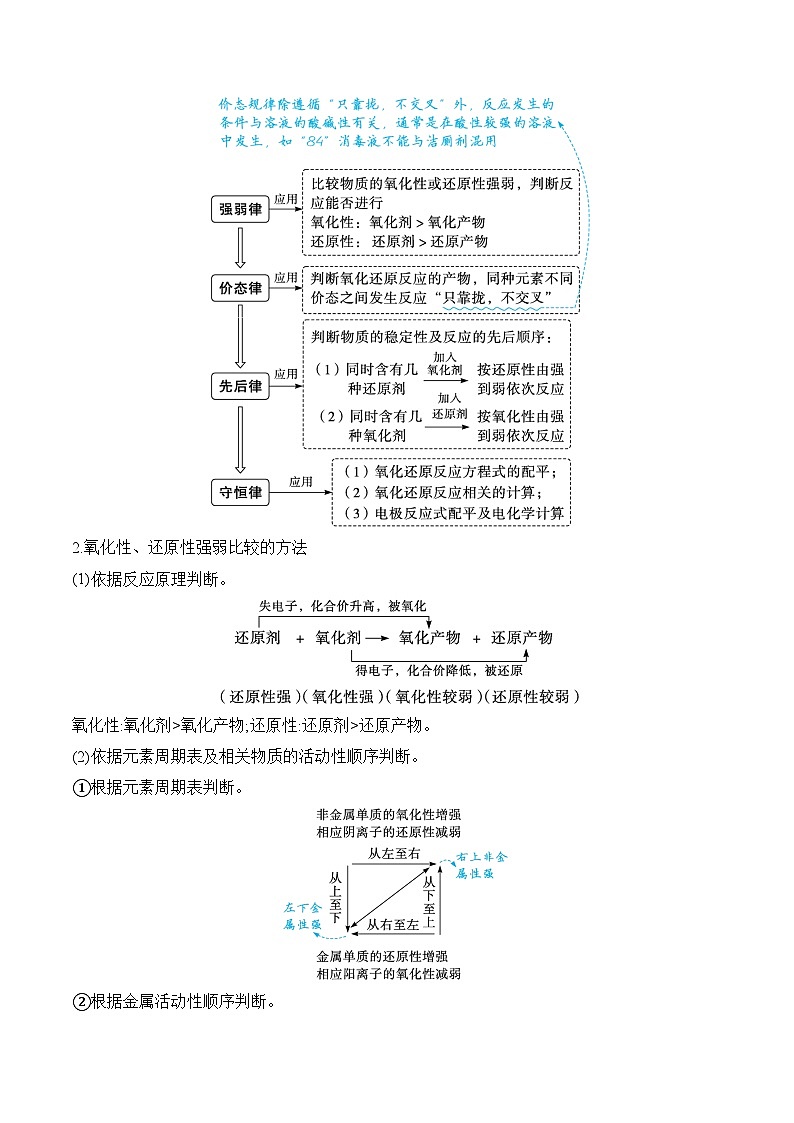
考点一 氧化还原反应的规律
1.氧化还原反应中的“四大规律”
2.氧化性、还原性强弱比较的方法
(1)依据反应原理判断。
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)依据元素周期表及相关物质的活动性顺序判断。
①根据元素周期表判断。
②根据金属活动性顺序判断。
③根据非金属活动性顺序判断。
(3)依据电化学原理判断。
①原电池:一般情况下,两种不同的金属构成原电池的两极,还原性:负极>正极。
特例:Al、Mg和NaOH溶液构成原电池,因Mg不能与NaOH溶液反应,负极是相对不活泼的Al
②电解池:用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
3.氧化还原反应方程式的配平步骤及方法
二、易错训练
1.下列实验中的现象及现象过程中与氧化还原反应无关的是( )
A.AB.BC.CD.D
2.硝酸工业尾气中的NO、可用火碱溶液吸收,有关化学反应为:
①;
②。
下列说法错误的是( )
A.反应①、②均为氧化还原反应
B.反应①中氧化产物与还原产物的物质的量之比为1:1
C.若尾气可以被完全吸收,则尾气中与NO的体积之比可能大于1:1
D.反应②中,生成2ml共转移电子的物质的量为2ml
3.电视剧中美轮美奂的“仙境”,其中所需的烟雾是在置于温热石棉网上的和Zn粉混合物中滴几滴水后能持续产生白烟,涉及反应:。下列有关说法中错误的是( )
A.上述反应属于氧化还原反应
B.氮气既是氧化产物也是还原反应
C.在标准状况下,11.2L中所含电子的物质的量为6ml
D.每生成1mlZnO共转移5ml电子
4.常温下,实验室可用和浓盐酸反应制取,反应原理为,下列说法正确的是( )
A.该反应中氧化剂,发生还原反应
B.该反应中氧化剂与还原剂的物质的量之比为1:8
C.该反应说明氧化性:
D.该反应中每消耗,生成
5.锅炉水内溶解的氧气易对锅炉造成腐蚀,为了保证锅炉的安全正常使用,常使用联氨()处理锅炉水中溶解的氧,部分转化关系如图所示。下列说法错误的是( )
A.液态不能导电
B.反应①②③④均属于氧化还原反应
C.反应②中,每生成23.2g,生成0.1ml
D.反应①的电子转移可表示为
6.某运载火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为,则下列叙述错误的是( )
A.此反应是氧化还原反应B.反应瞬间产生大量高温气体,推动火箭飞行
C.R的分子式为D.在反应中作还原剂
7.以太阳能为热源分解,铁氧化合物循环分解水制的过程如图所示。下列说法错误的是( )
A.过程Ⅰ、Ⅱ发生的反应均属于氧化还原反应
B.该制氢过程中,固体的颜色不会发生变化
C.过程Ⅰ中每消耗116g理论上转移2ml电子
D.过程Ⅱ的化学方程式为
8.CuCl在有机合成中常用作催化剂或还原剂,其一种制备方法为,下列说法错误的是( )
A.氧化剂和还原剂的物质的量之比为2∶1
B.还原产物为CuCl
C.电子转移的方向和数目可表示为
D.每转移1ml,生成的质量为142g
9.根据下列反应判断,有关物质的氧化性由强到弱的顺序正确的( )
①②③
A.B.
C.D.
10.在特定碱性条件下,过量可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为(未配平),下列有关说法正确的是( )
A.Y为
B.上述反应中氧化剂和还原剂的物质的量之比为2:3
C.1ml参加反应时,转移电子的物质的量为6ml
D.在酸性条件下可以转化为
11.常温下,可混合制备氯气,其化学方程式为:,下列说法错误的是( )
A.与和浓盐酸制比较可知,氧化性:
B.标准状况下,生成5.6L时,转移的电子数目为0.5
C.该反应中HCl只表现出还原性
D.该反应中1ml被还原,则有5mlHCl被氧化
12.溶液中有如下反应(未配平):,有关叙述正确的是( )
A.当有1ml电子转移时,消耗硫酸1ml
B.消耗3ml,有0.5ml被还原
C.反应中氧化剂和还原剂物质的量之比为6∶1
D.若用代替,上述反应的离子方程式不变
13.去除酸性废水中的反应机理如图所示(图中“HS・”为自由基)。下列说法正确的是( )
A.X的化学式为
B.1mlHS・自由基含18ml电子
C.步骤Ⅲ反应中氧化产物与还原产物的物质的量比为8:1
D.步骤Ⅳ生成1ml需要67.2L气体
14.化学与生产、生活、环境息息相关。从化学视角回答下列问题:
(1)钠在空气中的燃烧产物A可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为_______(写一种即可)。
(2)家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂进行疏通。管道疏通剂主要成分为铝和氢氧化钠,疏通管道时发生反应的离子方程式是_______。
(3)亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用。已知能发生反应:。
①配平上述化学方程式,并用“双线桥”标明电子转移的方向和数目_______。
②氧化剂与还原剂的物质的量之比为_______;反应中转移0.3ml电子时生成标准状况下的NO_______L。
③误食会导致血红蛋白中的转化为而中毒,可服用维生素C解毒,维生素C在解毒过程中作_______剂。
15.双氧水是工业上常用的绿色氧化剂,也是治疗创伤伤口的消毒剂以及环境消毒剂,贮存时见光、受热或有杂质进入会加快分解速率。氨水具有部分碱的通性,受热易分解,实验室中密封保存。回答下列问题。
(1)双氧水用于伤口的消毒,是利用的___________性(填“强氧化”或“强还原”)。
(2)向双氧水中滴加酸性溶液,溶液的紫红色褪去,说明具有___________性(填“氧化”或“还原”)。
(3)过氧化钙()是一种水产养殖增氧剂。一种过氧化钙的制备方法如下:在冰水浴的环境下,向饱和溶液中加入双氧水和氨水,不断搅拌,析出纯度较高的晶体。
①该反应在冰水浴环境下进行的目的是___________。
②作增氧剂,与水反应的化学方程式为___________。
(4)酸性条件下,向双氧水中加入或,发生反应的过程表示如图所示:
①在过程ⅰ、ⅱ中表现出氧化性的是___________(填“ⅰ”或“ⅱ”)。
②过程ⅰ中发生反应的化学方程式为,用单线桥法表示该反应中电子转移的方向和数目:___________,该反应中每生成标准状况下,转移电子的物质的量为___________。
③过程ⅱ中发生反应的化学方程式为___________。
答案以及解析
1.答案:B
解析:B.向碳酸钠溶液中边振荡边滴加稀盐酸直至过量,起初生成和NaCl,与HCl继续反应生成NaCl、等,有气泡产生,B符合题意。
2.答案:D
解析:A.反应①、②中均有元素化合价变化,均为氧化还原反应,故A正确;
B.反应①中氧化产物与还原产物的物质的量之比为1:1,故B正确;
C.若尾气可以被完全吸收,则尾气中与NO的体积之比可能大于1:1或等于1:1,故C正确;
D.反应②中,生成2ml共转移电子的物质的量为1ml,故D错误;
故选D。
3.答案:C
解析:锌元素的化合价升高,锌作还原剂,ZnO是氧化产物,中氮元素的化合价既升高又降低,故氨气既是氧化产物也是还原产物,A、B两项均正确;标准状况下,11.2L的物质的量为0.5 ml,其所含电子的物质的最为0.5 ml×14-7 ml,C项错误;由元素的化合价变化可知。每生成1 ml ZnO共转移5 ml电子,D项正确。
4.答案:AC
解析:A.该反应中是氧化剂,发生还原反应,故A正确;
B.该反应中氧化剂与还原剂的物质的量之比为,故B错误;
C.该反应中氧化剂是,氧化产物是,氧化剂的氧化性大于氧化产物,所以氧化性:,故C正确;
D.该反应中每消耗2ml,生成5ml,但是没有说明气体所处的温度和压强,无法计算气体的体积,故D错误;
故选AC。
5.答案:C
解析:C.反应②的化学方程式为,的物质的量为,根据方程式可知生成0.025ml,故C错误。
6.答案:D
解析:A.N元素在反应物中以化合态存在,反应生成氮气,N元素化合价变化,反应是氧化还原反应,故A正确;
B.偏二甲肼和四氧化二氮剧烈反应产生大量气体并释放出大量的热,瞬间产生大量高温气体,推动火箭飞行,故B正确;
C.根据原子守恒可知,偏二甲肼的分子式为,故C正确;
D.中N元素化合价降低,是氧化剂,偏二甲肼中所含元素化合价一定有升高,故偏二甲肼作还原剂,故D错误;
故选:D。
7.答案:C
解析:过程Ⅰ、Ⅱ发生的反应均有单质生成,元素化合价一定发生了变化,发生了氧化还原反应,A项正确;FeO和均为黑色固体,固体的颜色不会发生变化,B项正确;116g的物质的量为0.5ml,生成FeO时,理论上转移1ml电子,C项错误;根据流程中给出的信息,判断反应物和生成物,过程Ⅱ的化学方程式为,D项正确。
8.答案:D
解析:每转移1ml,生成的的质量为71g,D项错误。
9.答案:C
解析:氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;反应①中氧化剂为,氧化产物为,则氧化性:;反应②中氧化剂为,氧化产物为,则氧化性:;反应③中氧化剂为,氧化产物为,则氧化性:,所以氧化性由强到弱的顺序为,故C正确;
故选:C。
10.答案:D
解析:配平该反应为,可知Y为,A错误;该反应氧化剂为,还原剂为,二者物质的量之比为3:2,B错误;1ml参加反应时,转移电子的物质的量为2ml,C错误;在酸性条件下可以转化为,离子方程式为,D正确。
11.答案:C
解析:A.和浓盐酸制,需要加热,用高锰酸钾与浓盐酸制备氯气常温就可以,所以氧化性:,故A说法正确;
B.根据化学方程式中Mn元素的化合价变化,可知生成5ml需转移电子数目为10,所以当生成5.6L时,即0.25ml,则转移的电子数为0.5,故B说法正确;
C.该反应中HCl不仅表现出还原性,还表现出酸性,因为该反应还生成了KCl、,故C说法错误;
D.通过化学方程式可知,2ml被还原,有10mlHCl被氧化,故1ml被还原,则有5mlHCl被氧化,故D说法正确;
本题答案C。
12.答案:B
解析:A.由分析可知,反应消耗3ml硫酸时,反应转移6ml电子,则有1ml电子转移时,消耗硫酸的物质的量为1ml×=0.5ml,故A错误;
B.由分析可知,反应消耗6ml亚铁离子时,被还原氯酸根离子的物质的量为1ml,则反应消耗3ml亚铁离子时,被还原氯酸根离子的物质的量为1ml×=0.5ml,故B正确;
C.由分析可知,反应中氧化剂氯酸钠和还原剂硫酸亚铁的物质的量之比为1∶6,故C错误;
D.硝酸具有强氧化性,也能与亚铁离子发生氧化还原反应,则用硝酸代替硫酸,题给反应的反应的离子方程式会发生变化,故D错误;
故选B。
13.答案:A
解析:A.正确;B.1mlHS・自由基含17ml电子,B错误;C.氧化产物与还原产物的物质的量比为1:8,C错误;D.没有标准状况,D错误。
14.答案:(1)或
(2)
(3);1∶1;6.72;还原
解析:(1)钠在空气中的燃烧产物A为过氧化钠,可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应是过氧化钠与水或二氧化碳反应生成氧气,化学方程式为或。故答案为:或;
(2)管道疏通剂主要成分为铝和氢氧化钠,反应生成偏铝酸钠和氢气,疏通管道时发生反应的离子方程式是。故答案为:;
(3)①在反应中,N元素的化合价从+3价降低到了+2价,得到了1ml电子,I元素的化合价从-1价升高到了0价,共失去电子2ml,根据电子守恒,所含以氮元素的物质前边都乘以系数2,碘单质系数是1,根据原子守恒,NaI前边式系数2,HI前边式系数4,水的前边是系数2,,用“双线桥”标明电子转移的方向和数目。故答案为:;
②氧化剂与还原剂HI的物质的量之比为1∶1;由方程式每转移1ml电子生成1mlNO,反应中转移0.3ml电子时生成标准状况下的0.3ml×22.4L/ml=6.72LNO。故答案为:1∶1;6.72;
③误食会导致血红蛋白中的转化为而中毒,可服用维生素C解毒,将还原为,维生素C在解毒过程中作还原剂。故答案为:还原。
15.答案:(1)强氧化
(2)还原
(3)①防止温度过高,和分解
②
(4)①ⅱ
②;1ml
③
解析:(1)具有强氧化性,能用来消毒杀菌;
(2)酸性溶液的紫红色褪去转化为,元素的化合价降低,作氧化剂,则作还原剂,表现还原性;
(3)①和受热易分解,在冰水浴环境下反应的目的是防止温度过高,和分解;
②与水的反应类似与水的反应,与水反应生成和,反应的化学方程式为。
选项
A
B
C
D
实验
过量的硫酸亚铁溶液加入到高锰酸钾溶液中
向碳酸钠溶液中边振荡边滴加稀盐酸直至过量
漂白粉长期暴露在潮湿的空气中
紫色石蕊试液滴入新制氯水中
现象及现象过程中
紫色褪去,溶液最终变为浅黄色
最初没有现象,继续滴加稀盐酸产生气泡
白色粉末失效最终变成团块,无法均匀地溶解在水中
溶液变红,随后迅速褪色
相关试卷
这是一份专题04 氧化还原反应及其应用(含解析)-2025高考化学专题二轮复习冲刺练习,共25页。试卷主要包含了单选题,多选题,填空题,实验题,计算题,元素或物质推断题,工业流程题等内容,欢迎下载使用。
这是一份高考化学二轮复习易错题易错点04 氧化还原反应(解析版),文件包含高考化学二轮复习易错题易错点04氧化还原反应原卷版docx、高考化学二轮复习易错题易错点04氧化还原反应解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
这是一份新高考化学二轮复习考点提升讲与练专题04 氧化还原反应及其应用(专讲)(解析版),文件包含新高考化学二轮复习考点提升讲与练专题04氧化还原反应及其应用专讲原卷版docx、新高考化学二轮复习考点提升讲与练专题04氧化还原反应及其应用专讲解析版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。









