


所属成套资源:【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用)
- 专题55 化学平衡常数及计算-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用) 试卷 0 次下载
- 专题56 化学反应速率与平衡图像问题(讲练)- 最近10年(14-23年)高考化学真题分项汇编(全国通用) 试卷 0 次下载
- 专题58 弱电解质的电离-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用) 试卷 0 次下载
- 专题59 水的电离与溶液的pH-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用) 试卷 0 次下载
- 专题60 酸碱中和滴定及曲线-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用) 试卷 0 次下载
专题57 化学反应速率与平衡综合问题(讲练)- 最近10年(14-23年)高考化学真题分项汇编(全国通用)
展开
这是一份专题57 化学反应速率与平衡综合问题(讲练)- 最近10年(14-23年)高考化学真题分项汇编(全国通用),文件包含专题57化学反应速率与平衡综合问题原卷卷docx、专题57化学反应速率与平衡综合问题解析卷docx等2份试卷配套教学资源,其中试卷共71页, 欢迎下载使用。
一、高考真题汇编的意义。1、增强高考考生的复习动力和信心;2、提高高考考生的复习效率;3、加深考生对知识点的理解和掌握。
二、高考真题汇编的内容。1、高考试题收录;2、答案解析;3、复习指导。
三、高考真题汇编的重要性。高考真题汇编不仅可以提高考生的复习动力和信心,增强考生的复习效率,而且还可以加深考生对知识点的理解和掌握,使考生更好地把握考试方向,为高考复习提供了有力的支持。
最近10年(14-23年)高考化学分项汇编
专题57 化学反应速率与平衡综合问题
1.【2023年6月浙江卷】一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I反应Ⅱ,故A正确;B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I0平衡右移,Li增多LiH 减少,则结合选项C可知:80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD) ,D正确;答案为:C。
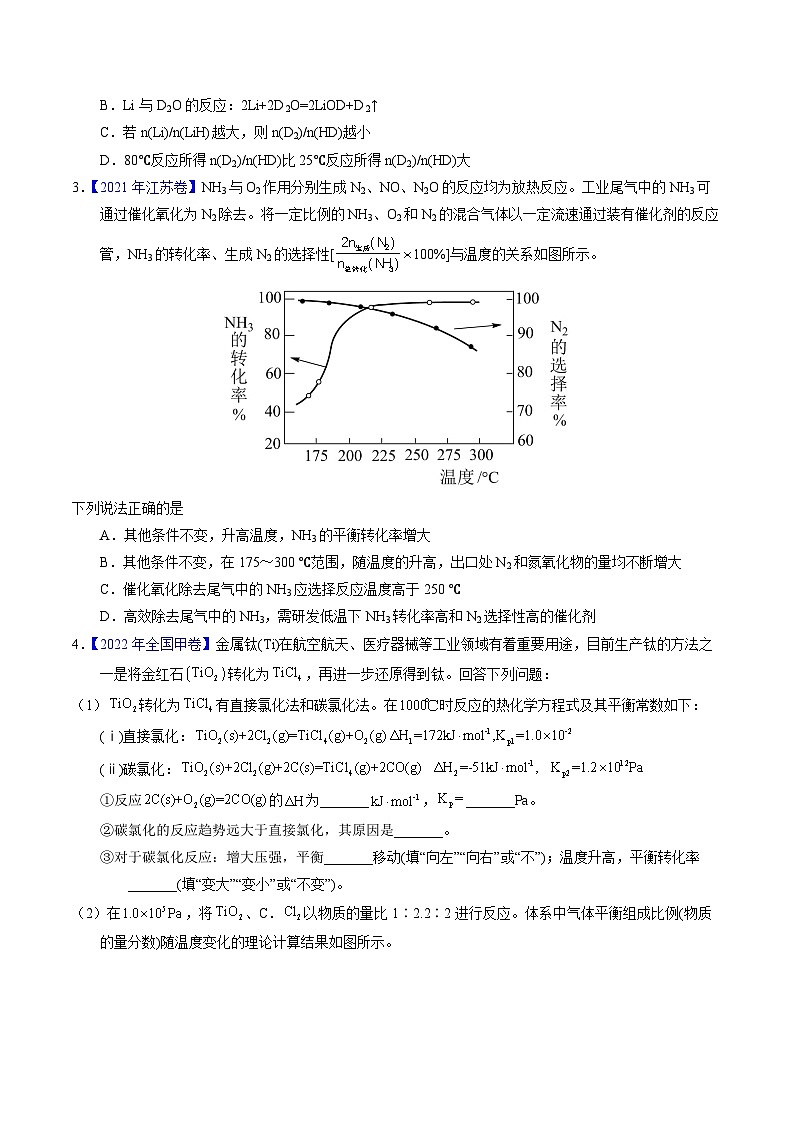
3.【2021年江苏卷】NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[100%]与温度的关系如图所示。
下列说法正确的是
A.其他条件不变,升高温度,NH3的平衡转化率增大
B.其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C.催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D.高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
【答案】D
【解析】A.NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,氨气的平衡转化率降低,故A错误;B.根据图象,在175~300 ℃范围,随温度的升高,N2的选择率降低,即产生氮气的量减少,故B错误;C.根据图象,温度高于250℃ N2的选择率降低,且氨气的转化率变化并不大,浪费能源,根据图象,温度应略小于225℃,此时氨气的转化率、氮气的选择率较大,故C错误;D.氮气对环境无污染,氮的氧化物污染环境,因此高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,故D正确;答案为D。
4.【2022年全国甲卷】金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:
①反应的为_______,_______Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
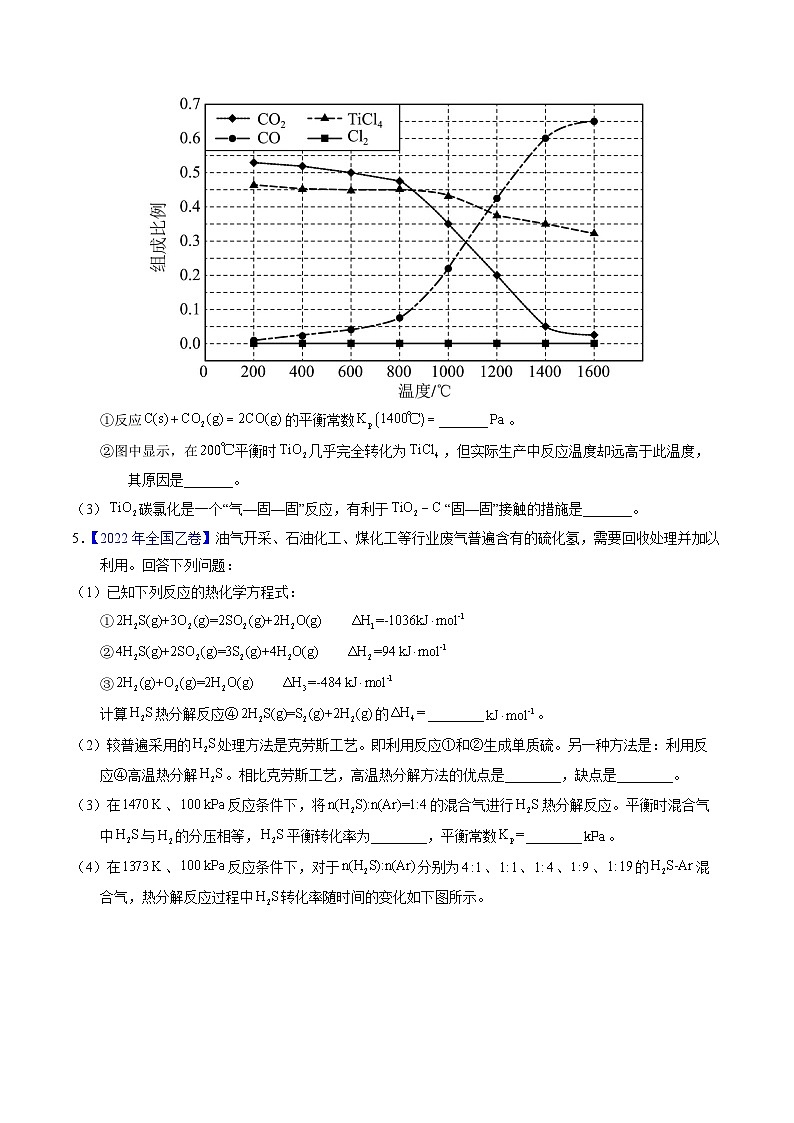
(2)在,将、C.以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应的平衡常数_______。
②图中显示,在平衡时几乎完全转化为,但实际生产中反应温度却远高于此温度,其原因是_______。
(3)碳氯化是一个“气—固—固”反应,有利于“固—固”接触的措施是_______。
【答案】(1) -223 1.2×1014 碳氯化反应气体分子数增加,∆H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程 向左 变小
(2) 7.2×105 为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
(3)将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
【解析】
(1)①根据盖斯定律,将“反应ⅱ-反应ⅰ”得到反应2C(s)+O2(g)=2CO(g),则∆H=-51kJ/ml-172kJ/ml=-223kJ/ml;则Kp===1.2×1014Pa;
②碳氯化的反应趋势远大于直接氯化,因为碳氯化反应气体分子数增加,∆H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变、且是吸热过程;
③对应碳氯化反应,气体分子数增大,依据勒夏特列原理,增大压强,平衡往气体分子数减少的方向移动,即平衡向左移动;该反应是放热反应,温度升高,平衡往吸热方向移动,即向左移动,则平衡转化率变小。
(2)①从图中可知,1400℃,体系中气体平衡组成比例CO2是0.05,TiCl4是0.35,CO是0.6,反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(1400℃)==Pa=7.2×105Pa;
②实际生产中需要综合考虑反应的速率、产率等,以达到最佳效益,实际反应温度远高于200℃,就是为了提高反应速率,在相同时间内得到更多的TiCl4产品。
(3)固体颗粒越小,比表面积越大,反应接触面积越大。有利于TiO2 – C“固-固”接触,可将两者粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”,增大接触面积。
5.【2022年全国乙卷】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
③
计算热分解反应④的________。
(2)较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是________,缺点是________。
(3)在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为________,平衡常数________。
(4)在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率________,理由是________。
②对应图中曲线________,计算其在之间,分压的平均变化率为________。
【答案】(1)170
(2) 副产物氢气可作燃料 耗能高
(3) 50% 4.76
(4) 越高 n(H2S):n(Ar)越小,H2S的分压越小,平衡向正反应方向进行,H2S平衡转化率越高 d 24.9
【解析】
(1)已知:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ/ml
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=94kJ/ml
③2H2(g)+O2(g)=2H2O(g) ΔH3=-484kJ/ml
根据盖斯定律(①+②)×-③即得到2H2S(g)=S2(g)+2H2(g)的ΔH4=(-1036+94)kJ/ml×+484kJ/ml=170 kJ/ml;
(2)根据盖斯定律(①+②)×可得2H2S(g)+O2(g)=S2(g)+2H2O(g) ΔH=(-1036+94)kJ/ml×=-314kJ/ml,因此,克劳斯工艺的总反应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质硫的同时还有氢气生成。因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解H2S会消耗大量能量,所以其缺点是耗能高;
(3)假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1ml和4ml,根据三段式可知:
平衡时H2S和H2的分压相等,则二者的物质的量相等,即1-x=x,解得x=0.5,所以H2S的平衡转化率为,所以平衡常数Kp==≈4.76kPa;
(4)①由于正反应是体积增大的可逆反应,n(H2S):n(Ar)越小,H2S的分压越小,相当于降低压强,平衡向正反应方向移动,因此H2S平衡转化率越高;
②n(H2S):n(Ar)越小,H2S平衡转化率越高,所以n(H2S):n(Ar)=1:9对应的曲线是d;根据图像可知n(H2S):n(Ar)=1:9反应进行到0.1s时H2S转化率为0.24。假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1ml和9ml,则根据三段式可知
此时H2S的压强为≈7.51kPa,H2S的起始压强为10kPa,所以H2S分压的平均变化率为=24.9kPa·s-1。
6.【2022年山东卷】利用丁内酯(BL)制备1,丁二醇(BD),反应过程中伴有生成四氢呋喃(THF)和丁醇(BuOH)的副反应,涉及反应如下:
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故压强近似等于总压。回答下列问题:
(1)以或BD为初始原料,在、的高压氛围下,分别在恒压容器中进行反应。达平衡时,以BL为原料,体系向环境放热;以BD为原料,体系从环境吸热。忽略副反应热效应,反应Ⅰ焓变_______。
(2)初始条件同上。表示某物种i的物质的量与除外其它各物种总物质的量之比,和随时间t变化关系如图甲所示。实验测得,则图中表示变化的曲线是_______;反应Ⅰ平衡常数_______(保留两位有效数字)。以BL为原料时,时刻_______,BD产率=_______(保留两位有效数字)。
(3)为达平衡时与的比值。、、三种条件下,以为初始原料,在相同体积的刚性容器中发生反应,随时间t变化关系如图乙所示。因反应在高压氛围下进行,可忽略压强对反应速率的影响。曲线A.B.c中,最大的是_______(填代号);与曲线b相比,曲线c达到所需时间更长,原因是_______。
【答案】(1)-200(X+Y)
(2) a或c 8.3×10-8 0.08 39%
(3) c 由于b和c代表的温度相同,而压强对反应速率的影响可忽略,压强增大反应Ⅱ、Ⅲ均是逆向移动,增大,故=1.0所需时间更长
【解析】
(1)依题意,结合已知信息,可推定在同温同压下,以同物质的量的BL或BD为初始原料,达到平衡时的状态相同,两个平衡完全等效。则以5.0×10-3ml的BL为原料,达到平衡时放出XkJ热量与同物质的量的BD为原料达到平衡时吸收YkJ热量的能量二者能量差值为(X+Y)kJ,则1ml时二者能量差值为200(X+Y)kJ,反应I为放热反应,因此焓变=-200(X+Y)kJ·ml-1。
(2)实验测定X0)。完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ ml/(L·min);该反应的平衡常数表达式K=_____
(2)上述反应达到平衡后,下列说法正确的是_____。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是__。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___(填“>”、“=”或“,此反应为放热反应,降低温度,平衡向正反应方向移动
(6)
【解析】
(1)由图可知第Ⅰ阶段,平衡时△c(A)=2ml/L-1ml/L=1ml/L,△c(B)=6ml/L-3ml/L=3ml/L,△c(C)=2ml/L,浓度变化量之比等于化学计量数之比,故a:b:c=1ml/L:3ml/L:2ml/L=1:3:2;
(2)vⅠ(A)=1/2=0.05ml/(L·min),vⅡ(A)=(1-0.62)/15=0.0253ml/(L·min),vⅢ(A)=(0.62-0.5)/10=0.012ml/(L·min),故A的平均反应速率vⅠ(A)>vⅡ(A)>vⅢ(A)。
(3) aI(B)=3ml/L/6ml/L×100%=50% ;aII(B)=(3-1.86)ml/L /3 ml/L×100%=38%;aIII(B)=(1.86-1.5)ml/L/1.86 ml/L =19%;所以B的平衡转化率aI(B)、aII(B)、aIII(B) 中最小的是aIII(B),其值是19%;
(4)由浓度曲线变化可知,由第一次平衡到第二次平衡,AB 的浓度减小,C的浓度增大,平衡正向移动;由于C的浓度由2.0ml/L变为0,所以采取的措施是分离出产物C;
(5)第II阶段的到第III阶段时,AB的浓度均减小,C的浓度增大,平衡正向移动,由于I、II、III阶段容器容积不变,且反应的∆H T3。
(6)由a:b:c=1ml/L:3ml/L:2ml/L=1:3:2可知,该反应A(g)+3B(g)2C(g);达到第三次平衡后,将容器的体积扩大一倍,相当于减压过程,各物质浓度先减小原来各自的一半,然后平衡向左移动,A、B的浓度再增大一些,而C的浓度再减小一些,具体变化过程如图:
。
23.(2014·浙江高考真题)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·ml-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·ml-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是 。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
【答案】(1)高温
(2)
(3)C.
(4) 反应I中生成有SO2,监测SO2与CO2的浓度增加量的比不为1:1,可确定发生两个反应。
(5)A、B、C
(6)
【解析】
(1)由△G=△H-T△S<0时自发,△H>0,则T要大,故选择高温。
(3)反应Ⅰ吸热,产物的能量高于反应物,反应Ⅱ放热,产物的能量低于反应物;反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),反应I的活化能低。
(4) 反应I中生成有SO2,监测SO2与CO2的浓度增加量的比即可确定是否发生两个反应。
(5)向该反应体系中投入石灰石,产生CO2,使反应I逆向进行,可降低该反应体系中SO2生成量,A正确;在合适的温度区间内控制较低的反应温度,图中可以看出最低温度的CaS的含量最高,故B正确、D错误;C.图中可以看出,提高CO的初始体积百分数,可以提高CaS的含量,故正确。
(6) 反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),故SO2增加的快,反应达到平衡快;随着反应II的进行,CO2的浓度不断增大,使反应I平衡逆向移动。
24.(2012·浙江高考真题)[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)CO2(g)+H2(g)的△H= kJ/ml。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
①若要达到H2物质的量分数>65%、CO的物质的量分数
相关试卷
这是一份专题54 化学平衡的建立与移动(B)-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用),文件包含专题54化学平衡的建立与移动B原卷卷docx、专题54化学平衡的建立与移动B解析卷docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
这是一份专题53 化学平衡的建立与移动(A)-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用),文件包含专题53化学平衡的建立与移动A原卷卷docx、专题53化学平衡的建立与移动A解析卷docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
这是一份专题52 化学反应速率-【真题汇编】最近10年(14-23年)高考化学真题分项汇编(全国通用),文件包含专题52化学反应速率原卷卷docx、专题52化学反应速率解析卷docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。









