











所属成套资源:【大单元核心素养】沪教版(全国)化学九年级下册课件+大单元教学设计+课后作业
- 【大单元整体教学】沪教版(全国)化学九年级下册 7.2 溶液组成的表示(课件+大单元教学设计+课后作业) 课件 5 次下载
- 【大单元整体教学】沪教版(全国)化学九年级下册7.3 饱和溶液和不饱和溶液(课件+大单元教学设计+课后作业) 课件 5 次下载
- 【大单元整体教学】沪教版(全国)化学九年级下册8.1 溶液的酸碱性(课件+大单元教学设计+课后作业) 课件 2 次下载
- 【大单元整体教学】沪教版(全国)化学九年级下册8.2 常见的酸和碱(课件+大单元教学设计+课后作业) 课件 1 次下载
- 【大单元整体教学】沪教版(全国)化学九年级下册8.3 中和反应(课件+大单元教学设计+课后作业) 课件 1 次下载
沪教版(2024)九年级下册(2024)第4节 物质的溶解性评优课教学作业ppt课件
展开
这是一份沪教版(2024)九年级下册(2024)第4节 物质的溶解性评优课教学作业ppt课件,文件包含大单元教学设计74物质的溶解性课件pptx、大单元教学设计74物质的溶解性教学设计doc、74物质的溶解性课后作业原卷版docx、74物质的溶解性课后作业解析版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1. 理解溶解性的概念,知道影响物质溶解性的因素,如温度、溶质和溶剂的性质等。2. 掌握通过实验探究物质溶解性的方法和步骤,能够准确记录和分析实验数据。3. 能够运用物质溶解性的知识,解释生活和生产中的相关现象,如物质的溶解、结晶等。
在我国某些盐碱湖可“冬天捞碱,夏天晒盐”,这里的碱是指碳酸钠,盐是指氯化钠。人们在冬天可以直接从湖中捞出碱,夏天可以取湖水晒盐。
为什么可以“冬天捞碱,夏天晒盐”?
新知导入
冬天捞碱 夏天晒盐
创设问题情境,引入新课
妈妈告诉我一个小妙招,用汽油可以洗掉衣服上的油渍。这是为什么呢?用了什么原理?
模块一 影响物质溶解性的因素
提出问题
定义:一种物质(溶质)溶解在某种溶剂中的能力,称为该物质的溶解性。提出问题:影响物质溶解性的因素有哪些呢?
影响物质溶解性的因素
1、在相同条件下,面粉在水中不易溶解,而食盐、蔗糖在水中易于溶解。
2、衣服上的油渍在水中很难洗去,而在汽油或酒精中易于洗去。
在日常生活中,我们常观察到这样的事实:
物质的溶解性和溶质性质有关。
物质的溶解性和溶剂性质有关。
物质的溶解性和温度有关。
【实验1】取2支试管,分别加入氯化钠、氢氧化钙各1g,再用量筒各量取5mL水,加入2支试管中。充分振荡后静置,观察物质的溶解情况。
观察到A试管中的氯化钠全部溶解,氢氧化钠几乎没有溶解,有很多固体剩余。
不同的物质在同一种溶剂中的溶解性不同。
【实验2】取2支试管,各加入少量固体碘,往试管中分别加入等体积的少量水和少量酒精,振荡,观察现象。
A试管中的碘几乎不溶解,B试管中的碘全部溶解,形成棕色碘的酒精溶液。
同一种物质在不同溶剂中的溶解性不同。
【实验3】取1支试管,加入3g硝酸钾,然后加入5mL水,充分振荡,硝酸钾是否能完全溶解?如不能完全溶解,将试管加热,观察发生的变化。
硝酸钾不能完全溶解,试管加热后,未溶的硝酸钾固体又逐渐溶解。
同一种物质在同一种溶剂中的溶解性与温度有关。
实验结论:(1)不同的物质在同一溶剂中的溶解性不同。如氯化钠可溶于水,而氢氧化钙则微溶于水。(2)同一种物质在不同溶剂中的溶解性不同。如碘较难溶于水,却易溶于酒精。(3)同一种物质在同一溶剂中的溶解性与温度有关。对于硝酸钾等多数物质,温度越高,其在水中的溶解能力越强。
一些固体物质(如硝酸钾)在水中的溶解性受温度的影响变化较大,而对于气体,除温度外,其他因素也会影响其在水中的溶解。
拓展:你知道干洗的原理吗?干洗剂是什么化学成分?呢绒、毛、丝绸等高级衣料用水洗会引起皱缩、变形和损伤,或不易洗净,故常采用干洗的方法。干洗剂是由易挥发的有机溶剂,表面活性剂和少量水(或不加水)及乳化剂组成的。有机溶剂的作用是溶解衣物上的油污(常用的有轻石油烃和氯代烃),表面活性剂能防止溶于溶剂的污垢微粒再沉积。干洗剂尽管对清洁油性污渍非常有效,但对水溶性污渍的去污效果却不明显。
例1、下列对“20℃时,硝酸钾溶解度为31.6g”的解释正确的是( )A.20℃时,31.6g硝酸钾溶解在水里达到饱和状态B.20℃时,100g水中溶解31.6g硝酸钾硝酸钾溶解在100g水中达到饱和状态D.20℃时,31.6g硝酸钾溶解在100g水中恰好达到饱和状态
【答案】D【解析】A、没有指明是否达到饱和状态。 B、不是100克溶液,是100克溶剂。C、没有指明温度,溶解度在一定温度下是不变的。D、符合溶解度的定义,正确。故选D。
例2、下列对物质溶解性的描述错误的是( )A.物质的溶解性有强有弱B.在一定条件下,一定量的溶剂中,物质不能无限地溶解C.溶解性大小只跟物质的性质有关,跟其他因素无关D.物质的溶解性是指一种物质在另一种物质中的溶解能力
【答案】C【解析】A、物质的溶解性有强有弱,强弱不同,如氯化钠易溶于水,碳酸钙难溶于水,故选项说法正确。B、在一定条件下,一定量的水中,物质不能够无限的溶解,故选项说法正确。C、溶解性大小只与物质的性质有关,跟其他因素有关,如温度,故选项说法错误。D、物质的溶解性是指一种物质在另一种物质中的溶解能力,故选项说法正确。故选C。
例3、一定温度下,向如图所示烧杯中加入一定质量的水,仅有部分品体溶解。所得溶液与原溶液相比,说法正确的是( )A.溶剂的质量增加,溶液颜色变浅B.溶质溶解度不变,溶液颜色变深C.溶质的质量增加,溶液颜色变深D.溶质溶解度不变,溶液颜色不变
【答案】A【解析】温度不变,向烧杯内加水后,部分硫酸铜晶体溶解,还有部分品体剩余,所得溶液还是原温度下的硫酸铜的饱和溶液,虽然溶液中溶剂的质量增加,溶质的质量增加,但溶液的溶质质量分数未变,故溶液颜色不变。故ABC三项说法错误。温度不变,硫酸铜的溶解度不变
模块二 物质溶解性的定量表示
物质的溶解度
概念:人们常用溶解度来定量描述物质的溶解性强弱。固体物质的溶解度是指在一定温度下,该物质在100g溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。溶解度一般用符号S表示。
20℃时几种固体物质在水中的溶解度
常温下(20℃)物质溶解度和溶解性的关系
人们根据常温下(20℃)物质在水中溶解度的不同,将物质分为易溶物、可溶物、微溶物和难溶物等。
注:难溶,习惯上称“不溶”,绝对不溶的物质是没有的。
同一种物质在水中的溶解度随温度的变化而变化,我们常用溶解度曲线来表示这种关系。怎样绘制溶解度曲线呢?
溶解度曲线
1.用实验方法测定不同温度时硝酸钾在水中的溶解度,并将实验数据记录下来,填表。
2.以温度为横坐标,以物质的溶解度为纵坐标,在坐标纸上标出不同温度下相应溶解度的点,再用光滑的曲线将这些点连接起来,即为该物质的溶解度曲线。
3.根据硝酸钾的溶解度曲线你能得到哪些信息?能否找到硝酸钾在 50℃、70℃时的溶解度?对应在曲线上可以找到一定温度的溶解度。
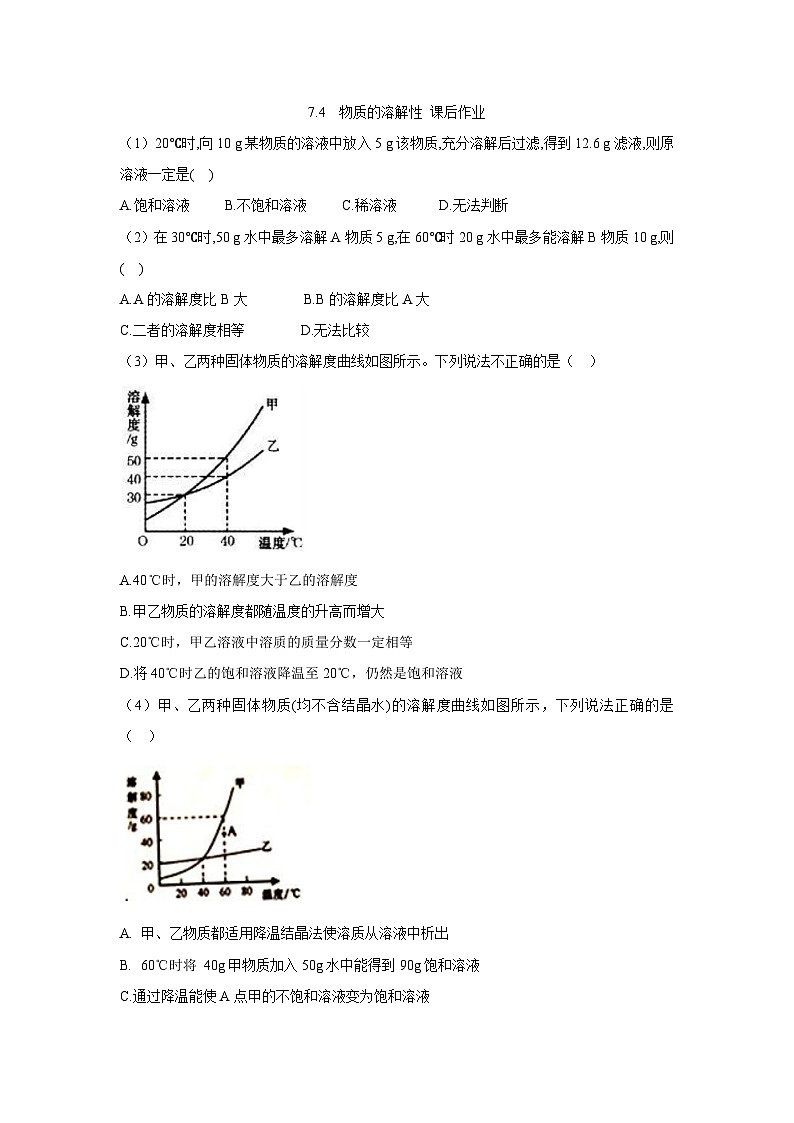
图1是几种固体物质的溶解度曲线图2是氢氧化钙的溶解度曲线。从图上的曲线你能得到什么信息?
P点的含义是什么?所对应的溶液是饱和溶液还是不饱和溶液?曲线上的点表示物质在对应温度下的溶解度。例图上P点表示:硝酸钠在40℃时溶解度为100克,对应的溶液为该温度下的饱和溶液。A点在曲线下方,表示这种物质在该温度下的不饱和溶液。
曲线以上区域的点所表示的溶液为饱和溶液且有未溶固体。曲线以下区域的点所表示的溶液为不饱和溶液。
曲线上的交点表示什么含义?表示在该温度下,两物质溶解度相等。例图上交点表示:硝酸钾和硝酸钠在70℃时溶解度相同。
溶解度曲线的应用:①利用溶解度曲线可以推测物质在不同温度下的溶解度数。②发现溶解度随温度变化的趋势。如硝酸钾的溶解度随温度升高而增大,氢氧化钙的溶解度则随温度升高而减小。而氯化钠的溶解度随温度的升高变化不大;③可以比较同一温度下不同物质的溶解度。如60℃时硝酸钠的溶解度大于硝酸钾的溶解度,80℃时则相反。
学以致用:根据固体物质的溶解度曲线,回答以下问题。
1.多数固体物质的溶解度随温度变化具有怎样的变化规律?随温度升高而增大:大部分固体物质符合这一规律,如硝酸钾、硝酸钠等,其溶解度曲线呈“陡升型”。受温度影响较小:少数固体物质的溶解度受温度影响不大,如氯化钠,其溶解度曲线为“缓升型”。随温度升高而减小:极少数固体物质的溶解度随温度升高而减小,如氢氧化钙,其溶解度曲线呈“下降型”。
陡升型:例硝酸钾 缓升型:例氯化钠下降型:例氢氧化钙
2.图一中溶解度受温度影响最大与最小的物质分别是什么?①溶解度受温度影响最大的物质:可以判断斜率越大,溶解度受温度影响越大。随着温度的升高,硝酸铵的溶解度迅速增加,所以溶解度受温度影响最大的物质是硝酸铵。②溶解度受温度影响最小的物质:氯化钠的溶解度曲线斜率最小。温度变化时,氯化钠的溶解度变化不明显,溶解度受温度影响最小的物质是氯化钠。
3.在 0℃时,图一中几种物质的溶解度由小到大的顺序是怎样的?由图片可知,在0℃时,几种物质的溶解度由小到大的顺序是:硝酸钾<氯化钾<氯化铵<硝酸钠<硝酸钠<硝酸铵
4.30℃时,硝酸钾的溶解度大约是多少?80℃时,140g硝酸钠溶于100g水中形成的溶液是否为饱和溶液?根据图片可知,30℃时,硝酸钾的溶解度大约是45g。根据图片可知,100g水中硝酸钠的溶解度为180g,所以140g硝酸钠溶于100g水中形成的溶液不是为饱和溶液。
对于溶解度的应用
在生产和科研中,人们可以利用溶解度曲线找到有利于物质溶解和结品的温度区域,分析不同温度下溶液是否饱和,还能依据曲线变化计算溶解和结晶的量。
实际应用
如图,配制不饱和溶液。随着温度下降,溶质的溶解度减小,至60℃时形成饱和溶液②。当温度继续下降时,溶解度也进一步减小,晶体不断析出,依次经历状态③和④。通过对溶解度曲线的分析,人们可以选择科学、合理的方法控制晶体的析出。
氯化钠的溶解度随温度变化不大,因此采用蒸发结晶的方法进行粗盐的提纯。
晒盐 熬盐
对于溶解能力受温度变化影响较大的固态物质(如硝酸钾),还可以用冷却热的饱和溶液的方法,使溶质从溶液中结晶析出。
过滤水中混有的泥沙颗粒
例5、20℃时,1千克水中溶解50克A物质恰好达饱和,则A在水中的溶解性等级为( )A、易溶B、可溶C、微溶D、难溶
【答案】B【解析】在一定温度下,某固体物质在100g溶剂里达到饱和状态是所溶解的质量为(溶解性是由20°0时某物质的溶解度决定的):1、难溶或不溶:
相关课件
这是一份初中第3节 饱和溶液和不饱和溶液一等奖教学作业课件ppt,文件包含大单元教学设计73饱和溶液和不饱和溶液课件共49张PPT内嵌视频pptx、大单元教学设计73饱和溶液和不饱和溶液教学设计doc、73饱和溶液和不饱和溶液课后作业原卷版docx、73饱和溶液和不饱和溶液课后作业解析版docx等4份课件配套教学资源,其中PPT共46页, 欢迎下载使用。
这是一份初中化学沪教版(2024)九年级下册(2024)第2节 溶液组成的表示获奖教学作业ppt课件,文件包含大单元教学设计72溶液组成的表示课件pptx、大单元教学设计72溶液组成的表示课后作业原卷版docx、大单元教学设计72溶液组成的表示教学设计doc、大单元教学设计72溶液组成的表示课后作业解析版docx等4份课件配套教学资源,其中PPT共53页, 欢迎下载使用。
这是一份沪教版(2024)九年级下册(2024)第1节 物质在水中的溶解优质教学作业课件ppt,文件包含大单元教学设计71物质在水中的溶解课件共56张PPT内嵌视频pptx、大单元教学设计71物质在水中的溶解课后作业原卷版docx、大单元教学设计71物质在水中的溶解教学设计doc、大单元教学设计71物质在水中的溶解课后作业解析版docx等4份课件配套教学资源,其中PPT共53页, 欢迎下载使用。











